Gujarat Board GSEB Textbook Solutions Class 12 Chemistry Chapter 11 આલ્કોહૉલ, ફિનોલ અને ઇથર સંયોજનો Textbook Questions and Answers.
Gujarat Board Textbook Solutions Class 12 Chemistry Chapter 11 આલ્કોહૉલ, ફિનોલ અને ઇથર સંયોજનો
GSEB Class 12 Chemistry આલ્કોહૉલ, ફિનોલ અને ઇથર સંયોજનો Text Book Questions and Answers
પ્રશ્ન 1.
નીચે દર્શાવલા સંયોજનોના IUPAC નામ લખો :
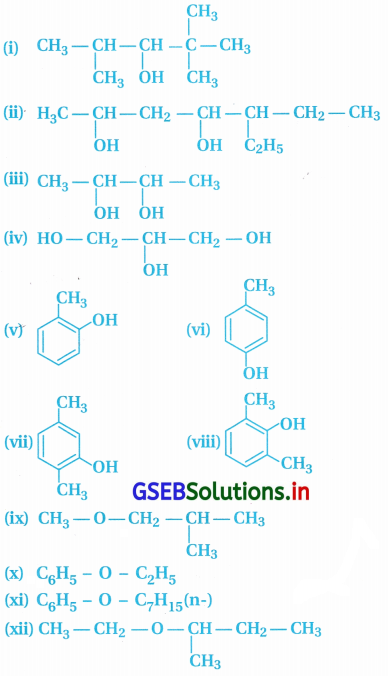
ઉત્તર:

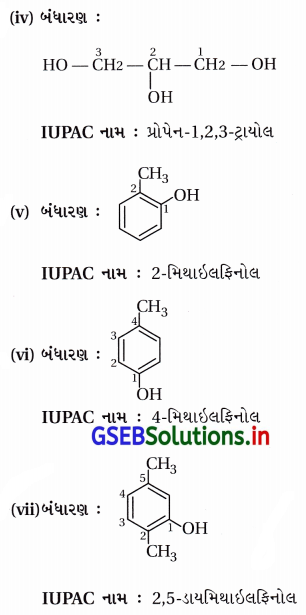
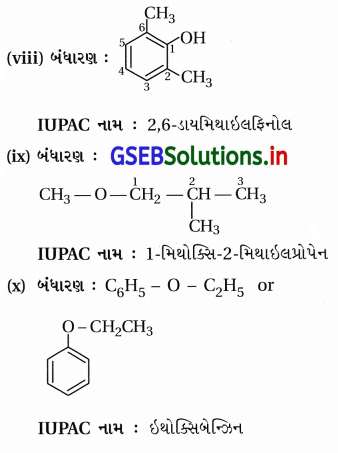
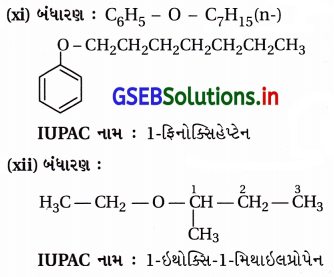
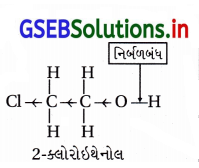
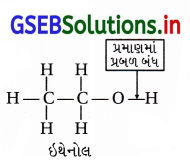
![]()
પ્રશ્ન 2.
નીચે દર્શાવેલા IUPAC નામ ધરાવતા સંયોજનોના બંધારણો લખો :
(i) 2-મિથાઇલબ્યુટેન-2-ઑલ
(ii) 1-ફિનાઇલપ્રોપેન-2-ઑલ
(iii) 3,5-ડાયમિથાઇલહેકઝેન-1,3,5-ટ્રાયોલ
(iv) 2,3-ડાયઇથાઇલફિનોલ
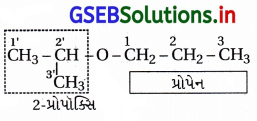
(v) 1-ઇથોક્સિપ્રોપેન
(vi) 2-ઇથોક્સિ-3-મિથાઇલપેન્ટેન
(vii) સાયક્લોહેકઝાઇલમિથેનોલ
(viii) 3-સાયક્લોહેકઝાઇલપેન્ટેન-3-ઑલ
(x) સાયક્લોપેન્ટ-3-ઇન-1-ઑલ
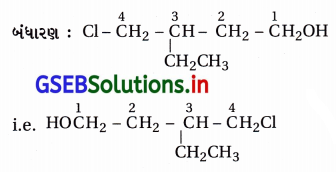
(x) 4-ક્લોરો-3-ઇથાઇલબ્યુટેન-1-ઑલ
ઉત્તર:
(i) IUPAC નામ : 2-મિથાઇલબ્યુટેન-2-ઑલ
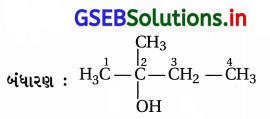
(ii) IUPAC નામ : 1-ફિનાઇલપ્રોપેન-2-ઑલ
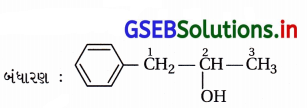
(iii) IUPAC નામ : 3,5-ડાયમિથાઇલહેક્ઝેન-1,3,5-ટ્રાયોલ
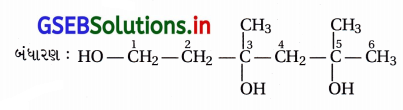
(iv) IUPAC નામ : 2,3-ડાયઇથાઇલફિનોલ
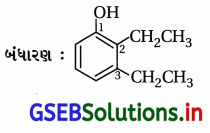
(v) IUPAC નામ : 1-ઇથોક્સિપ્રોપેન
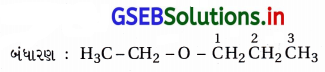
(vi) IUPAC નામ : 2-ઇથોક્સિ-3-મિથાઇલપેન્ટેન
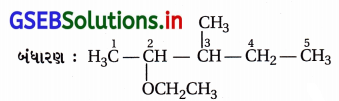
(vii) IUPAC નામ : સાયક્લોહેક્ઝાઇલમિથેનોલ
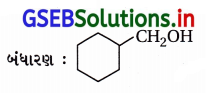
(viii) IUPAC નામ : 3-સાયક્લોહેક્ઝાઇલપેન્ટેન-3-ઑલ
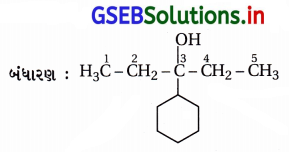
(ix) IUPAC નામ : સાયક્લોપેન્ટ-3-ઇન-1-ઑલ
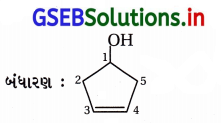
(x) IUPAC નામ : 4-ક્લોરો-3-ઇથાઇલબ્યુટેન-1-ઑલ
પ્રશ્ન 3.
(i) C5H12O આણ્વીયસૂત્રવાળા બધા સમઘટકીય આલ્કોહોલ સંયોજનોનાં બંધારણો દોરો અને તેમના IUPAC નામ લખો.
(ii) પ્રશ્ન 11.3 (i)માંના આલ્કોહોલ સમઘટકોને પ્રાથમિક, દ્વિતીયક અને તૃતીયક આલ્કોહોલ સંયોજનોમાં વર્ગીકૃત કરો.
ઉત્તર:
(i) C5H12O આણ્વીયસૂત્રવાળા આલ્કોહૉલ એટલે C5H11OH (પેન્ટેનોલ)ના ભિન્ન સમઘટકોનાં બંધારણો અને IUPAC નામ તથા પ્રકાર (1°,2°,3°) નીચે પ્રમાણે છે. તેમાં કુલ 8 સમઘટકો છે જેમાં ચાર (1°) ત્રણ 2° અને એક ૩° આલ્કોહૉલ.
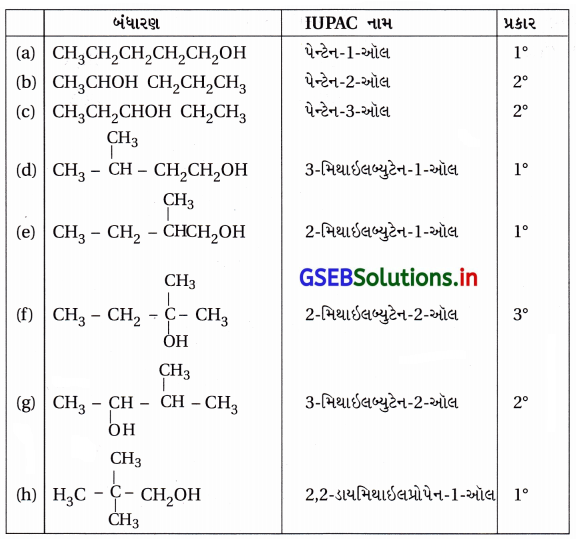
(ii) જવાબ માટે જુઓ ઉપરના કોષ્ટકમાં
![]()
પ્રશ્ન 4.
સમજાવો કે પ્રોપેનોલનું ઉત્કલનબિંદુ શા માટે હાઇડ્રોકાર્બન બ્યુટેન કરતાં ઊંચું હોય છે ?
ઉત્તર:
| પ્રોપેનોલ (C3H7OH) | બ્યુટેન (C4H10) |
| આણ્વીયદળ : 60 g mol-1 આણ્વીયદળ વધારે છે. | આણ્વીયદળ : 58 g mol-1 આણ્વીયદળ ઓછું છે. |
| સૂત્ર : C3H7OH | સૂત્ર : C4H10 |
તેમાં -OH સમૂહ ધ્રુવીય છે અને પ્રોપેનોલના ભિન્ન અણુઓની વચ્ચે નીચે પ્રમાણે આંતરઆણ્વીય હાઇડ્રોજન બંધ બને છે.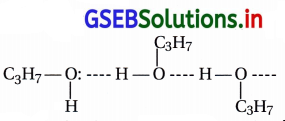 પ્રોપેનોલમાં આંતરઆણ્વીય હાઇડ્રોજન બંધ હોવાથી તેનું ઉત્કલનબિંદુ બ્યુટેનના કરતાં વધારે હોય છે. |
તે હાઇડ્રોકાર્બન છે. ∴ તેમાં ભિન્ન અણુ વચ્ચે નિર્બળ આંતરઆણ્વીય વાન્ ડર વાલ્સ બળો છે ∴ તેનું ઉત્કલનબિંદુ પ્રોપેનોલના કરતાં ઓછું છે. |
ઉપરનાં કારણોથી પ્રોપેનોલનું ઉત્કલનબિંદુ બ્યુટેનના કરતાં ઊંચું હોય છે.
પ્રશ્ન 5.
આલ્કોહોલ સંયોજનોની દ્રાવ્યતા તેમને સમાન મોલરદળ ધરાવતા હાઇડ્રોકાર્બન સંયોજનો કરતાં વધુ હોય છે. આ સત્યને સમજાવો.
ઉત્તર:
(a) આલ્કોહૉલ પાણીમાં દ્રાવ્ય : આલ્કોહૉલ અને પાણી તે બંનેમાં -OH છે અને આલ્કોહૉલના ઑક્સિજન તેમજ હાઇડ્રોજન પરમાણુની સાથે પાણીના અનુક્રમે હાઇડ્રોજન તથા ઑક્સિજન પરમાણુઓ હાઇડ્રોજન બંધ બનાવીને જોડાય છે. આ H-બંધમાં મુક્ત થતી ઊર્જા આલ્કોહૉલનાં આંતરઆણ્વીય બળો કરતાં પ્રબળ હોવાથી આલ્કોહૉલ સંયોજનો પાણીમાં દ્રાવ્ય છે.
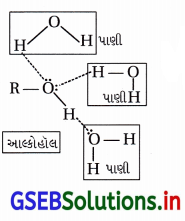
(b) હાઇડ્રોકાર્બન પાણીમાં અદ્રાવ્ય : હાઇડ્રોકાર્બનમાં બધાં જ C-H અને C-C બંધ હોય છે, જેથી તેઓ H2Oની સાથે H-બંધ રચી શકતા નથી અને પાણીમાં અદ્રાવ્ય હોય છે.
પ્રશ્ન 6.
હાઇડ્રોબોરેશન-ઓક્સિડેશન પ્રક્રિયા એટલે શું ? તેને ઉદાહરણ આપી સમજાવો.
ઉત્તર:
(a) બનાવટ : હાઇડ્રોબોરેશન-ઑક્સિડેશન પ્રક્રિયા એટલે – ડાયબોરેન (BH3)2ની આલ્કીન સંયોજનો સાથે પ્રક્રિયા કરવાથી બનતી યોગશીલ નીપજ ટ્રાયઆલ્કાઇલ બોરેનનું જલીય સોડિયમ હાઇડ્રૉક્સાઇડની હાજરીમાં હાઇડ્રોજન પેરૉક્સાઇડ વડે આલ્કોહૉલમાં ઑક્સિડેશન કરવાની પ્રક્રિયા. ઉદાહરણ નીચે મુજબ આપેલ છે.
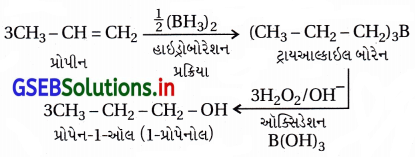
આ અંતિમ નીપજ આલ્કોહૉલ બને છે જેમાં આલ્કીનમાં H2Oનું ઉમેરણ ઍન્ટિમાર્કોવનિકોવ પ્રમાણે છે.
(b) ક્રિયાવિધિ : ડાયબોરેન તે (BH3)2 દા.ત., [B2H6] છે. વિદ્યુતઋણતા બોરોન (2.0) અને હાઇડ્રોજન (2.1) છે, જેથી બોરોન હાઇડ્રોજનબંધ ધ્રુવીય (Bδ+ – Hδ-) છે. પરિણામે અસમમિત આલ્કીનના દ્વિબંધ ધરાવતા કાર્બન ઉપર માર્કોવનિકોવ નિયમ પ્રમાણે BH3 ઉમેરીને ટ્રાયઆલ્કાઇલ બોરેન બને છે. “આમાં બોરોન પરમાણુ વધારે હાઇડ્રોજન પરમાણુઓ ધરાવતા sp2 કાર્બન સાથે જોડાય છે.”
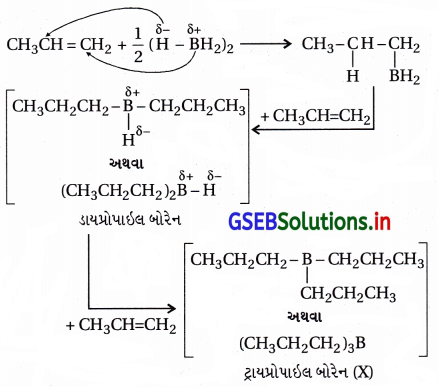
યોગશીલ પ્રક્રિયાથી નીપજતો ટ્રાયઆલ્કાઇલ બોરેનનું જલીય સોડિયમ હાઇડ્રૉક્સાઇડની હાજરીમાં હાઇડ્રોજન પેરૉક્સાઇડ વડે ઑક્સિડેશન થઈને આલ્કોહૉલ બને છે.
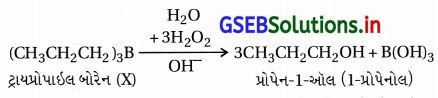
આ રીતે બનેલો આલ્કોહૉલ એવો હોય છે કે, જેમાં આલ્કીન સંયોજનમાં પાણીનો અણુ, માર્કોવનિકોવના નિયમથી વિપરીત યોગશીલ પ્રક્રિયાથી બનેલો હોય છે.
નોંધ : હાઇડ્રોબોરેશન-ઑક્સિડેશન સૌપ્રથમ 1959માં એચ.સી. બ્રાઉન દ્વારા રજૂ કર્યું અને તેમને 1979માં નૉબેલ પારિતોષિક મળ્યું.
પ્રશ્ન 7.
C7H8O આણ્વીયસૂત્રવાળા મોનોહાઇડ્રિક ફિનોલ સંયોજનોના બંધારણો અને તેમના IUPAC નામ લખો.
ઉત્તર:
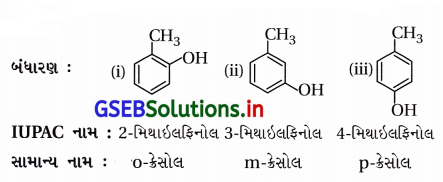
![]()
પ્રશ્ન 8.
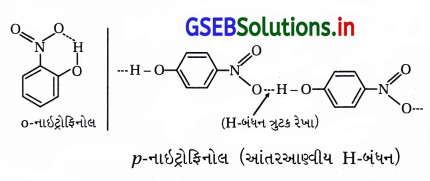
ઓર્થો અને પેરા નાઇટ્રોફિનોલ સંયોજનોના મિશ્રણને વરાળ નિસ્યંદનથી અલગ કરતાં જે સમઘટક વરાળ બાષ્પશીલ બનશે તેનું નામ જણાવો. આ માટેનું કારણ જણાવો.
ઉત્તર:
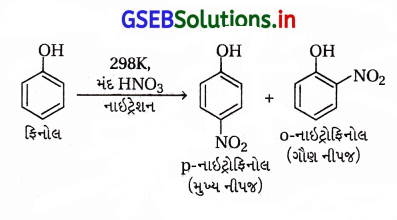
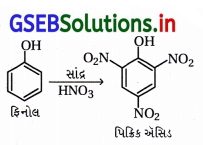
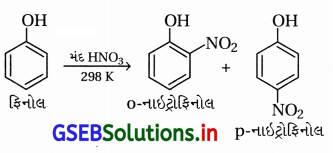
(i) ફિનોલનું મંદ HNO3 વડે નાઇટ્રેશન કરવાથી ૦-નાઇટ્રોફિનોલ અને p-નાઇટ્રોફિનોલનું મિશ્રણ મળે છે.
(ii) આ નાઇટ્રોફિનોલના મિશ્રણના ઘટકોને વરાળ નિસ્યંદન પતિથી છૂટા પાડવામાં આવે છે.
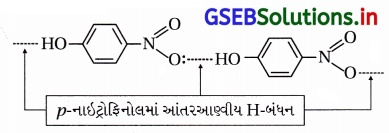
(iii) o- અને p-નાઇટ્રોફિનોલના મિશ્રણનું વરાળ નિસ્યંદન કરવાથી ૦-નાઇટ્રોફિનોલ પાણીની વરાળની સાથે નિસ્યંદન પામી છૂટો પડે છે અને p-નાઇટ્રોફિનોલ વરાળ નિસ્યંદન પામ્યા સિવાયનો રહી જાય છે.
(iv) o-નાઇટ્રોફિનોલમાં આંતઃઆણ્વીય હાઇડ્રોજન બંધન હોવાથી તે વરાળ નિસ્યંદનમાં વરાળની સાથે બાષ્પશીલ બને છે અને છૂટો પડે છે.
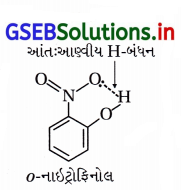
p-નાઇટ્રોફિનોલ વરાળ નિસ્યંદનની ક્રિયામાં ઓછું બાષ્પશીલ હોવાથી ફ્લાસ્કમાં બાષ્પશીલ બન્યા સિવાયનો રહી જાય છે, કારણ કે p-નાઇટ્રોફિનોલમાં આંતરઆણ્વીય H-બંધન હોય છે. જે નીચે મુજબ દર્શાવેલ છે.
પ્રશ્ન 9.
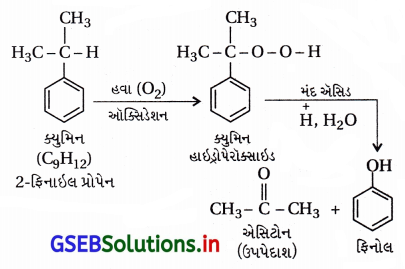
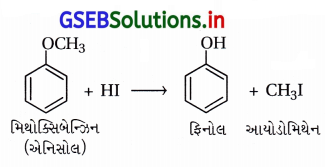
ક્યુમિનમાંથી ફિનોલ બનાવવાની પ્રક્રિયાનું સમીકરણ જણાવો.
ઉત્તર:
ક્યુમિન (આઇસોપ્રોપાઇલ બેન્ઝિન)માંથી ફિનોલ : વિશ્વમાં ફિનોલનું મોટાભાગનું ઉત્પાદન ક્યુમિનમાંથી થાય છે.
પ્રશ્ન 10.
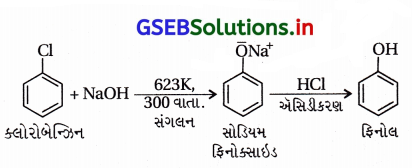
ક્લોરોબેઝિનમાંથી ફિનોલ બનાવવાની રાસાયણિક પ્રક્રિયા લખો.
ઉત્તર:
(i) ક્લોરોબેન્ઝિન (હેલોએરિન)માંથી ફિનોલ :
પ્રશ્ન 11.
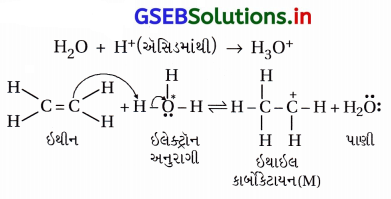
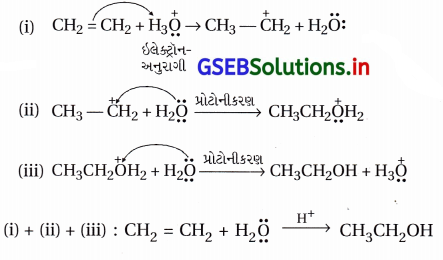
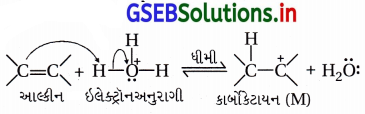
ઇથેનોલ મેળવવા માટે ઇથીનના જલીયકરણની ક્રિયાવિધિ લખો.
ઉત્તર:

(b) ક્રિયાવિધિ : આ પ્રક્રિયા નીચેના ત્રણ તબક્કામાં પૂર્ણ થાય છે. આ પ્રક્રિયાની ક્રિયાવિધિ ઇલેક્ટ્રૉનઅનુરાગી યોગશીલ છે.
તબક્કો-1 : ઉદ્દીપક ઍસિડની હાજરીમાં પાણીમાંથી ઇલેક્ટ્રૉન- અનુરાગી H3O+ બને છે, જે ઇથીન ઉપર હુમલો કરીને કાર્બોકેટાયન CH3\(\stackrel{+}{\mathrm{C}} \mathrm{H}_2\) રચે છે.
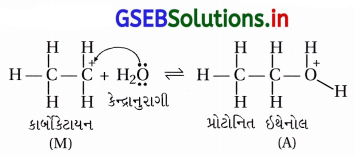
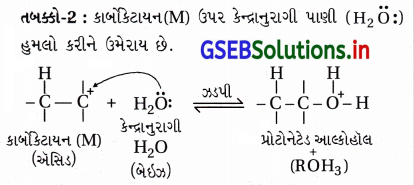
તબક્કો-2 : કાર્બોકેટાયનની ઉપર કેન્દ્રાનુરાગી H2O હુમલો કરીને પ્રોટોનિત ઇથેનોલ બનાવે છે.
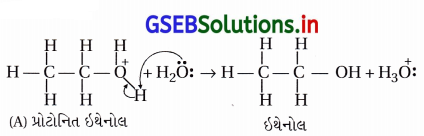
તબક્કો-3 : પ્રોટોનિત ઇથેનોલનું વિપ્રોટૉનીકરણ થઈને ઇથેનોલ બને છે.
ટૂંકમાં આ ક્રિયાવિધિ નીચે પ્રમાણે છે.
પ્રશ્ન 12.
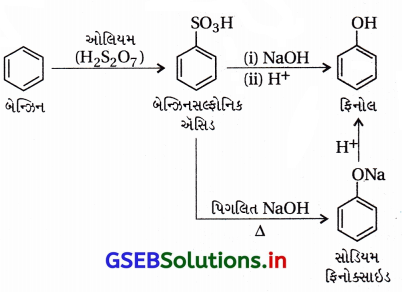
તમને બેઝિન, સાંદ્ર HSO4 અને NaOH આપેલા છે. આ પ્રક્રિયકોના ઉપયોગ દ્વારા ફિનોલ બનાવવાનું સમીકરણ લખો.
ઉત્તર:
બેઝિનમાંથી ફિનોલ :
![]()
પ્રશ્ન 13.
તમે નીચે દર્શાવેલા સંશ્લેષણ કેવી રીતે કરશો તે દર્શાવો :
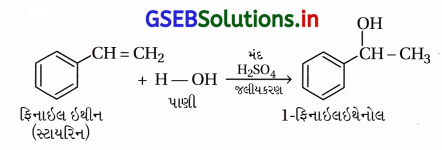
(i) એક યોગ્ય આલ્કીનમાંથી 1-ફિનાઇલઇથેનોલ
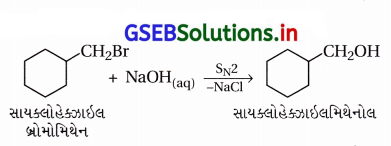
(ii) SN2 પ્રક્રિયા દ્વારા આલ્કાઇલ હેલાઇડના ઉપયોગથી સાયક્લોહેક્ઝાઇલ મિથેનોલ
(iii) એક યોગ્ય આલ્કાઇલ હેલાઇડના ઉપયોગથી પેન્ટેન-1-ઑલ
ઉત્તર:
(i) યોગ્ય આલ્કીનમાંથી-1-ફિનાઇલઇથેનોલ : સ્ટાયરિનનું જલીયકરણ મંદ ઍસિડની હાજરીમાં કરતાં તે બને છે.
(ii) SN2 પ્રક્રિયા દ્વારા આલ્કાઇલ હેલાઇડના ઉપયોગથી સાયક્લોહેક્ઝાઇલ મિથેનોલ : નીચેની પ્રક્રિયામાં 1°-હેલાઇડના Br– નું કેન્દ્રાનુરાગી –OH વડે વિસ્થાપન થાય છે.
(iii) યોગ્ય આલ્કાઇલ હેલાઇડના ઉપયોગથી પેન્ટેન-1-ઑલ : 1°-આલ્કાઇલ હેલાઇડ (CH3CH2CH2CH2CH2Br)ની કેન્દ્રાનુરાગી –OH(NaOH)સાથે SN2 પ્રક્રિયાથી પેન્ટેન-1-ઑલ બને.

પ્રશ્ન 14.
ફિનોલનો ઍસિડિક સ્વભાવ દર્શાવતી બે પ્રક્રિયાઓ લખો. ફિનોલની ઍસિડિક્તાની સરખામણી ઇથેનોલની ઍસિડિકતા સાથે કરો.
ઉત્તર:
નીચેની પ્રક્રિયાઓમાં ફિનોલ પ્રોટૉનદાતા, બ્રોન્સ્ટેડ ઍસિડ છે.
(a) ફિનોલનો ઍસિડિક સ્વભાવ દર્શાવતી બે પ્રક્રિયાઓ :
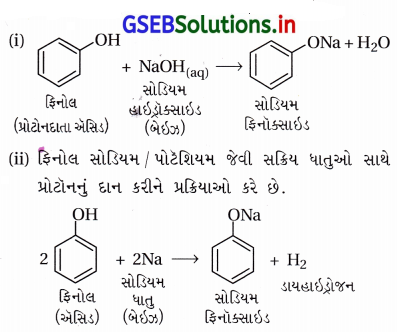
(b) ફિનોલની ઑસિડિકતાની સરખામણી ઇથેનોલની ઍસિડિકતાની સાથે : ફિનોલની ઍસિડિકતા ઇથેનોલના કરતાં વધારે છે.
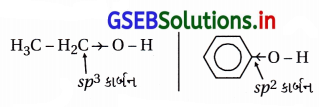
(i) ફિનોલની pKa (10.0) અને ઇથેનોલની pKa (15.9) છે. એટલે કે ઇથેનોલના કરતાં ફિનોલ વધારે ઍસિડિક છે.
(ii) ફિનોલ જલીય NaOHની સાથે પ્રક્રિયા કરે છે, પણ ઇથેનોલ નથી કરતો જે દર્શાવે છે કે ફિનોલ વધારે ઍસિડિક છે.
(iii) ફિનોલ વધારે ઍસિડિક છે, તેમાં O-H બંધ સરળતાથી તૂટી પાણીમાં આયનીકરણ પામી ફિનૉક્સાઇડ આયન રચે છે.
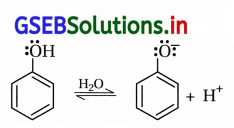
આલ્કોહૉલનું પાણીમાં આયનીકરણ લગભગ H+ રચતું નથી.
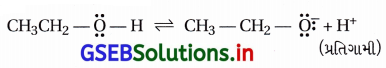
(iv) સસ્પંદનથી ફિનોલના સાપેક્ષ ફિનૉક્સાઇડ વધારે સ્થાયી છે અને ફિનોલમાં -OH સાથેનો કાર્બન sp2 હોવાથી ફિનોલ ઍસિડિક છે પણ આલ્કોહૉલ (ઇથેનોલ)માં -OH સાથેનો કાર્બન sp3 છે. વળી, ઇથૉક્સાઇડ (CH3CHO–) સત્પંદન સ્થાયી ન હોવાથી ઇથેનોલ ઘણો જ નિર્બળ ઍસિડ છે; ઇથેનોલ, ફિનોલ અને પાણીના કરતાં નિર્બળ ઍસિડ છે.
પ્રશ્ન 15.
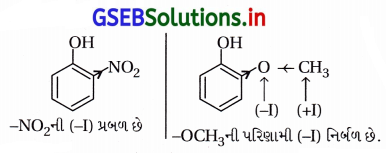
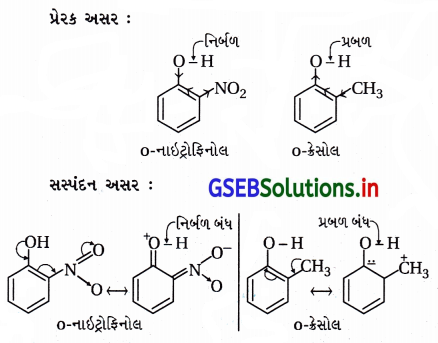
સમજાવો કે ઑર્થો નાઇટ્રોફિનોલ શા માટે ઑથો મિથોક્સિફિનોલ કરતાં વધુ ઍસિડિક છે ?
ઉત્તર:
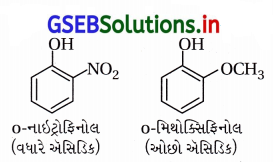
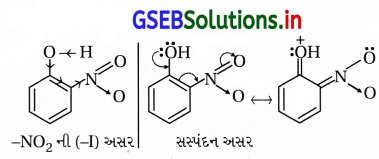
(a) પ્રેરક અસર : નાઇટ્રો અને મિથોક્સિ બંને પ્રેરક અસરમાં
ઇલેક્ટ્રૉન આકર્ષણ-(-I) છે પણ નાઇટ્રોસમૂહ વધારે પ્રબળ ઇલેક્ટ્રૉન આકર્ષક છે જેથી o-નાઇટ્રોફિનોલ ૦-મિથોક્સિફિનોલ કરતાં વધુ ઍસિડિક છે.
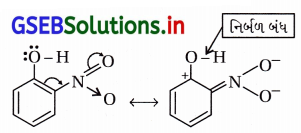
(b) સસ્પંદન અસર : સસ્પંદનમાં -NO2 વલયમાંના ઇલેક્ટ્રૉનયુગ્મને બહાર ખેંચી O – H બંધ નિર્બળ બનાવે છે.
∴ પ્રોટૉનદાતા ક્ષમતા વધારે અને વધારે ઍસિડિક છે . –OCH3 સમૂહ સસ્પંદનમાં ઑક્સિજન ઉપરનું ઇલેક્ટ્રૉનયુગ્મ આપે છે. જેથી O – H બંધ પ્રબળ બની ઍસિડિકતા ઘટે છે.
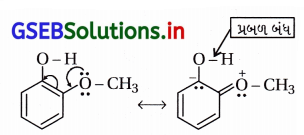
∴ પ્રોટૉનદાતા ક્ષમતા ઓછી અને ઓછો ઍસિડિક છે.
પ્રશ્ન 16.
સમજાવો કે બેન્ઝિન વલયના કાર્બન સાથે જોડાયેલો -OH સમૂહ બેન્ઝિન વલયને ઇલેક્ટ્રોનઅનુરાગી વિસ્થાપન પ્રત્યે કેવી રીતે સક્રિય કરે છે ?
ઉત્તર:
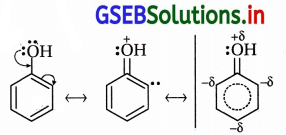
ફિનોલમાં બેઝિન વલયના કાર્બનની સાથે જોડાયેલું -OH સમૂહ છે. ફિનોલમાં -OH સમૂહ બેન્ઝિન વલયને ઇલેક્ટ્રૉન અનુરાગી વિસ્થાપન પ્રક્રિયાઓ માટે સક્રિયતાકારક છે.
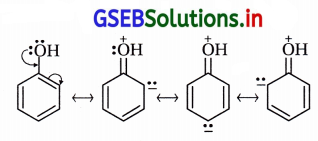
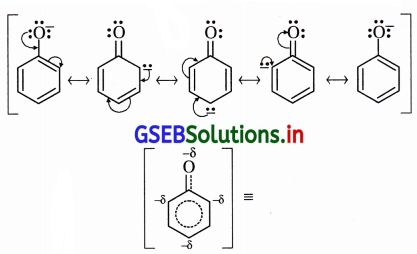
-OH સમૂહના ઑક્સિજન ઉપર અબંધકા૨ક ઇલેક્ટ્રૉનયુગ્મો છે અને સત્પંદનમાં ઑક્સિજન ઉપરનું અબંધકારક ઇલેક્ટ્રૉનયુગ્મ વલયમાં સ્થળાંતર પામે જે નીચેના સસ્પંદન બંધારણોથી સ્પષ્ટ છે.
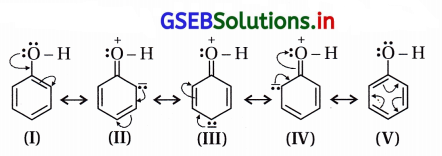
આ બંધારણો સ્પષ્ટ કરે છે કે વલયમાં ઑર્થો અને પૅરા સ્થાનોમાં ઋણભાર છે. “ફિનોલમાં વલય ઇલેક્ટ્રૉનધનિક છે, વલયમાં ઇલેક્ટ્રૉન ઘનતા વધારે છે. આના પરિણામે ઇલેક્ટ્રૉનઅનુરાગી પ્રક્રિયક સરળતાથી, ઝડપથી હુમલો કરી પ્રક્રિયાઓ કરે છે. આમ, બેન્ઝિન વલયના કાર્બનની સાથે જોડાયેલ -OH સમૂહ બેન્ઝિન વલયને ઇલેક્ટ્રૉનઅનુરાગી વિસ્થાપન પ્રક્રિયાઓ માટે સક્રિય કરે છે.
![]()
પ્રશ્ન 17.
નીચે દર્શાવલી પ્રક્રિયાઓ માટે સમીકરણો લખો :
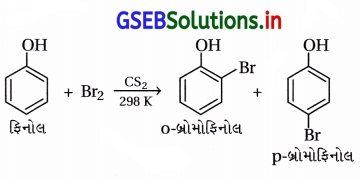
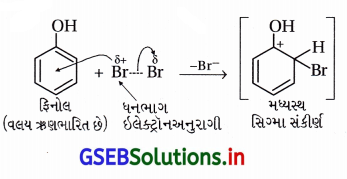
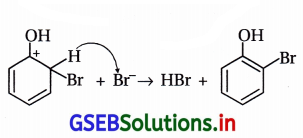
(i) પ્રોપેન-1-ઓલનું આલ્કલાઇન KMnO4ના દ્રાવણ સાથે ઑક્સિડેશન
(ii) CS2માં રહેલા બ્રોમીનની ફિનોલ સાથે પ્રક્રિયા
(iii) મંદ HNO3ની ફિનોલ સાથે પ્રક્રિયા
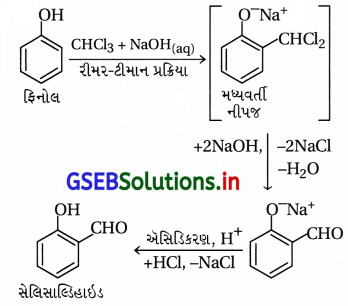
(iv) ફિનોલની જલીય NaOHની હાજરીમાં ક્લોરોફોર્મ સાથે પ્રક્રિયા
ઉત્તર:
(i) પ્રોપેન-1-ઑલનું આલ્કલાઇન KMnO4 વડે ઑક્સિડેશન કરતાં ઃ પ્રક્રિયક આલ્કલાઇન KMnO4 પ્રબળ ઑક્સિડેશનકર્તા હોવાથી સીધો જ કાર્બોક્સિલિક ઍસિડ બને છે.

(ii) CS2માં રહેલા બ્રોમીનની ફિનોલ સાથે પ્રક્રિયા : CS2 જેવા ઓછા ધ્રુવીય દ્રાવકમાં પ્રબળ ઇલેક્ટ્રૉનઅનુરાગી Br+ બનતો નથી અને મોનોબ્રોમિનેશન થાય છે. SE2 ઍરોમેટિક પ્રક્રિયા થાય છે.
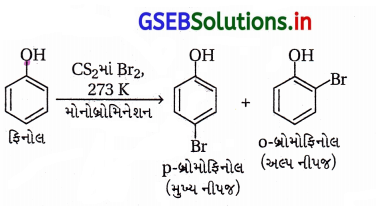
(iii) મંદ HNO3ની ફિનોલ સાથે પ્રક્રિયા : ફિનોલનું -OH સમૂહ પ્રબળ સક્રિયતાકારક છે તેથી મંદ HNO3 પણ ફિનોલનું મોનોનાઇટ્રેશન કરે છે, વળી -OH સમૂહની ઑર્થો + પૅરા સ્થાનનિર્દેશક અસરના કારણે -NO2 સમૂહ -OHના ઑર્થો અને પૅરા સ્થાને જોડાય છે.
(iv) ફિનોલની જલીય NaOHની હાજરીમાં ક્લોરોફૉર્મ સાથે પ્રક્રિયા :
પ્રશ્ન 18.
નીચે દર્શાવલને ઉદાહરણ સહિત સમજાવો :
(i) કોલ્લે પ્રક્રિયા
(ii) રીમર-ટીમાન પ્રક્રિયા
(iii) વિલિયમસન ઈથર સંશ્લેષણ
(iv) અસમમિતિય ઈથર
ઉત્તર:
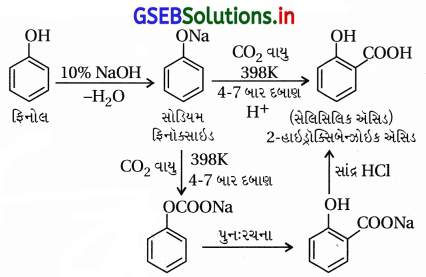
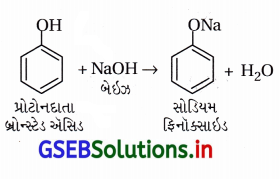
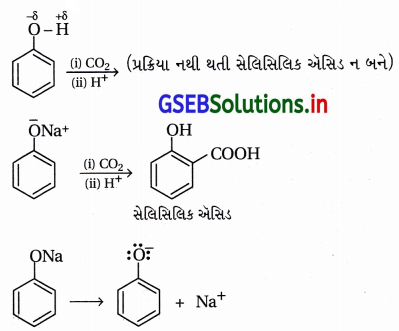
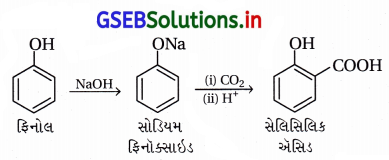
(i) કોલ્લે પ્રક્રિયા :
- આ પ્રક્રિયામાં -OH જળવાઈ રહી ઑર્થો સ્થાને CO2 જોડાય છે. ફિનોલની સોડિયમ હાઇડ્રૉક્સાઇડ (NaOH) સાથે પ્રક્રિયા કરવાથી સોડિયમ ફિનૉક્સાઇડ બને છે.
- ફિનોલની સરખામણીમાં ફિનૉક્સાઇડ આયન ઇલેક્ટ્રૉનઅનુરાગી એરોમેટિક વિસ્થાપન પ્રક્રિયા પ્રત્યે વધારે પ્રતિક્રિયાત્મક છે, જેથી ફિનૉક્સાઇડની CO2 જેવા નિર્બળ ઇલેક્ટ્રૉનઅનુરાગી વડે પ્રક્રિયા થઈને મુખ્ય નીપજ ઑર્થોહાઇડ્રૉક્સિબેન્ઝોઇક ઍસિડ બને છે.
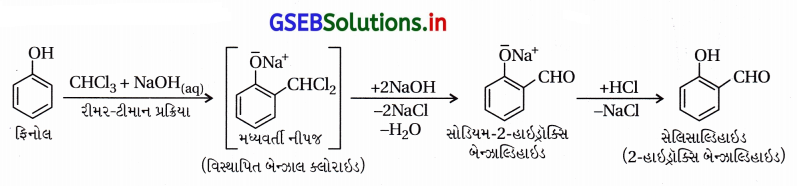
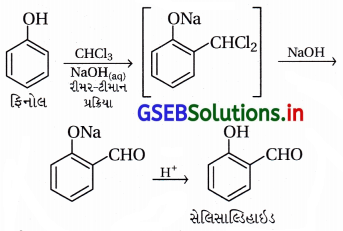
(ii) રીમર-ટીમાન પ્રક્રિયા :
- આ પ્રક્રિયામાં -OH સમૂહ જળવાઈ રહી ઑર્થો સ્થાને પ્રક્રિયા થાય છે. ફિનોલને સોડિયમ હાઇડ્રૉક્સાઇડની હાજરીમાં ક્લોરોફોર્મની સાથે ગરમ કરતાં ફિનોલમાં -OH ના ઑર્થો સ્થાને આલ્ડિહાઇડ (-CHO) સમૂહ દાખલ થાય છે, જેને રીમર-ટીમાન પ્રક્રિયા કહે છે.
- આ પ્રક્રિયા દરમિયાન મધ્યવર્તી સંયોજન વિસ્થાપિત બેન્ઝાલ ક્લોરાઇડ બને છે, જે આલ્કલી (NaOH)ની હાજરીમાં જળવિભાજન પામી નીપજ સેલિસાલ્ડિહાઇડ બનાવે છે.
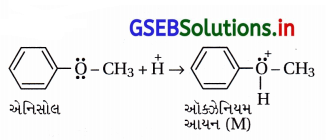
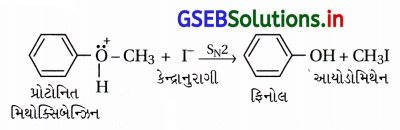
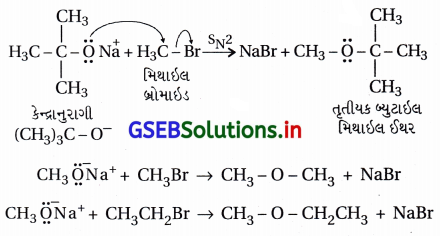
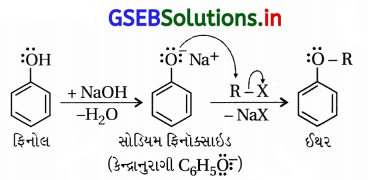
(iii) વિલિયમસન ઈથર સંશ્લેષણ :
એલેક્ઝાન્ડર વિલિયમ વિલિયમસન (1824-1904)નો લંડનમાં જન્મ થયો હતો અને 1849માં લંડનની યુનિવર્સિટીમાં રસાયણવિજ્ઞાનના પ્રાધ્યાપક હતા. તેમણે સમિતિય અને અસમિતિય ઈથર સંયોજનો બનાવવાની પદ્ધતિ શોધી હતી.
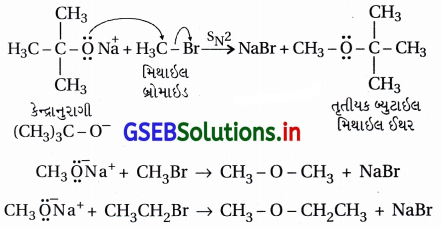
(i) પદ્ધતિ : આ પદ્ધતિમાં આલ્કાઇલ હેલાઇડ સંયોજનોની સોડિયમ આલ્બૉક્સાઇડની સાથે પ્રક્રિયા કરાય છે, જે સામાન્ય પ્રક્રિયા નીચે પ્રમાણે છે.

(ii) આ પદ્ધતિથી સમમિતિય ઈથર, અસમમિતિય ઈથર અને વિસ્થાપિત આલ્કાઇલ સમૂહો (દ્વિતીયક કે તૃતીયક) ધરાવતા ઈથર સંયોજનો બનાવી શકાય છે જે માટે યોગ્ય આલ્કૉક્સાઇડની પસંદગી કરાય છે. યોગ્ય 1°-આલ્કાઇલ હેલાઇડ ન લેતાં માત્ર આલ્કીન બને છે, ઈથર બનતો નથી.
(iii) વિલિયમસન ઈથર સંશ્લેષણ એ SN2 ક્રિયાવિધિથી થતી પ્રક્રિયા છે, જેમાં કેન્દ્રાનુરાગી આલ્કૉક્સાઇડ આયન હોય છે.
દા.ત.,
(iv) દ્વિતીયક અને તૃતીયક હેલાઇડ હોય તો વિસ્થાપનના સ્થાને વિલોપન પ્રક્રિયા થાય છે, જેનું ઉદાહરણ નીચે મુજબ છે.
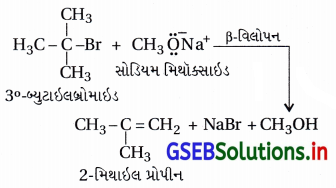
અહીં આલ્કૉક્સાઇડ આયન કેન્દ્રાનુરાગી ઉપરાંત પ્રબળ બેઇઝ છે, જેથી તૃતીયક હેલાઇડની સાથે હરીફાઈથી વિલોપન પ્રક્રિયા થાય છે.
(v) ફિનોલની વિલિયમસન ઈથર પ્રક્રિયા ઃ ફિનોલનો ફિનૉક્સાઇડ (C6H5O–) કેન્દ્રાનુરાગી તરીકે વર્તી આલ્કાઇલ હેલાઇડ સાથે ઈથર બનાવે છે.
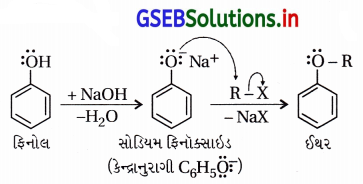
જો, R = -CH3 તો એનિસોલ (C6H5OCH3)
R = -CH2CH3 તો ફેનિટોલ (C6H5OCH2CH3)
R = -C6H6 તો ડાયફિનાઇલ ઈથર (C6H5-O-C6H5) બને છે.
(iv) અસમમિતિય ઈથર : જે ઈથર સંયોજનમાં ઑક્સિજન પરમાણુની સાથે બે ભિન્ન સમૂહો (આલ્કાઇલ કે એરાઇલ) જોડાયેલાં હોય તેને અસમિતિય ઈથર કહે છે.
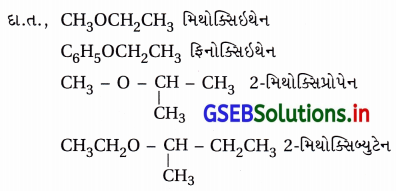
પ્રશ્ન 19.
ઇથેનોલના ઍસિડ નિર્જળીકરણથી ઇથીન મેળવવાની ક્રિયાવિધિ લખો.
ઉત્તર:
(i) આલ્કોહૉલ સંયોજનોનું નિર્જળીકરણ, સાંદ્ર H2SO4 અથવા H3PO4 જેવા પ્રોટિક ઍસિડ અથવા ઉદ્દીપક (નિર્જળ ZnCl2/ ઍલ્યુમિના)ની હાજરીમાં ગરમ કરવાથી થાય છે અને આલ્કીન બને છે.

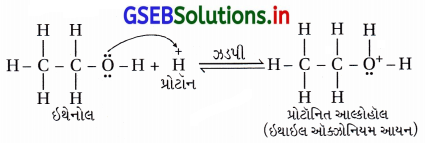
(ii) ઇથેનોલનું નિર્જળીકરણ ત્રણ તબક્કામાં થાય છે અને તે β-વિલોપન પ્રકારની ક્રિયાવિધિથી થાય છે.
તબક્કો-1 : આ પ્રથમ તબક્કામાં ઍસિડમાંનો પ્રોટૉન (H+) આલ્કોહૉલના ![]() સમૂહમાં ઉમેરાઈને ઑક્ઝોનિયમ આયન
સમૂહમાં ઉમેરાઈને ઑક્ઝોનિયમ આયન ![]() બને છે.
બને છે.
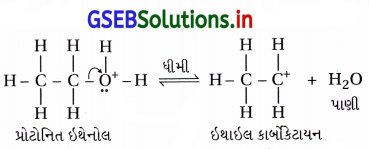
તબક્કો-2 : આ તબક્કામાં C – O બંધ તૂટે છે, H2O મુક્ત થાય છે અને C – Oના C ઉપર ધનભાર હોય તેવો કાર્બોકેટાયન રચાય છે. આ તબક્કો ધીમો છે. (કારણ કે C-O બંધ તોડવા ઊર્જા જરૂરી છે) જેથી તે પ્રક્રિયાનો વેગ નિર્ણાયક તબક્કો છે.
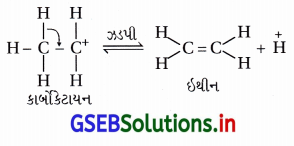
તબક્કો-3 : કાર્બોકેટાયનમાંથી B-પ્રોટૉનનું વિલોપન થઈને ઈથીન બનવાનો ઝડપી તબક્કો છે. તબક્કા-1માં વપરાયેલ ઍસિડનો H+ આ તબક્કામાં મુક્ત થાય છે, જેથી H+ પ્રક્રિયાનું ઉદ્દીપન કરે છે. પ્રક્રિયાને જમણી (નીપજ) તરફ ચાલુ રાખવા (ખસેડવા) માટે ઇથીન બને તેવો તરત જ દૂર કરવામાં આવે છે.
![]()
પ્રશ્ન 20.
નીચે દર્શાવલા પરિવર્તનો કેવી રીતે થાય છે ?
(i) પ્રોપિન → પ્રોપેન-2-ઑલ
(ii) બેન્ઝાઇલ ક્લોરાઇડ → બેન્ઝાઇલ આલ્કોહોલ
(iii) ઇથાઇલ મેગ્નેશિયમ ક્લોરાઇડ → પ્રોપેન-1-ઑલ
(iv) મિથાઇલ મેગ્નેશિયમ બ્રોમાઇડ → 2-મિથાઇલપ્રોપેન- 2-ઑલ
ઉત્તર:
(i) પ્રોપિન → પ્રોપેન-2-લ :
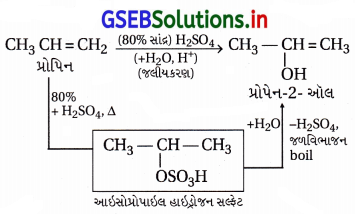
આ પ્રક્રિયા ઍસિડ ઉદ્દીપકીય, ઇલેક્ટ્રૉનઅનુરાગી છે, માર્કેનિકોવ નિયમથી H2O ઉમેરાય છે.
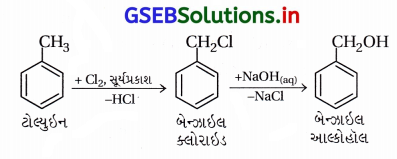
(ii) બેન્ઝાઇલ-ક્લોરાઇડ → બેન્ઝાઇલ આલ્કોહૉલ :
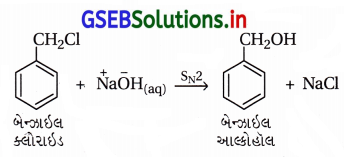
(iii) ઇથાઇલ મૅગ્નેશિયમ ક્લોરાઇડ → પ્રોપેન-1-ઑલ :
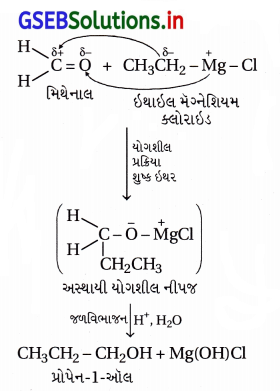
(iv) મિથાઇલ મૅગ્નેશિયમ બ્રોમાઇડ → 2-મિથાઇલ-પ્રોપેન-2-ઑલ :
અહીં નીપજ તૃતીયક-આલ્કોહૉલ છે જેથી યોગ્ય કિટોનની ગ્રિગ્નાર્ડે પ્રક્રિયક સાથેની પ્રક્રિયા કરવાથી બનશે.
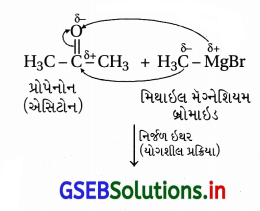
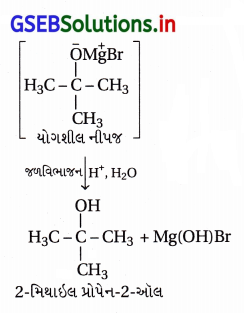
પ્રશ્ન 21.
નીચે દર્શાવેલી પ્રક્રિયાઓમાં વપરાતા પ્રક્રિયકોનાં નામ જણાવો :
(i) પ્રાથમિક આલ્કોહોલનું કાર્બોક્સિલિક ઍસિડમાં ઑક્સિડેશન
(ii) પ્રાથમિક આલ્કોહૉલનું આલ્ડિહાઇડમાં ઑક્સિડેશન
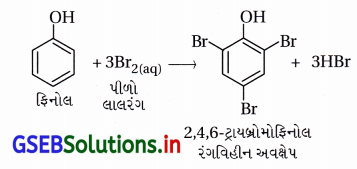
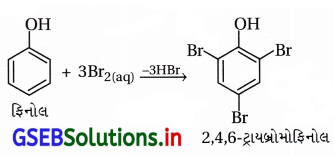
(iii) ફિનોલનું 2,4,6-ટ્રાયબ્રોમોફિનોલમાં બ્રોમિનેશન
(iv) બેન્ઝાઇલ આલ્કોહોલમાંથી બેન્ઝોઇક ઍસિડ
(v) પ્રોપેન-2-ઓલનું પ્રોપિનમાં નિર્જળીકરણ
(vi) બ્યુટેન-2-ઓનમાંથી બ્યુટેન-2-ઑલ
ઉત્તર:
(i) પ્રાથમિક આલ્કોહૉલનું કાર્બોક્સિલિક ઍસિડમાં ઑક્સિડેશન : પ્રક્રિયક : તટસ્થ કે આલ્કલાઇન પોટૅશિયમ પરમેંગેનેટ અને પછી ઍસિડીકરણ અથવા ઍસિડિક પોટૅશિયમ ડાયક્રોમેટ

(ii) પ્રાથમિક આલ્કોહૉલનું આલ્ડિહાઇડમાં ઑક્સિડેશન`: પ્રક્રિયક :
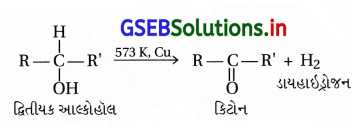
(i) 573 K તાપમાને ગરમ કરેલા કૉપર ઉપરથી પ્રાથમિક આલ્કોહૉલને પસાર કરીને.
(ii) પિરિડિનિયમ ક્લોરો ક્રોમેટ PCC (Cr2,O3નું પિરિડીન અને HCIનું સંકીર્ણ) CH2Cl2માં

(iii) ફિનોલનું 2,4,6-ટ્રાયબ્રોમોફિનોલમાં બ્રોમિનેશન :
પ્રક્રિયક : બ્રોમીનજળ (પાણીમાં દ્રાવ્ય કરેલ Br2)
(iv) બેન્ઝાઇલ આલ્કોહૉલમાંથી બેન્ઝોઇક ઍસિડ :
પ્રક્રિયક : ઍસિડિક પોટૅશિયમ પરમેંગેનેટ અથવા આલ્કલાઇન પોટૅશિયમ (KMnO4) પછી ઍસિડિક જળવિભાજન
(v) પ્રોપેન-2-ઑલનું પ્રોપિનમાં નિર્જળીકરણ :
પ્રક્રિયક : 443 K તાપમાને 85% ફૉસ્ફૉરિક ઍસિડ (H3PO4) અથવા 433 થી 443 K તાપમાને સાંદ્ર H2SO4
(vi) બ્યુટેન-2-ઓનમાંથી બ્યુટેન-2-ઑલ :
પ્રક્રિયક : ઉદ્દીપકીય રિડક્શન (Ni + H2) વડે અથવા NaBH (સોડિયમ બોરોહાઇડ્રાઇડ) અથવા લિથિયમ ઍલ્યુમિનિયમ હાઇડ્રાઇડ (LiAlH4)
પ્રશ્ન 22.
મિથોક્સિમિથેનની સરખામણીમાં ઇથેનોલનું ઉત્કલનબિંદુ ઊંચું હોવાનું કારણ જણાવો.
ઉત્તર:
- સોડિયમ તૃતીયક બ્યુટૉક્સાઇડ + તૃતીયક બ્યુટાઇલ બ્રોમાઇડ :
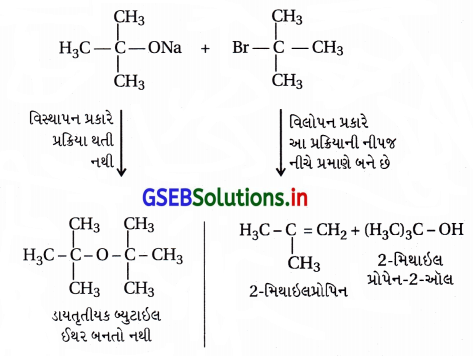
- હંમેશાં વિસ્થાપન અને વિલોપન પ્રક્રિયાઓ હરીફાઈથી થાય છે. આ પ્રક્રિયામાં (CH3)3 C – O કેન્દ્રાનુરાગી છે, જે પ્રબળ બેઇઝ પદ્મ છે, વળી, (CH3)3 C – Brમાં અવકાશીય અવરોધના કારણે C – Br બંધ તોડી વિસ્થાપન પ્રક્રિયા કરી શકતો નથી પણ ૩°-કાર્બોનિયમ આયન બનાવી વિલોપન નીપજ રચે છે. આથી (CH3)3 C – O – C (CH3)3 બનતો નથી.
પ્રશ્ન 23.
નીચે દર્શાવેલા ઈથર સંયોજનોના IUPAC નામ જણાવો :
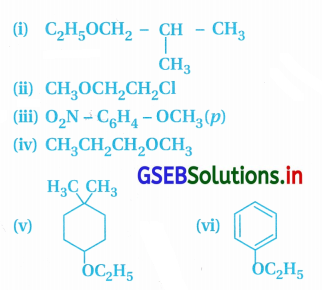
ઉત્તર:
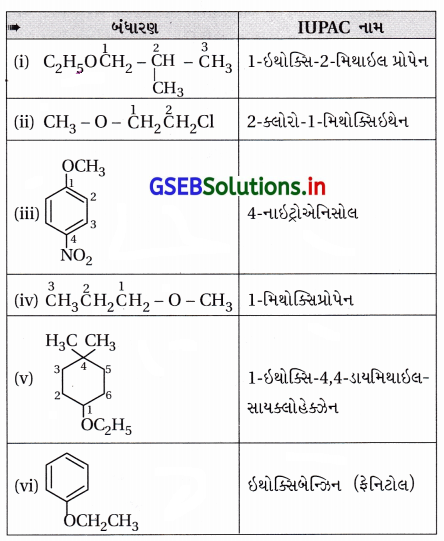
![]()
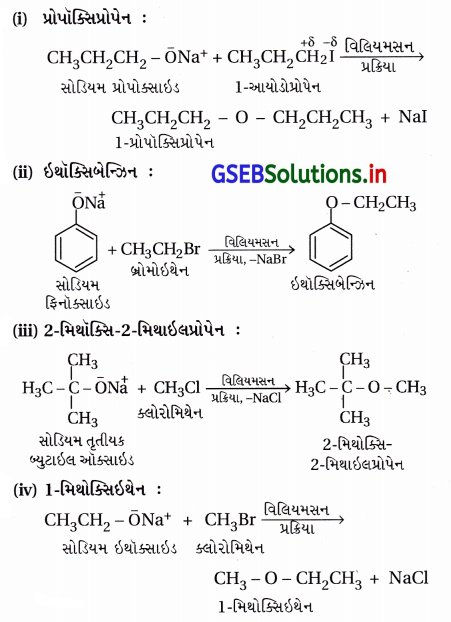
પ્રશ્ન 24.
નીચે દર્શાવેલા ઈથર સંયોજનોની વિલિયમસન સંશ્લેષણ દ્વારા બનાવટ માટેના પ્રક્રિયકોનાં નામ અને સમીકરણ લખો :
(i) 1-પ્રોપોક્સિપ્રોપેન
(ii) ઇથોક્સિબેઝિન
(iii) 2-મિથોક્સિ-2-મિથાઇલપ્રોપેન
(iv) 1-મિથોક્સિઇથેન
ઉત્તર:
પ્રશ્ન 25.
કેટલાક પ્રકારના ઈથર સંયોજનોની વિલિયમસન સંશ્લેષણ દ્વારા બનાવટ માટેની મર્યાદા ઉદાહરણો સહિત સમજાવો.
ઉત્તર:
(i) વિલિયમસન ઈથર સંશ્લેષણમાં દ્વિતીયક હેલાઇડ અને તૃતીયક હેલાઇડ સંયોજનોમાંથી ઈથરનું સંશ્લેષણ કરવામાં આવતું નથી કારણ કે તેમાં વિલોપન પ્રક્રિયા થઈને આલ્કીન બને છે. દા.ત., તૃતીયક બ્યુટાઇલ ક્લોરાઇડમાંથી ઈથર બનતા નથી.

ડાયઆઇસોપ્રોપાઇલ ઈથર, ડાયતૃતીયક બ્યુટાઇલ ઈથર વગેરે પણ બનાવી શકાતા નથી.
(ii) એરાઇલ હેલાઇડનાં વિલિયમસન ઈથર સંશ્લેષણ કરીને ઈથર બનાવી શકાતાં નથી. દા.ત., ક્લોરોબેન્ઝિન, બ્રોમોબેન્ઝિનમાંથી તેમના ઈથર બનાવી શકાતા નથી.
પ્રશ્ન 26.
પ્રોપેન-1-ઑલમાંથી 1-પ્રોપોક્સિપ્રોપેનનું સંશ્લેષણ કેવી રીતે કરવામાં આવે છે ? આ પ્રક્રિયાની ક્રિયાવિધિ લખો.
ઉત્તર:
(a) 1-પ્રોપોક્સિ પ્રોપેનનું સંશ્લેષણ નીચે પ્રમાણે કરાય છે :

(b) ક્રિયાવિધિ : આ પ્રક્રિયા દ્વિઆણ્વીય કેન્દ્રાનુરાગી વિસ્થાપન (SN2) પ્રકારે થાય છે. અને તેમાં પ્રોપાઇલ બ્રોમાઇડની સાથે કેન્દ્રાનુરાગી પ્રોપોક્સાઇડ આયન (CH3CH2CH2O–) પ્રક્રિયા કરે છે અને Br– અવશિષ્ટ સમૂહ છે.
(i) CH3CH2CH2OH + Na → CH3CH2CH2ONa + \(\frac{1}{2}\) H2 આયનીકરણ CH3CH2CH2ONa ![]() CH3CH2CH2O– + Na+
CH3CH2CH2O– + Na+
(ii) કેન્દ્રાનુરાગી RO– વડે C – Br બંધમાં પાછળથી હુમલો થઈને સંક્રાંતિ અવસ્થા બને છે.

આ પ્રક્રિયા SN2 ક્રિયાવિધિથી થાય છે.
પ્રશ્ન 27.
દ્વિતીયક અને તૃતીયક આલ્કોહોલ સંયોજનોના ઍસિડ નિર્જળીકરણ દ્વારા ઈથર સંયોજનોની બનાવટની પદ્ધતિ યોગ્ય નથી. કારણ આપો.
ઉત્તર:
કારણ કે જ્યારે આલ્કોહૉલ દ્વિતીયક અથવા તૃતીયક હોય છે ત્યારે, તેમનાં ઍસિડ નિર્જળીકરણથી ઈથર બનતાં નથી, પણ B-વિલોપન પ્રક્રિયા, વિસ્થાપન પ્રક્રિયાની સાથે સ્પર્ધા કરીને સરળતાથી આલ્કીન બનાવે છે. દા.ત.,
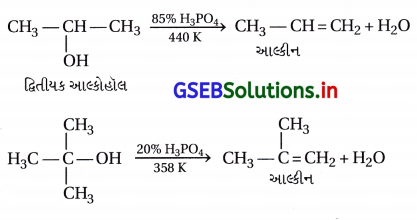
2°-આલ્કોહૉલ અને 3°-આલ્કોહૉલનું ઍસિડની સાથે ગરમ કરતાં ઈથર નથી બનતા પણ આલ્કીન બને છે, કેન્દ્રાનુરાગી પ્રક્રિયા નથી થતી પણ વિલોપન પ્રક્રિયા થાય છે, આથી દ્વિતીયક અને તૃતીયક આલ્કોહૉલના નિર્જળીકરણ દ્વારા ઈથર બનાવવાની પદ્ધતિ યોગ્ય નથી.
પ્રશ્ન 28.
હાઇડ્રોજન આયોડાઇડની નીચે દર્શાવેલા સંયોજનો સાથેની પ્રક્રિયાના સમીકરણ લખો : [માર્ચ-2020]
(i) 1-પ્રોપોક્સિપ્રોપેન
(ii) મિથોક્સિબેઝિન અને
(iii) બેન્ઝાઇલ ઇથાઇલ ઈથર
ઉત્તર:
(i) 1-પ્રોપોક્સિપ્રોપેનની હાઇડ્રોજન આયોડાઇડ સાથે પ્રક્રિયા :

(ii) મિથોક્સિ બેન્ઝિનની હાઇડ્રોજન આયોડાઇડ સાથેની પ્રક્રિયા :
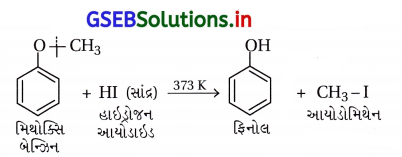
આમાં O – CH3 બંધ નિર્બળ હોવાથી તૂટે છે અને C6H5 – O બંધ પ્રબળ હોવાથી તૂટતો નથી.
(iii) બેન્ઝાઇલ ઇથાઇલ ઈથરની હાઇડ્રોજન આયોડાઇડ સાથેની પ્રક્રિયા :
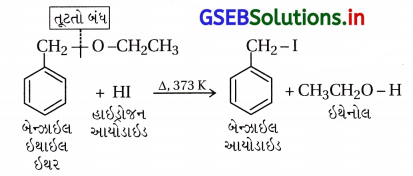
નોંધ : C6H5CH2 ઇલેક્ટ્રૉન આકર્ષણ અસરથી ઇલેક્ટ્રૉનને પોતાની તરફ ખેંચી C6H5CH2 – O બંધને નિર્બળ બનાવે છે, જેથી આ બંધ તૂટે છે. CH2CH2 ઇલેક્ટ્રૉન મુક્તકર્તા અસરથી CH3CH2 – O બંધ વધારે મજબૂત કરે છે.
![]()
પ્રશ્ન 29.
એરાઇલ આલ્કાઇલ ઈથર સંયોજનોમાં નીચેનાં સત્યોને સમજાવો :
(i) આલ્કોહૉલ સમૂહ બેન્ઝિન વલયને ઇલેક્ટ્રોનઅનુરાગી વિસ્થાપન પ્રત્યે સક્રિય બનાવે છે.
(ii) તે બેન્ઝિન વલયમાં નવા દાખલ થનાર વિસ્થાપકોને ઑર્થો અને પેરા સ્થાનનું નિર્દેશન કરે છે.
ઉત્તર:
(i) આલ્કોહૉલ સમૂહ બેન્ઝિન વલયને ઇલેક્ટ્રોનઅનુરાગી વિસ્થાપન પ્રત્યે સક્રિય બનાવે છે.
-OR સમૂહ સક્રિયતાકારક છે : આલ્કૉક્સિ ![]() સમૂહ સસ્પંદનમાં ઑક્સિજન ઉપરનું અબંધકા૨ક ઇલેક્ટ્રૉનયુગ્મ બેન્ઝિન વલયમાં આપે છે. પરિણામે વલયમાં ઋણભાર આવે છે, વલય ઇલેક્ટ્રૉનનિક બને છે. જેથી વલયમાં ઇલેક્ટ્રૉનઅનુરાગી વિસ્થાપન સરળ બને છે.
સમૂહ સસ્પંદનમાં ઑક્સિજન ઉપરનું અબંધકા૨ક ઇલેક્ટ્રૉનયુગ્મ બેન્ઝિન વલયમાં આપે છે. પરિણામે વલયમાં ઋણભાર આવે છે, વલય ઇલેક્ટ્રૉનનિક બને છે. જેથી વલયમાં ઇલેક્ટ્રૉનઅનુરાગી વિસ્થાપન સરળ બને છે. ![]() સમૂહ બેન્ઝિન વલયને સક્રિય કરે છે. +8
સમૂહ બેન્ઝિન વલયને સક્રિય કરે છે. +8
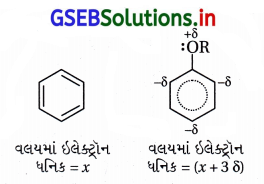
(ii) તે બેન્ઝિન વલયમાં નવા દાખલ થનાર વિસ્થાપકોને ઑર્થો અને પેરા સ્થાનનું નિર્દેશન કરે છે.
આલ્કૉક્સિ સમૂહ ઑર્થો-પૅરા સ્થાન નિર્દેશક છે :
(i) આલ્કૉક્સિ બેન્ઝિનનાં સસ્પંદન સ્વરૂપો નીચે પ્રમાણે છે :
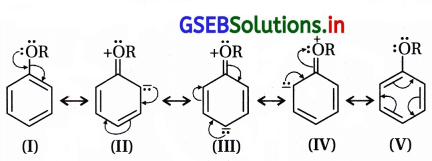
(ii) સસ્પંદન બંધારણોમાં ઑર્થો-પૅરા સ્થાને અબંધકારક ઇલેક્ટ્રૉનયુગ્મ (ઋણભાર) છે અને કાર્બન ઇલેક્ટ્રૉન- ધનિક છે.
(iii) આ કારણથી ઇલેક્ટ્રૉનઅનુરાગી પ્રક્રિયકો ઑર્થો-પૅરા સ્થાને આકર્ષાઈને ત્યાં હુમલો કરે છે.
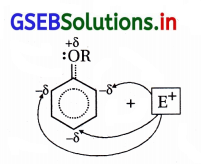
આ રીતે આલ્કૉક્સિ સમૂહ ઇલેક્ટ્રૉનઅનુરાગી વિસ્થાપન પ્રક્રિયા માટે ઑર્થો-પૅરા સ્થાન નિર્દેશક છે.
પ્રશ્ન 30.
મિથોક્સિમિથેનની HI સાથેની પ્રક્રિયાની ક્રિયાવિધિ લખો.
ઉત્તર:

ક્રિયાવિધિ : આ પ્રક્રિયા નીચે પ્રમાણે બે તબક્કામાં SN2 ક્રિયાવિધિથી થાય છે.
તબક્કો-1 : ઈથર, મિથોક્સિમિથેનનું પ્રોટૉનીકરણ પ્રક્રિયક HIના H+ થી થાય છે.
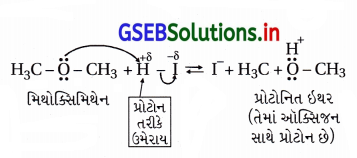
તબક્કો-2 : આયોડાઇડ આયન (I–) તે સારો કેન્દ્રાનુરાગી પ્રક્રિયક છે અને પ્રોટોનિત ઈથરમાં C – O બંધની વિરુદ્ધ દિશામાં હુમલો કરી આંશિક I – C બંધ બનેલ અને આંશિક C – O બંધ તૂટેલી સંક્રાંતિ અવસ્થા બને છે.
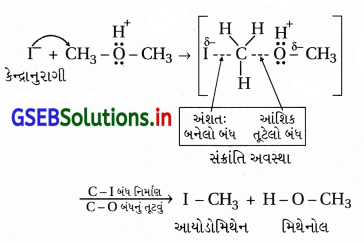
સંક્રાંતિ અવસ્થામાં બે સંયોજનો છે માટે પ્રક્રિયાની ગતિકી બે છે.
પ્રક્રિયામાં કેન્દ્રાનુરાગી I– વડે અવશિષ્ટ સમૂહ -OCH3નું વિસ્થાપન થાય છે; આમ, આ પ્રક્રિયા દ્વિઆણ્વીય કેન્દ્રાનુરાગી વિસ્થાપન (SN2) ક્રિયાવિધિથી થાય છે.
પ્રશ્ન 31.
નીચે દર્શાવલી પ્રક્રિયાઓના સમીકરણો લખો.
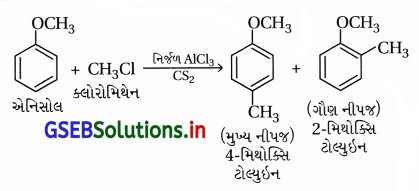
(i) ફ્રિડલ-ક્રાફટ્સ પ્રક્રિયા – એનિસોલનું આલ્કાઇલેશન
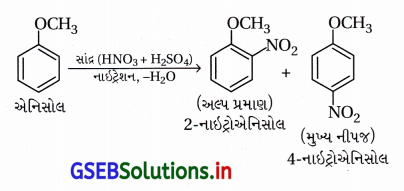
(ii) એનિસોલનું નાઇટ્રેશન
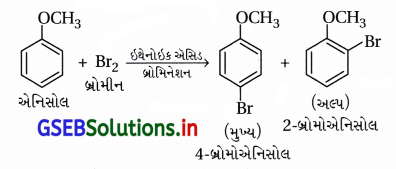
(iii) ઇથેનોઇક એસિડ માધ્યમમાં એનિસોલનું બ્રોમિનેશન
(iv) એનિસોલનું ફ્રિડલ-ક્રાફટ્સ એસાઇલેશન
ઉત્તર:
(i) ફ્રિડલ-ક્રાફટ્સ પ્રક્રિયા – એનિસોલનું આલ્કાઇલેશન :
(ii) એનિસોલનું નાઇટ્રેશન :
(iii) ઇથેનોઇક ઍસિડ માધ્યમમાં એનિસોલનું બ્રોમિનેશન :
(iv) એનિસોલનું ફિડલ-ક્રાફટ્સ એસાઇલેશન :

પ્રશ્ન 32.
યોગ્ય આલ્કીન સંયોજનોમાંથી તમે નીચે દર્શાવેલા આલ્કોહોલ સંયોજનોનું સંશ્લેષણ કેવી રીતે કરશો તે જણાવો :
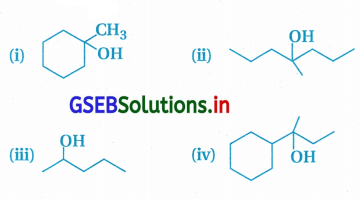
ઉત્તર:
આલ્કીનમાંથી આલ્કોહૉલ બનાવવા માટે જલીયકરણ પ્રક્રિયા સાંદ્ર ઍસિડ સાથે ગરમ કરીને કરવી પડે છે.
(i) નીચેના X અને Y આલ્કીનનું જલીયકરણ :
આ પ્રક્રિયામાં પાણીનો અણુ (H+δOH-δ) માર્કોવનિકોવ નિયમ પ્રમાણે ઉમેરાય છે.
(ii) આપેલા આલ્કોહૉલનું નિર્જળીકરણ કરીએ તો નીચેનો એક જ આલ્કીન બની શકે છે.
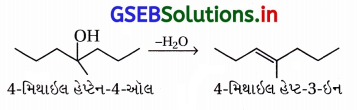
જેથી નીચેની પ્રક્રિયા પ્રમાણે આપેલો આલ્કોહૉલ (ii) બનાવી શકાય.

(iii) આપેલા આલ્કોહૉલના નિર્જળીકરણની પ્રક્રિયા નીચે પ્રમાણે :
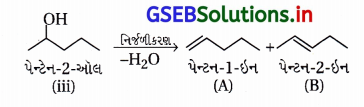
જેથી આલ્કીન (A) અને (B)નું જલીયકરણ કરવાથી આલ્કોહૉલ (iii) ઉત્પન્ન થશે.

અહીં માત્ર એક જ આલ્કોહૉલ પેન્ટેન-2-ઑલ નીપજ છે.
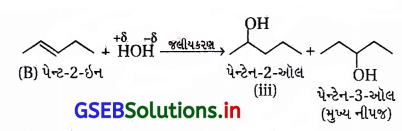
આ જલીયકરણમાં બે આલ્કોહૉલ સંયોજનોનું મિશ્રણ બને છે.
∴ પેન્ટેન-1-ઇનનું જલીયકરણ કરવાથી જ જરૂરી પેન્ટેન-2- ઑલનું સંશ્લેષણ કરી શકાશે.
(iv) આપેલા આલ્કોહૉલ (iv)નું નિર્જળીકરણ કરવાથી નીચે પ્રમાણે ત્રણ આલ્કીન (A), (C) અને (D) બની શકે છે :
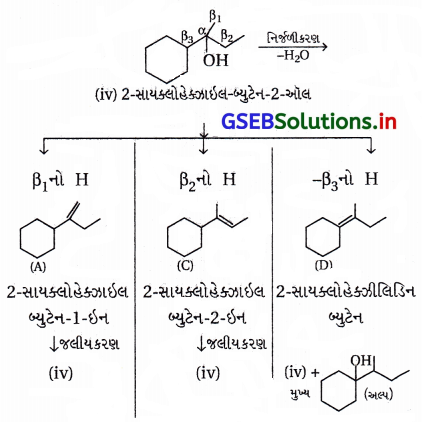
આ અનુસાર આપેલો આલ્કોહૉલ (iv) મેળવવા માટે આલ્કીન (A) અથવા (C) અથવા (D)નું સાંદ્ર ઍસિડની હાજરીમાં જલીયકરણ કરવું જોઈએ.
![]()
પ્રશ્ન 33.
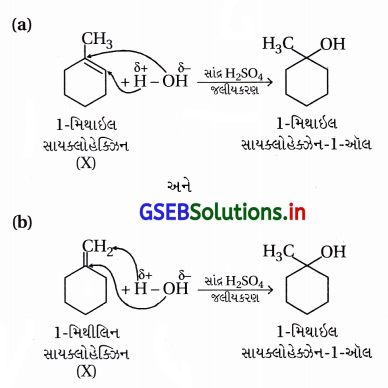
જ્યારે 3-મિથાઇલબ્યુટેન-2-ઓલની HBr સાથે પ્રક્રિયા કરવામાં આવે છે ત્યારે નીચે દર્શાવલી પ્રક્રિયા થાય છે :

આ પ્રક્રિયા માટેની ક્રિયાવિધિ લખો.
(સંકેત : તબક્કા-IIમાં બનેલો દ્વિતીયક કાર્બોકેટાયન, ત્રીજા કાર્બન પરમાણુ પરથી સ્થાનાંતર પામેલા હાઇડ્રાઇડ આયન દ્વારા વધુ સ્થાયી તૃતીયક કાર્બોકેટાયનમાં પુનર્વિન્યાસ પામે છે.)
ઉત્તર:
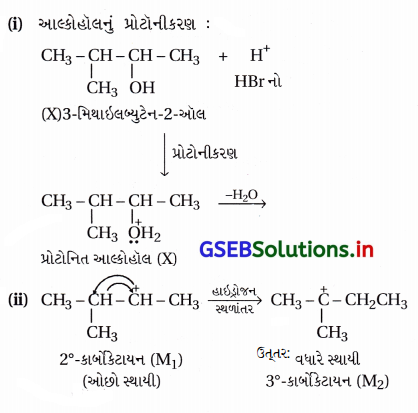
(iii) 3°-વધુ સ્થાયી કાર્બોકેટાયન કેન્દ્રાનુરાગી Br સાથે જોડાઈને બ્રોમાઇડ બને છે.

આમ, આ પ્રક્રિયા ત્રણ તબક્કામાં પૂર્ણ થતી એકઆણ્વીય કેન્દ્રાનુરાગી વિસ્થાપન (SN1) ક્રિયાવિધિથી થાય.
પ્રક્રિયામાં બનતા મધ્યસ્થ 2°-કાર્બોકેટાયન(M1)માં હાઇડ્રોજન સ્થળાંતર થઈને વધુ સ્થાયી 3°-કાર્બોકેટાયન(M2) બને છે.
GSEB Class 12 Chemistry આલ્કોહૉલ, ફિનોલ અને ઇથર સંયોજનો NCERT Exemplar Questions and Answers
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-I)
પ્રશ્ન 1.
સૂર્યપ્રકાશની હાજરીમાં ટોલ્યુઇનનું મોનોક્લોરિનેશન કર્યા બાદ જલીય NaOH સાથે જળવિભાજન કરતાં ………………… નીપજે છે.
(A) o-ક્રેસોલ
(B) m-ક્રેસોલ
(C) 2,4-ડાયહાઇડ્રૉક્સિ ટોલ્યુઇન
(D) બેન્ઝાઇલ આલ્કોહૉલ
જવાબ
(D) બેન્ઝાઇલ આલ્કોહૉલ
આ પ્રક્રિયા નીચે પ્રમાણે થાય છે :
પ્રશ્ન 2.
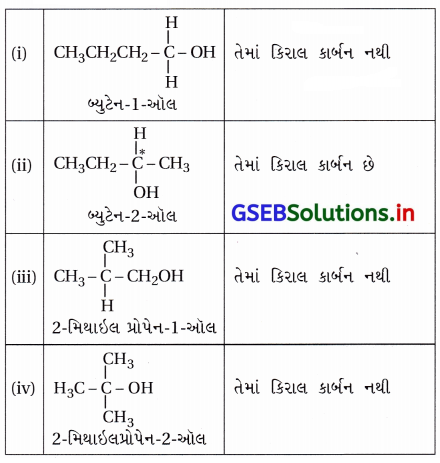
C4H10O આણ્વીયસૂત્ર સાથે કેટલા આલ્કોહોલ સ્વભાવે કિરાલ છે ?
(A) 1
(B) 2
(C) 3
(D) 4
જવાબ
(A) 1
- જે કાર્બનની સાથે ચાર અલગ અલગ સમૂહો હોય તે કિરાલ કાર્બન કહેવાય છે.
- C4H10O અણુસૂત્રવાળા આલ્કોહૉલ નીચે પ્રમાણે છે :
પ્રશ્ન 3.
નીચેની પ્રક્રિયામાં આલ્કોહોલની પ્રતિક્રિયાત્મકતાનો કયો ક્રમ સાચો છે ?

(A) 1° > 2° > 3°
(B) 1° < 2° > 3°
(C) 3° > 2° > 1°
(D) 3° > 1° > 2°
જવાબ
(C) 3° > 2° > 1°
- આપેલ પ્રક્રિયામાં આલ્કોહૉલના -OH સમૂહનું, કેન્દ્રાનુરાગી Cl– વડે વિસ્થાપન છે અને કેન્દ્રાનુરાગી વિસ્થાપન પ્રક્રિયા છે. આ પ્રક્રિયામાં પ્રથમ પ્રોટૉનીકરણ થાય છે અને પછી કાર્બોકેટાયન બને છે.
- વધારે સ્થાયી કાબોકેટાયન સરળતાથી, ઝડપી બનીને કેન્દ્રાનુરાગી Cl– ની સાથે આલ્કાઇલ ક્લોરાઇડ બનાવે છે. કાર્બોકેટાયન બનવાની સ્થાયિતા અને સરળતા 3° > 2° > 1° છે તેના પરિણામે આ પ્રક્રિયાની પ્રતિક્રિયાત્મકતાનો સાચો ક્રમ 3° > 2° > 1° આલ્કોહૉલ છે.
પ્રશ્ન 4.
…………………………. દ્વારા CH3CH2OH ને CH3CHO માં રૂપાંતરિત કરી શકાય.
(A) ઉદ્દીપકીય હાઇડ્રોજિનેશન
(B) LiAlH4 સાથેની પ્રક્રિયા
(C) પિરિડિનિયમ ક્લોરોક્રોમેટ સાથેની પ્રક્રિયા
(D) KMnO4 સાથેની પ્રક્રિયા
જવાબ
(C) પિરિડિનિયમ ક્લોરોક્રોમેટ સાથેની પ્રક્રિયા

પ્રશ્ન 5.
આલ્કાઇલ હેલાઇડનું આલ્કોહોલમાં રૂપાંતર થવું …………………….. સમાવે છે.
(A) યોગશીલ પ્રક્રિયા
(B) વિસ્થાપન પ્રક્રિયા
(C) ડીહાઇડ્રોહેલોજિનેશન પ્રક્રિયા
(D) પુનર્વિન્યાસ પ્રક્રિયા
જવાબ
(B) વિસ્થાપન પ્રક્રિયા

આ પ્રક્રિયા થાય ત્યારે X ના સ્થાને OH– આવે છે. X– તે અવશિષ્ટ સમૂહ અને OH– કેન્દ્રાનુરાગી છે, અને કેન્દ્રાનુરાગી OH– વડે X–નું વિસ્થાપન થાય છે આ પ્રક્રિયા કેન્દ્રાનુરાગી વિસ્થાપન છે.
![]()
પ્રશ્ન 6.
કયું સંયોજન એરોમેટિક આલ્કોહોલ છે ?
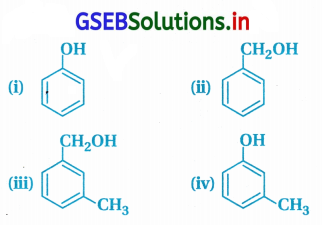
(A) (i), (ii), (iii), (iv)
(B) (i), (iv)
(C) (ii), (iii)
(D) (i)
જવાબ
(C) (ii), (iii)
- બેન્ઝિન વલયની સાથે સીધા -OH સમૂહ જોડાયેલ હોય તો તેઓ ફિનોલિક સંયોજનો કહેવાય છે. આ અનુસાર (i) અને (iv) ફિનોલ છે પણ આલ્કોહૉલ નથી.
- સંયોજન (ii) અને (iii)માં બેન્ઝિન વલય છે અને તેની સાથે -CH2OH (આલ્કોહૉલ) સમૂહ છે માટે (ii) અને (iii) ઍરોમેટિક આલ્કોહૉલ છે, જેથી (C) સાચો વિકલ્પ છે.
પ્રશ્ન 7.
નીચે આપેલા સંયોજનનું IUPAC નામ આપો :

(A) 2-ક્લોરો-5-હાઇડ્રૉક્સિહેક્ઝેન
(B) 2-હાઇડ્રૉક્સિ-5-ક્લોરોહેક્ઝેન
(C) 5-ક્લોરોહેક્ઝેન-2-ઑલ
(D) 2-ક્લોરોહેક્ઝેન-5-ઑલ
જવાબ
(C) 5-ક્લોરોહેક્ઝેન-2-ઑલ
નીચે પ્રમાણે ક્રમ આપવા જોઈએ.

માટે સાચું IUPAC નામ 5-ક્લોરોહેક્ઝેન-2-ઑલ
પ્રશ્ન 8.
m-ક્રેસોલનું IUPAC નામ ………………….. છે.
(A) 3-મિથાઇલફિનોલ
(B) 3-ક્લોરોફિનોલ
(C) 3-મિથોક્સિફિનોલ
(D) બેન્ઝિન-1,3-ડાયોલ
જવાબ
(A) 3-મિથાઇલફિનોલ
m-ક્રેસોલનું બંધારણીય સૂત્ર નીચે પ્રમાણે છે :
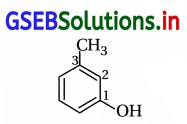
IUPAC નામ : 3-મિથાઇલફિનોલ
પ્રશ્ન 9.
સંયોજન 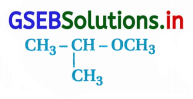 નું IUPAC નામ …………………….. છે.
નું IUPAC નામ …………………….. છે.
(A) 1-મિથોક્સિ-1-મિથાઇલઇથેન
(B) 2-મિથોક્સિ-2-મિથાઇલઇથેન
(C) 2-મિથોક્સિપ્રોપેન
(D) આઇસોપ્રોપાઇમિથાઇલઈથર
જવાબ
(C) 2-મિથોક્સિપ્રોપેન
આપેલા બંધારણને નીચે પ્રમાણે લખી શકાય છે.

∴ સાચું IUPAC નામ 2-મિથોક્સિપ્રોપેન છે.
પ્રશ્ન 10.
નીચે પૈકી કયું ઘટક સૌથી વધુ પ્રબળ બેઇઝ તરીકે વર્તે છે ?
(A) ⊖OH
(B) ⊖OR
(C) ⊖OC6H5
(D) 
જવાબ
(B) ⊖OR
આપેલા બધા જ સ્વિસીઝ ઍસિડના સંયુગ્મ બેઇઝ છે, જે બધાં જ –O – H બંધના Hના સ્થાને ભિન્ન વિસ્થાપનો ધરાવતા નીચે પ્રમાણે છે :
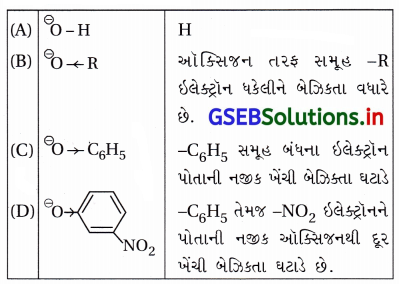
જેમ ઑક્સિજન ઉ૫૨થી ઇલેક્ટ્રૉનયુગ્મ આપવાની ક્ષમતા વધારે હોય તેમ તે સ્પિસીઝ વધારે પ્રબળ બેઇઝ હોય. આ કારણથી RO⊖ આપેલ બધામાં સૌથી વધારે પ્રબળ બેઇઝ છે. બીજી રીતે આપેલા બેઇઝના સંયુગ્મ ઍસિડ અનુક્રમે H2O,
ROH, C6H5OH અને  છે, આ બધામાં ROH સૌથી નિર્બળ ઍસિડ હોવાથી તેનો સંયુગ્મ બેઇઝ RO⊖
છે, આ બધામાં ROH સૌથી નિર્બળ ઍસિડ હોવાથી તેનો સંયુગ્મ બેઇઝ RO⊖
મહત્તમ પ્રબળ બેઇઝ છે.
![]()
પ્રશ્ન 11.
નીચે પૈકી કયું સંયોજન સોડિયમ હાઇડ્રોક્સાઇડના જલીય દ્રાવણ સાથે પ્રક્રિયા કરશે ?
(A) C6H5OH
(B) C6H5CH2OH
(C) (CH3)3COH
(D) C2H5OH
જવાબ
(A) C6H5OH
ફક્ત (A) C6H5OH (ફિનોલ) ઍસિડિક છે અને બાકીના બધા તટસ્થ આલ્કોહૉલ છે. ફિનોલ નીચે પ્રમાણે બેઇઝ જલીય NaOHની સાથે પ્રક્રિયા કરે છે.
પ્રશ્ન 12.
ફિનોલ …………………………….. કરતાં ઓછો ઍસિડિક છે.
(A) ઇથેનોલ
(B) ૦-નાઇટ્રોફિનોલ
(C) o-મિથાઇલફિનોલ
(D) 0-મિથોક્સિફિનોલ
જવાબ
(B) ૦-નાઇટ્રોફિનોલ
- ફિનોલના કરતાં તેનો સંયુગ્મ વધારે સ્થાયી હોવાથી ફિનોલ ઍસિડિક છે. ૦-નાઇટ્રોફિનોલમાં ઇલેક્ટ્રૉન આકર્ષક નાઇટ્રોસમૂહ ઑર્થો સ્થાને છે જે ફિનોલની ઍસિડિકતામાં વધારો કરે છે, આથી ફિનોલ ૦-નાઇટ્રોફિનોલ કરતાં ઓછો ઍસિડિક છે.
- (C) 0-મિથાઇલફિનોલ અને (D) o-મિથોક્સિફિનોલમાં, અનુક્રમે ઇલેક્ટ્રૉન મુક્તકર્તા (સસ્પંદનમાં) -CH3 અને -OCH3 સમૂહો છે જે ફિનોલની ઍસિડિકતામાં ઘટાડો કરતા છે. આ કારણથી (C) અને (D)ના સાપેક્ષમાં ફિનોલ વધારે ઍસિડિક છે.
- (A) ઇથેનોલ ફિનોલની સરખામણીમાં ઓછો ઍસિડિક છે. ૦-નાઇટ્રોફિનોલની સરખામણીમાં ફિનોલ ઓછો ઍસિડિક છે.
પ્રશ્ન 13.
નીચેના પૈકી કયું સૌથી વધુ ઍસિડિક છે ?
(A) બેન્ઝાઇલ આલ્કોહૉલ
(B) સાયક્લોહેક્ઝેનોલ
(C) ફિનોલ
(D) m-ક્લોરોફિનોલ
જવાબ
(D) m-ક્લોરોફિનોલ
- (A) બેન્ઝાઇલ આલ્કોહૉલ અને (B) સાયક્લોહેક્ઝેનોલ તે આલ્કોહૉલ છે અને તેમાં sp3-કાર્બન -OH બંધ છે. માટે આ બંને ફિનોલના સાપેક્ષ ઓછા ઍસિડિક છે.
- (C) ફિનોલ અને m-ક્લોરોફિનોલ ફિનોલિક છે માટે આલ્કોહૉલના કરતાં વધારે ઍસિડિક છે. તેઓમાં sp2કાર્બન -OH બંધ છે જેથી તેઓ ઍસિડિક છે.
- m-ક્લોરોફિનોલમાં રહેલ Cl તે ઇલેક્ટ્રૉન આકર્ષક હોવાથી ફિનોલનો ઍસિડિક ગુણ પ્રબળ બનાવે છે. આપેલા ચારમાં m-ક્લોરોફિનોલ સૌથી વધારે ઍસિડિક છે.
પ્રશ્ન 14.
નીચેનાં સંયોજનોની ઍસિડિક પ્રબળતાનો ઊતરતો સાચો ક્રમ નક્કી કરો :
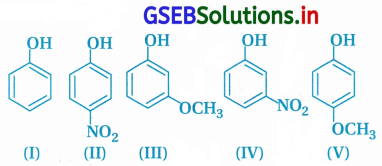
(A) V > IV > II > I > III
(B) II > IV > I > III > V
(C) IV >V > III > II > I
(D) V > IV > III > II >I
જવાબ
(B) II > IV > I > III > V
- આપેલાં બધા જ ફિનોલિક સંયોજનો છે.
- ઇલેક્ટ્રૉન આકર્ષક સમૂહ ઍસિડિક પ્રબળતામાં વધારો કરે છે, આથી (I)ના કરતાં (II) અને (IV) વધારે ઍસિડિક છે.
- પૅરાસ્થાને રહેલું -NO2 સમૂહ મૅટા સ્થાનના -NO2ની સરખામણીમાં ઍસિડિક ગુણોમાં અધિક વધારો કરે છે. આથી ઍસિડિક ગુણનો ઊતરતો ક્રમ : II > IV > I છે.
- (III) અને (V)માં -OCH3 છે જે ઍસિડિક ગુણમાં ઘટાડો કરે છે કારણ કે -OCH3 સમૂહ સસ્પંદનથી વલયમાં ઇલેક્ટ્રૉન આપી O – H બંધને પ્રબળ બનાવે છે. આ અસર મૅટા કરતાં પૅરા-OCH3 ની વધારે હોવાથી ઍસિડિક પ્રબળતાનો ક્રમ III > V.
- આમ, આપેલાં બધાં જ સંયોજનોનો ઍસિડિક ગુણનો ઊતરતો ક્રમ વિકલ્પ (B) પ્રમાણે II > IV > I > III > V છે.
પ્રશ્ન 15.
નીચેનાં સંયોજનોની HBr/HCI સાથેની પ્રક્રિયાની પ્રતિક્રિયાત્મકતાનો સાચો ચઢતો ક્રમ નક્કી કરો :
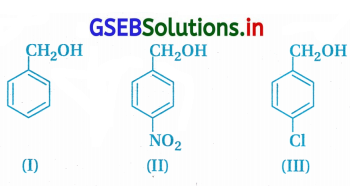
(A) I < II < III
(B) II < I < III
(C) II < III < I
(D) III < II < I
જવાબ
(C) II < III < I
- આપેલાં ત્રણેય ઍરોમેટિક આલ્કોહૉલ છે અને તેઓ HBr/ HCl સાથે અનુવર્તી હેલાઇડ બનાવે જેમાં -OH નું X– (કેન્દ્રાનુરાગી) વડે વિસ્થાપન થાય છે.
- પૅરા સ્થાને રહેલાં -NO2 અને -Cl ઇલેક્ટ્રૉન આકર્ષક હોવાથી કેન્દ્રાનુરાગી વિસ્થાપનની ક્રિયાશીલતામાં ઘટાડો કરે છે. આથી Iની સરખામણીમાં II અને III ઓછાં પ્રતિક્રિયાત્મક છે.
- II માં –NO2 અને IIIમાં પૅરા સ્થાને -Cl છે. જેમાંથી – Clના કરતાં -NO2 અધિક પ્રમાણમાં કેન્દ્રાનુરાગી પ્રક્રિયાની પ્રતિક્રિયાત્મકતા ઘટાડે છે.
∴ સંયોજન II HBr/HCl સાથે લઘુતમ અને I મહત્તમ પ્રતિક્રિયાત્મકતા છે.
∴ ચઢતો ક્રમ : II < III < I વિકલ્પ (C) પ્રમાણે છે.
![]()
પ્રશ્ન 16.
નીચેનાં સંયોજનોને ઉત્કલનબિંદુના ચઢતા ક્રમમાં ગોઠવો ઃ પ્રોપેન-1-ઑલ, બ્યુટેન-1-ઓલ, બ્યુટેન-2-ઓલ, પેન્ટેન-1-ઓલ
(A) પ્રોપેન-1-ઑલ, બ્યુટેન-2-ઑલ, બ્યુટેન-1-ઑલ, પેન્ટેન-1-ઑલ
(B) પ્રોપેન-1-ઑલ, બ્યુટેન-1-ઑલ, બ્યુટેન-2-ઑલ, પેન્ટેન-1-ઑલ
(C) પેન્ટેન-1-ઑલ, બ્યુટેન-2-ઑલ, બ્યુટેન-1-ઑલ, પ્રોપેન-1-ઑલ
(D) પેન્ટેન-1-ઑલ, બ્યુટેન-1-ઑલ, બ્યુટેન-2-ઑલ, પ્રોપેન-1-ઑલ
જવાબ
(A) પ્રોપેન-1-ઑલ, બ્યુટેન-2-ઑલ, બ્યુટેન-1-ઑલ, પેન્ટેન-1-ઑલ
આપેલા બધા જ આલ્કોહૉલ છે અને જેમ કાર્બન સંખ્યા વધારે તેમ ઉત્કલનબિંદુ વધારે છે.
| CH3CH2CH2OH પ્રોપેન-1-ઑલ |
લઘુતમ કાર્બન જેથી લઘુતમ ઉત્કલનબિંદુ. |
| CH3CHOHCH2CH3 બ્યુટેન-2-ઑલ |
દ્વિતીયક જેથી નોર્મલના કરતાં ઉત્કલનબિંદુ ઓછું. |
| CH3CH2CH2CH2OH બ્યુટેન-1-ઑલ |
નોર્મલ છે જેથી દ્વિતીયકના કરતાં ઉત્કલનબિંદુ વધારે છે. |
| CH3CHŻCH2CH2CH2OH પેન્ટેન-1-ઑલ |
મહત્તમ કાર્બન હોવાથી આનું ઉત્કલનબિંદુ મહત્તમ છે. |
આમ, ઉપરના આલ્કોહૉલનાં ઉત્કલનબિંદુ ઉપરથી નીચે જતાં વધે છે.
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-II)
નીચેના પ્રશ્નોમાં બે કે વધારે વિકલ્પો સાચાં હોઈ શકે છે.
પ્રશ્ન 1.
નીચેના પૈકી કયા પ્રક્રિયકો RCHO નું RCH2OHમાં રૂપાંતરણ કરવા ઉપયોગી છે ?
(A) H2/Pd
(B) LiAlH4
(C) NaBH4
(D) RMgX સાથે પ્રક્રિયા કર્યા પછી જળવિભાજન
જવાબ
(A, B, C)
H2/Pd, LiAlH4 અને NaBH4વડે RCHOમાંથી RCH2OH બને છે.

પ્રશ્ન 2.
નીચેના પૈકી કઈ પ્રક્રિયાઓ ફિનોલ નીપજાવશે ?
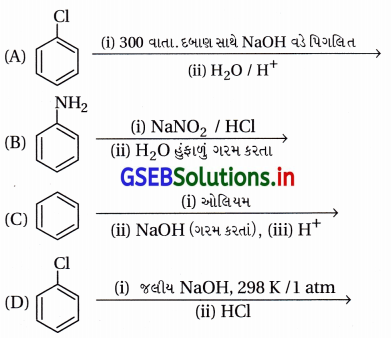
જવાબ
(A, B, C)
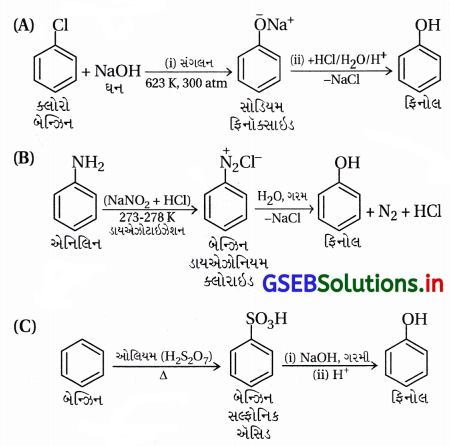
પ્રશ્ન 3.
પ્રાથમિક આલ્કોહોલનું આલ્ડિહાઇડમાં ઑક્સિડેશન કરવા નીચે પૈકી કયો પ્રક્રિયક વાપરી શકાય ?
(A) નિર્જળ માધ્યમમાં CrO3
(B) ઍસિડિક માધ્યમમાં KMnO4
(C) પિરિડિનિયમ ક્લોરોક્રોમેટ
(D) 573 K તાપમાને Cu ની હાજરીમાં ગરમ કરતાં
જવાબ
(A, C, D)
પ્રાથમિક આલ્કોહૉલમાંથી આલ્ડિહાઇડ બને તે ઑક્સિડેશન અને વિહાઇડ્રોજનીકરણ છે.

પ્રશ્ન 4.
ઇથેનોલથી ફિનોલને …………………………. સાથેની પ્રક્રિયા દ્વારા અલગ પારખી શકાય.
(A) Br2 / પાણી
(B) Na
(C) તટસ્થ FeCl3
(D) ઉપર્યુક્ત બધાં જ
જવાબ
(A, C)
(A) ઇથેનોલ બ્રોમીન જળની સાથે પ્રક્રિયા કરતો નથી પણ ફિનોલ બ્રોમીનજળની સાથે પ્રક્રિયા કરીને ટ્રાયબ્રોમોફિનોલના અવક્ષેપ આપે છે તથા તેમાં બ્રોમીનનો રંગ અદશ્ય થાય છે.
(B) સોડિયમ ધાતુ સાથે ઇથેનોલ અને ફિનોલ બન્ને પ્રક્રિયા કરતા હોવાથી, બન્નેમાં Na સાથેની પ્રક્રિયામાં ભિન્નતા દેખાઈ આવતી નથી. આથી આલ્કોહૉલ-ફિનોલની Na સાથેની પ્રક્રિયા તેમને અલગ ઓળખવા ઉપયોગી નથી.
(C) તટસ્થ FeCl3ની ફિનોલની સાથે પ્રક્રિયા થઈને પરપલ- જાંબલી-લાલ રંગનો સંકીર્ણ બને છે પણ ઇથેનોલ પ્રક્રિયા કરતો નથી. આથી ફિનોલને ઇથેનોલથી ભિન્ન ઓળખવા માટે તટસ્થ FeCl3ના દ્રાવણની સાથે પ્રક્રિયા કરી શકાય છે.
![]()
પ્રશ્ન 5.
નીચે પૈકી કર્યો બેન્ઝાઇલિક આલ્કોહોલ છે ?
(A) C6H5 CH2 – CH2OH
(B) C6H5 – CH2OH
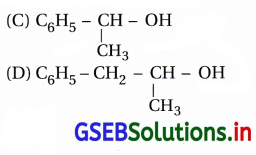
જવાબ
(B, C)
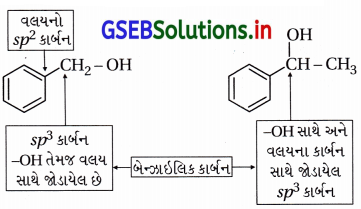
- “જો બેન્ઝિન વલયની સાથે સીધા જ જોડાયેલા sp3 કાર્બનની સાથે -OH સમૂહ હોય, તો જ તે બેન્ઝાઇલિક આલ્કોહૉલ કહેવાય છે.”
- ફક્ત (B) અને (C)માં -OH સમૂહ ધરાવતો sp3 કાર્બન બેન્ઝિન વલયના કાર્બન (sp2) સાથે સીધો જ જોડાય છે અને
આથી (B) અને (C) બેન્ઝાઇલિક આલ્કોહૉલ છે.
ટૂંક જવાબી પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
ગ્લિસરોલનું બંધારણ અને IUPAC નામ શું છે ?
ઉત્તર:
બંધારણ : 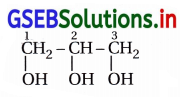
IUPAC નામ : પ્રોપેન-1,2,3-ટ્રાયોલ
પ્રશ્ન 2.
નીચેનાં સંયોજનોનાં IUPAC નામ લખો.
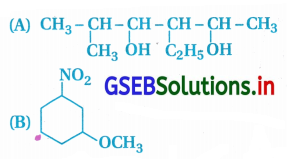
ઉત્તર:
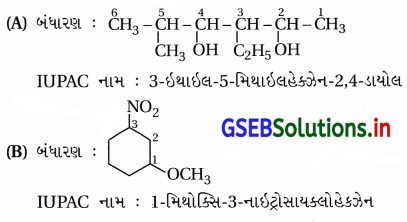
પ્રશ્ન 3.
નીચે આપેલા સંયોજનનું IUPAC નામ આપો :

ઉત્તર:

IUPAC નામ : 3-મિથાઇલપેન્ટ-2-ઇન-1,2-ડાયોલ
પ્રશ્ન 4.
આલ્કોહોલની પાણીમાં દ્રાવ્યતા માટે જવાબદાર પરિબળોનાં નામ લખો.
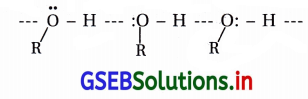
ઉત્તર:
(a) આંતરઆણ્વીય હાઇડ્રોજનબંધ અને તેની પ્રબળતા : “જેમ આલ્કોહૉલમાં પાણી સાથે આંતરઆણ્વીય હાઇડ્રોજન બંધ વધારે પ્રબળ હોય તેમ તે આલ્કોહૉલની જલદ્રાવ્યતા અધિક હોય છે.”
(b) -OH સમૂહની સંખ્યા : આલ્કોહૉલમાં જેમ -OH સમૂહની સંખ્યા વધારે હોય તેમ તેની દ્રાવ્યતા વધારે હોય છે.
દા.ત., CH3CH2OH, CH2OHCH2OH અને CH2OHCHOHCH2OHની દ્રાવ્યતા વધતા ક્રમમાં છે.
(c) આલ્કાઇલ સમૂહનું કદ : જેમ OH સમૂહ સાથે જોડાયેલા આલ્કાઇલ સમૂહનું કદ મોટું હોય તેમ તેની દ્રાવ્યતા ઓછી હોય છે.
દા.ત., CH3CH2CH2CH2OH, (CH3)2CHCH2OH અને (CH3)3C-OHની દ્રાવ્યતા ઊતરતા ક્રમમાં છે.
પ્રશ્ન 5.
વિકૃત (denatured) આલ્કોહૉલ એટલે શું ?
ઉત્તર:
- આલ્કોહૉલ (ઇથેનોલ)નો ઉદ્યોગોમાં અને દ્રાવક તરીકે વિશાળ ઉપયોગ થાય છે. આ સાથે જ લોકો પીવા માટે પણ તેનો ઉપયોગ કરે છે.
- લોકો ઔદ્યોગિક આલ્કોહૉલનો પીવા માટે ઉપયોગ ન કરે તે માટે તેમાં (i) થોડોક કૉપર સલ્ફેટ ઉમેરીને તે રંગીન બનાવાય છે અને (ii) થોડુંક પિરિડીન ભેળવીને દુર્ગંધયુક્ત બનાવાય છે. “આ પ્રકારે ઇથેનોલને પીવા માટે અયોગ્ય બનાવવો, તેને ‘વિકૃત આલ્કોહૉલ’ કહે છે.”
![]()
પ્રશ્ન 6.
નીચેના રૂપાંતરણ માટે પ્રક્રિયક દર્શાવો.
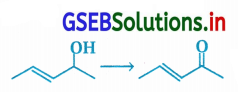
ઉત્તર:
- આ પ્રક્રિયામાં દ્વિતીયક આલ્કોહૉલ CH3CH=CH-CHOHCH3નું કિટોનમાં રૂપાંતર થાય છે.
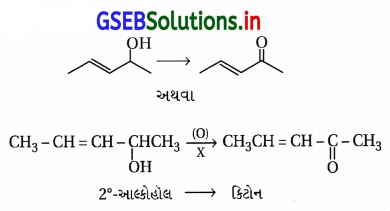
- આ રૂપાંતર કરતા પ્રક્રિયક X તરીકે નીચેનાનો ઉપયોગ કરી શકાય છે :
(i) ક્રોમિકએનહાઇડ્રાઇડ (CrO3)
(ii) 573 K તાપમાને કૉપર પરથી આલ્કોહૉલને પસાર કરવો.
પ્રશ્ન 7.
2-ક્લોરોઇથેનોલ અને ઇથેનોલમાંથી કયું વધારે ઍસિડિક છે અને શા માટે ?
ઉત્તર:
(i) ઇથેનોલની સરખામણીમાં 2-ક્લોરોઇથેનોલ વધારે ઍસિડિક છે.
(ii) કારણ કે 2-ક્લોરોઇથેનમાંનું ક્લોરિન પોતાની ઇલેક્ટ્રૉન આકર્ષક પ્રેરક અસર (-I)થી ઇલેક્ટ્રૉનને પોતાની નજીક ખેંચે છે અને પરિણામે O-H બંધ નિર્બળ બને છે.
 |
 |
| વધારે ઍસિડિક | ઓછો ઍસિડિક |
| ક્લોરિનની (-I) અસરના કારણે C – O બંધના ઇલેક્ટ્રૉન ઑક્સિજનથી દૂર જવાથી O-H બંધ નિર્બળ બનતા H આપવાની ક્ષમતા વધારે છે. | ઇથેનોલમાં O-H બંધ પ્રમાણમાં પ્રબળ હોવાથી 2-ક્લોરોઇથેનોલના કરતાં ઓછો ઍસિડિક છે. |
પ્રશ્ન 8.
ઇથેનોલનું ઇથેનાલમાં રૂપાંતર થવા માટેનો પ્રક્રિયક દર્શાવો.
ઉત્તર:

આ રૂપાંતરણ કરવા માટે વપરાતા પ્રક્રિયક (X) નીચે પ્રમાણે છે :
(i) નિર્જળ માધ્યમમાં CrO3
(ii) PCC (પિરિડિનિયમ ક્લોરોક્રોમેટ જે ક્રોમિયમ ટ્રાયઑક્સાઇડનું પિરિડીન અને HClનું સંકીર્ણ છે.
(iii) 1°-આલ્કોહૉલને 573 K તાપમાને તપાવેલા કૉપર ઉપર પસાર કરીને
પ્રશ્ન 9.
ઇથેનોલનું ઇથેનોઇક ઍસિડમાં રૂપાંતર થવા માટેનો પ્રક્રિયક દર્શાવો.
ઉત્તર:

પ્રાથમિક આલ્કોહૉલનું કાર્બોક્સિલિક ઍસિડમાં પરિવર્તન કરવા માટે પ્રબળ ઑક્સિડેશનકર્તાનો ઉપયોગ કરાય છે.
દા.ત.,
(i) આલ્કલાઇન KMnO4 અને પછી ઍસિડીકરણ
(ii) ઍસિડિક KMnO4
(iii) ઍસિડિક પોટૅશિયમ ડાયક્રોમેટ (K2Cr2O7)
પ્રશ્ન 10.
૦-નાઇટ્રોફિનોલ અને p-નાઇટ્રોફિનોલમાંથી કયું વધુ બાષ્પશીલ છે ? સમજાવો.
ઉત્તર:
- ૦-નાઇટ્રોફિનોલ કરતાં p-નાઇટ્રોફિનોલ વરાળ નિસ્યંદનમાં વધારે બાષ્પશીલ છે અને પાણીની વરાળની સાથે બાષ્પ બનીને છૂટો પડે છે.
- કારણ કે ૦-નાઇટ્રોફિનોલમાં આંતઃઆણ્વીય H-બંધન હોય છે જેથી બાષ્પમાં ફેરવાઈ શકે છે પણ p-નાઇટ્રોફિનોલમાં આંતર- આણ્વીય H-બંધન હોવાથી સરળતાથી બાષ્પમાં ફેરવાતો નથી.
![]()
પ્રશ્ન 11.
૦-નાઇટ્રોફિનોલ અને ૦-ક્રેસોલમાંથી કયું વધુ ઍસિડિક છે ?
ઉત્તર:
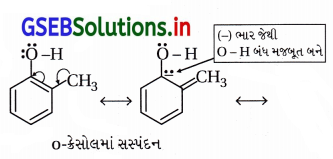
(i) o-નાઇટ્રોફિનોલ તે ૦-ક્રેસોલના કરતાં વધારે ઍસિડિક છે,
કારણ કે -નાઇટ્રોફિનોલમાંનું (-NO2) સમૂહ ઇલેક્ટ્રૉન આકર્ષક છે, જેથી ઇલેક્ટ્રૉનને આકર્ષી O – H બંધ નિર્બળ બનાવી ઍસિડિકતામાં વધારો કરે છે. વળી સસ્પંદનમાં ઇલેક્ટ્રૉનયુગ્મ સ્વીકારીને O – H બંધ નિર્બળ કરે છે.
(ii) o-ક્રેસોલમાં -CH3 સમૂહ છે જે ઇલેક્ટ્રૉન મુક્તકર્તા છે, ઇલેક્ટ્રૉન આપી O – H બંધ મજબૂત સહસંયોજક કરી ઍસિડિકતા ઘટાડે છે. વળી, -CH3 સમૂહ હાઇપર કૉન્ફ્લેગેશન (અબંધ સસ્પંદન)થી O – H બંધની પ્રબળતા ઘટાડે છે.
પ્રશ્ન 12.
ફિનોલની બ્રોમિન જળ સાથે પ્રક્રિયા કરતાં સફેદ અવક્ષેપ મળે છે. બનતા સંયોજનનું બંધારણ અને નામ આપો.
ઉત્તર:
પ્રશ્ન 13.
નીચેના આપેલાં સંયોજનોને ઍસિડિકતાના ચઢતા ક્રમમાં ગોઠવો અને વાજબી સમજૂતી આપો.
ફિનોલ, ૦-નાઇટ્રોફિનોલ, 0-ક્રેસોલ
ઉત્તર:
(a) ઍસિડિકતાનો ચઢતો ક્રમ :
૦-ક્રેસોલ < ફિનોલ < ૦-નાઇટ્રોફિનોલ
(b) સમજૂતી : આ ત્રણેયમાં -OH ફિનોલિક સમૂહ છે.
(i) ૦-નાઇટ્રોફિનોલમાં રહેલુ નાઇટ્રો (-NO2) સમૂહ ઇલેક્ટ્રૉન આકર્ષક (-I) પ્રેરક અસર ધરાવે છે જેથી તે ઍસિડિકતામાં વધારો કરે છે. વળી સસ્પંદનમાં -NO2 સમૂહ ઇલેક્ટ્રૉન બહાર ખેંચી O-H બંધ નિર્બળ બનાવી ઍસિડિક પ્રબળતા વધે છે.
(ii) ત્રણેયમાં ૦-ક્રેસોલ સૌથી નિર્બળ ઍસિડ છે. તેમાંનું -CH3 સમૂહ ઇલેક્ટ્રૉન મુક્તકર્તા (+I) પ્રેરક અસર વડે O-H બંધની પ્રબળતા વધારે છે.
સસ્પંદનમાં -CH3 ઇલેક્ટ્રૉનયુગ્મ વલયમાં મોકલી O-H બંધ મજબૂત કરે છે.
પ્રશ્ન 14.
આલ્કોહોલ સક્રિય ધાતુ જેવી કે Na, K વગેરે સાથે પ્રક્રિયા કરી અનુવર્તી આલ્કોક્સાઇડ આપે છે. પ્રાથમિક, દ્વિતીયક અને તૃતીયક આલ્કોહોલની સોડિયમ ધાતુ સાથેની
પ્રતિક્રિયાત્મકતાનો ઊતરતો ક્રમ લખો.
ઉત્તર:
- RCH2OH > R2CHOH > R3 C-OH
1°-આલ્કોહૉલ 2°-આલ્કોહૉલ 3°-આલ્કોહૉલ
→ Na સાથે પ્રતિક્રિયાત્મકતા ઘટે →
→ આલ્કાઇલ સમૂહોની (+I) વધે છે.
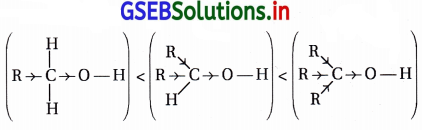
→ (જેથી O-H બંધની પ્રબળતા વધે છે અને ઍસિડિક ગુણ ઘટતો જાય છે) →
- સોડિયમ ધાતુ બેઝિક સ્વભાવની છે અને 1°,2°,3° આલ્કોહૉલની ઍસિડિકતા ઘટતા, સોડિયમ સાથે પ્રતિક્રિયાત્મકતા ઘટતી જાય છે.
પ્રશ્ન 15.
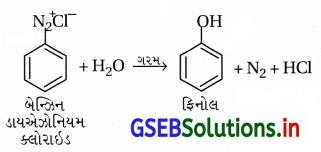
બેન્ઝિન ડાયેઝોનિયમ ક્લોરાઇડને પાણીની સાથે ગરમ કરતાં શું થાય છે ?
ઉત્તર:
બેન્ઝિન ડાયેઝોનિયમ ક્લોરાઇડને પાણીની સાથે ગરમ કરવાથી ફિનોલ બને છે.
![]()
પ્રશ્ન 16.
નીચેનાં સંયોજનોને ઍસિડિકતાના ઊતરતા ક્રમમાં ગોઠવો :
H2O, ROH, HC ≡ CH
ઉત્તર:
HC ≡ CH > H2O > ROH
→ ઍસિડિકતા ઘટે →
કારણ કે,

પ્રશ્ન 17.
આથવણ દ્વારા સુક્રોઝમાંથી ઇથેનોલની બનાવટની પ્રક્રિયા સાથે સંકળાયેલ સમીકરણ લખો અને ઉત્સેચકનું નામ આપો.
ઉત્તર:
- આમાં ઉત્સેચકો ઇન્વર્ટેઝ અને ઝાયમેઝ છે.

- ઉત્સેચક ઝાયમેઝ, યીસ્ટમાંથી મળે છે.
પ્રશ્ન 18.
પ્રોપેન-2-ઓનને તૃતીયક બ્યુટાઇલ આલ્કોહોલમાં કઈ રીતે રૂપાંતરિત કરી શકાય ?
ઉત્તર:
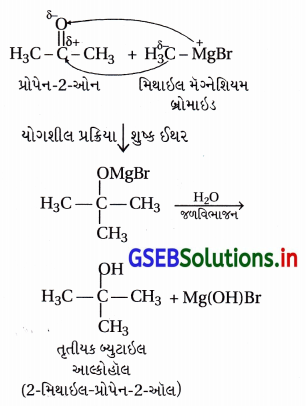
(i) કિટોનની ગ્રિગ્નાર્ડ પ્રક્રિયક સાથે પ્રક્રિયા કરી જળવિભાજન કરવાથી 3॰-આલ્કોહૉલ બને છે.
પ્રશ્ન 19.
C4H10O આણ્વીયસૂત્ર ધરાવતા આલ્કોહોલના સમઘટકોનાં બંધારણો લખો. આમાંનું કયું પ્રકાશક્રિયાશીલતા ધરાવે છે ?
ઉત્તર:
C4H10O અણુસૂત્રવાળા આલ્કોહૉલના બંધારણ, નામ અને પ્રકાશક્રિયાશીલતા નીચે પ્રમાણે છે :
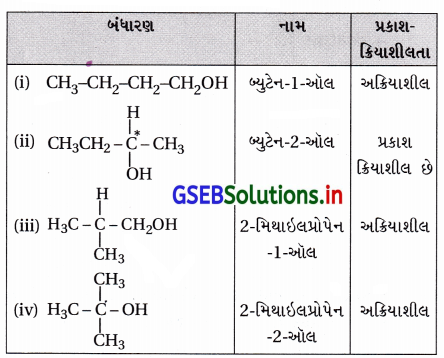
“જે સંયોજનમાં કાર્બન પરમાણુની સાથે ચાર ભિન્ન સમૂહો જોડાયેલા હોય તે સંયોજન અસમમિત (કિરાલ) હોય છે અને પ્રકાશક્રિયાશીલ હોય છે.” આ અનુસાર ઉપરના ચારમાંથી ફક્ત બ્યુટેન-2-ઑલ પ્રકાશક્રિયાશીલ છે.
પ્રશ્ન 20.
આલ્કોહોલમાં આવેલા -OH સમૂહ કરતાં ફિનોલમાં આવેલો -OH સમૂહ શા માટે વધુ મજબૂતાઈથી જોડાયેલો છે તે સમજાવો.
ઉત્તર:
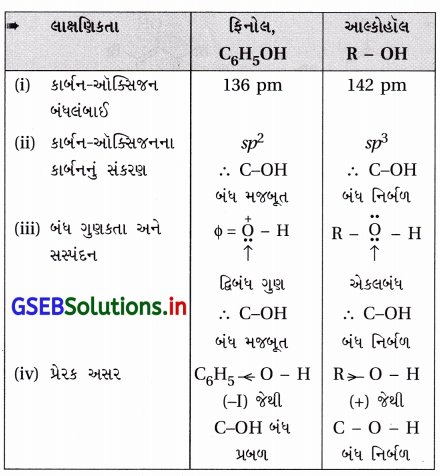
(iii) સસ્પંદન અસરથી : ફિનોલમાં સસ્પંદનથી C – O વચ્ચે દ્વિબંધ આવે છે. ઉપરનાં કારણોથી ફિનોલમાં C – OH બંધ આલ્કોહૉલ કરતાં પ્રબળ છે અને ફિનોલમાં -OH સમૂહ આલ્કોહૉલના કરતાં વધારે પ્રબળતાથી જોડાયેલ છે. જોકે ફિનોલનો H સરળતાથી મુક્ત થાય છે.
![]()
પ્રશ્ન 21.
ફિનોલમાં કેન્દ્રાનુરાગી વિસ્થાપન પ્રક્રિયાઓ શા માટે સામાન્ય નથી તે સમજાવો.
ઉત્તર:
(a) ફિનોલમાં -OH સમૂહનું કેન્દ્રાનુરાગી વડે વિસ્થાપન મુશ્કેલ છે જેથી વિસ્થાપન પ્રક્રિયાઓ સામાન્ય નથી. નીચે આપેલ પ્રક્રિયા થતી નથી.
C6H5 – OH + :Nu– → C6H5 – Nu + OH–
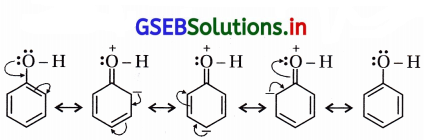
કારણ કે (i) -OH સાથેનો કાર્બન sp2 છે, (ii) C6H5 = \(\stackrel{+}{\mathrm{O} H}\) જેવો દ્વિબંધ સસ્પંદનથી આવે છે. (નીચેના બંધારણ પ્રમાણે)
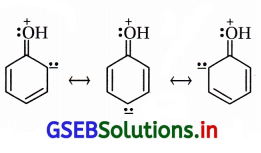
(iii) SN2 પ્રક્રિયા શક્ય નથી કારણ કે C6H5 નો અવકાશીય અવરોધ છે અને SN1 શક્ય નથી કારણ કે \(\stackrel{+}{\mathrm{C}}_6 \mathrm{H}_5\) કેટાયન
બનતો નથી.
(b) ફિનોલના બેન્ઝિન વલયમાં -Hનું વિસ્થાપન કેન્દ્રાનુરાગી વડે શક્ય નથી કારણ કે વલયમાં સસ્પંદનથી ઋણભાર આવતાં કેન્દ્રાનુરાગી વલયથી આકર્ષાતો નથી પણ અપાકર્ષણ પામે છે.
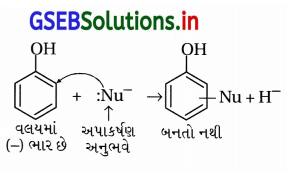
પ્રશ્ન 22.
આલ્કીનમાંથી આલ્કોહોલની બનાવટમાં આલ્કીન કાર્બન પરમાણુ પર ઇલેક્ટ્રોન અનુરાગીનો હુમલો સમાયેલો છે. ક્રિયાવિધિ સમજાવો.
ઉત્તર:
(i) આલ્કીનમાંથી આલ્કોહૉલના બનાવટની પ્રક્રિયા :
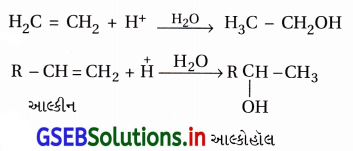
(ii) ક્રિયાવિધિ :
આલ્કીનના જલીયકરણની પ્રક્રિયા ઇલેક્ટ્રૉન- અનુરાગી યોગશીલ પ્રક્રિયા નીચેના ત્રણ તબક્કામાં થાય છે.
તબક્કો-1 : ઇલેક્ટ્રૉનઅનુરાગી H3O+ (અથવા H+) નો આલ્કીનમાં હુમલો થઈ આલ્કીનનું પ્રોટૉનેશન થઈને (વધારે સ્થાયી) કાર્બોકેટાયન બને છે.
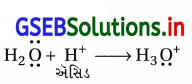
આમાં C=Cનો -બંધ તૂટતો હોવાથી ધીમો અને વેનિર્ણાયક તબક્કો નીચે પ્રમાણે છે.
અહીં ઇલેક્ટ્રૉનઅનુરાગી H3O(H+) ઉમેરાતાં પ્રક્રિયા ઇલેક્ટ્રૉન અનુરાગી છે.
તબક્કો-૩ : પ્રોટૉનેટેડ આલ્કોહૉલના વિપ્રોટોનીકરણથી આલ્કોહૉલ બને છે.
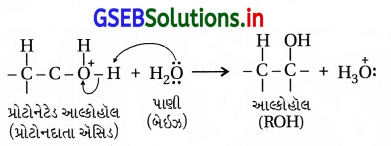
અહીં પ્રક્રિયામાં H2O ઉમેરાય છે અને ક્રિયાવિધિ ઇલેક્ટ્રૉન-અનુરાગી યોગશીલ છે.
પ્રશ્ન 23.
શા માટે 0 = C = 0 અધ્રુવીય છે જ્યારે R – O – R ધ્રુવીય છે તે સમજાવો.
ઉત્તર:
- CO2 રેખીય છે, તેમાં C – O બંધ ધ્રુવીય છે બન્ને C – O બંધની ધ્રુવીયતા સમાન અને વિરુદ્ધ દિશામાં છે, રેખીય અણુમાં બે વિરુદ્ધ ધ્રુવીયતાનું પરિણામી મૂલ્ય શૂન્ય થવાથી CO2 અણુ અધ્રુવીય છે.

- ઈથર R – O – R ધ્રુવીય છે તેમાં ઑક્સિજનનું sp3 સંકરણ થઈ વિકૃત સમચતુલકીય કોણીય V આકાર છે.
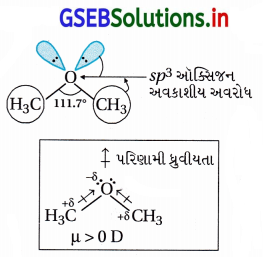
- મિથાઇલ-ઑક્સિજન બંધ H3C
 O ધ્રુવીય છે. બે
O ધ્રુવીય છે. બે
H3C – Oની ધ્રુવીયતા પૂરક છે. અને તેમનો સરવાળો શૂન્ય નથી, જેથી ઈથર સંયોજનો ધ્રુવીય હોય છે.
પ્રશ્ન 24.
સાંદ્ર HCl અને ZnCl2 (લુકાસ પ્રક્રિયક) સાથેની આલ્કોહોલના ત્રણેય પ્રકારોની પ્રતિક્રિયાત્મકતા શા માટે જુદી-જુદી છે ?
ઉત્તર:
(i) સાંદ્ર HCl અને ZnCl2 નો મિશ્ર પ્રક્રિયક, તેની આલ્કોહૉલ સાથેની પ્રક્રિયાને SN1 ક્રિયાવિધિના માર્ગે લઈ જાય છે, જેથી પ્રથમ C-OH બંધ તૂટીને સ્થાયી કાર્બોકેટાયન બને છે
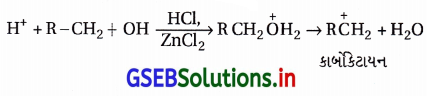
(ii) કાર્બોકેટાયન બનવાની સરળતા અનુસાર લુકાસ પ્રક્રિયકની પ્રક્રિયાની સરળતા રહે છે. ૩° > 2° > 1° અનુસાર કાર્બોકેટાયનની સ્થાયિતા હોવાથી આલ્કોહૉલની લુકાસ પ્રક્રિયા માટેની પ્રતિક્રિયાત્મકતા

“આલ્કોહૉલનો પ્રકાર બદલાતાં લુકાસ પ્રક્રિયક સાથેની પ્રતિક્રિયાત્મકતા બદલાય છે.”
પ્રશ્ન 25.
ફિનોલમાંથી એસ્પિરિનના રૂપાંતરણ માટેના તબક્કાઓ લખો.
ઉત્તર:
તબક્કો-1 : ફિનોલમાંથી સેલિસિલિક ઍસિડ
તબક્કો-2 : સેલિસિલિક ઍસિડમાંથી ઍસ્પિરિન (એસિટિલેશન) આ બંને પ્રક્રિયાના તબક્કા નીચેના સમીકરણમાં છે.
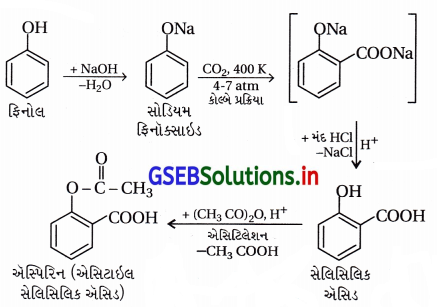
![]()
પ્રશ્ન 26.
નાઇટ્રેશન ઇલેક્ટ્રોનઅનુરાગી ઍરોમેટિક વિસ્થાપનનું ઉદાહરણ છે અને તેનો વેગ બેન્ઝિન વલયમાં પહેલેથી હાજર સમૂહ ઉપર આધારિત છે. બેઝિન અને ફિનોલમાંથી કયું વધુ સરળતાથી નાઇટ્રેશન પામશે અને શા માટે ?
ઉત્તર:
- બેન્ઝિન અને ફિનોલમાંથી ફિનોલનું નાઇટ્રેશન વધારે સરળતાથી થાય છે.
- કારણ કે ફિનોલમાંનું હાઇડ્રૉક્સિ (-OH) સમૂહ તેમાંના ઑક્સિજન ઉપરનું અબંધકારક ઇલેક્ટ્રૉનયુગ્મ બેન્ઝિન વલયમાં, પોતાના ઑર્થો-પૅરા સ્થાને આપે છે. ફિનોલના વલયમાં, ફક્ત બેન્ઝિનની સરખામણીમાં ઇલેક્ટ્રૉન ધનિકતા વધારે હોય છે.
- “-OH સમૂહ વલયને ઇલેક્ટ્રૉનઅનુરાગી પ્રક્રિયાઓ માટે સક્રિયકારક છે જેથી બેન્ઝિનની સરખામણીમાં ફિનોલનું નાઇટ્રેશન સરળ છે અને મંદ નાઇટ્રિક ઍસિડ પણ ફિનોલનું નાઇટ્રેશન કરી શકે છે.

પ્રશ્ન 27.
કોલ્બે પ્રક્રિયામાં ફિનોલની જગ્યાએ ફિનોક્સાઇડ આયનની કાર્બન ડાયોક્સાઇડ સાથે પ્રક્રિયા કરવામાં આવે છે. શા માટે ?
ઉત્તર:
અહીં નિર્બળ ઇલેક્ટ્રૉનઅનુરાગી CO2 છે અને ફિનોલના કરતાં ફિનૉક્સાઇડ આયન (C6H5O–) ઇલેક્ટ્રૉનઅનુરાગી ઍરોમેટિક વિસ્થાપન પ્રક્રિયા પ્રત્યે વધારે પ્રતિક્રિયાત્મક છે, જેથી સોડિયમ ફિનૉક્સાઇડ સાથે પ્રક્રિયા કરાય છે.
પ્રશ્ન 28.
મિથેનોલ કરતાં ફિનોલની દ્વિધ્રુવીય ચાકમાત્રા ઓછી છે ? શા માટે ?
ઉત્તર:

પ્રશ્ન 29.
વિલિયમસન સંશ્લેષણ દ્વારા ઈથર બનાવી શકાય છે. આમાં આલ્કાઇલ હેલાઇડની સોડિયમ આલ્કોસાઇડ સાથે પ્રક્રિયા કરવામાં આવે છે. સમજાવો કે આ પદ્ધતિ દ્વારા ડાય-તૃતીયક બ્યુટાઇલ ઈથર બનાવી શકાતો નથી.
ઉત્તર:
- સોડિયમ તૃતીયક બ્યુટૉક્સાઇડ + તૃતીયક બ્યુટાઇલ બ્રોમાઇડ :
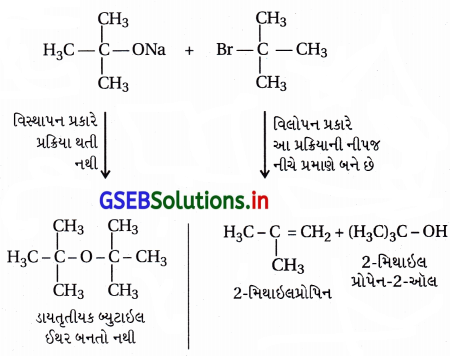
- હંમેશાં વિસ્થાપન અને વિલોપન પ્રક્રિયાઓ હરીફાઈથી થાય છે. આ પ્રક્રિયામાં (CH3)3 C – O– કેન્દ્રાનુરાગી છે, જે પ્રબળ બેઇઝ પણ છે, વળી, (CH3)3 C – Brમાં અવકાશીય અવરોધના કારણે C – Br બંધ તોડી વિસ્થાપન પ્રક્રિયા કરી શકતો નથી પણ 3°-કાર્બોનિયમ આયન બનાવી વિલોપન નીપજ રચે છે. આથી (CH3)3 C – O – C (CH3)3 બનતો નથી.
પ્રશ્ન 30.
આલ્કોહૉલમાં C – O – H બંધકોણ ચતુલકીય ખૂણા કરતાં થોડોક ઓછો છે જ્યારે ઈથરમાં C – O – C બંધકોણ થોડોક વધારે છે. શા માટે ?
ઉત્તર:
 ખૂણો C – O – H 108.9° છે જે સમચતુલકીય ખૂણા 109°28′ કરતાં થોડોક ઓછો છે. |
 ખૂણો C – O – C 111.7° છે જે આલ્કોહૉલના ખૂણા કરતાં થોડોક વધારે છે. |
| આલ્કોહૉલમાં ઑક્સિજનના અસહભાગિત ઇલેક્ટ્રૉનયુગ્મો વચ્ચે અપાકર્ષણ થવાથી C – O – H બંધકોણ સમચતુલકીય ખૂણા 109°28′ ના કરતાં સહેજ ઓછો છે. આમાં, H3C- અને -H અબંધકારક ઇલેક્ટ્રૉનયુગ્મથી દૂર ધકેલાય છે. | ઈથરમાં પણ ઑક્સિજનના અસહભાગિત ઇલેક્ટ્રૉનયુગ્મો વચ્ચે અપાકર્ષણ થાય છે. આ ઉપરાંત મિથાઇલ સમૂહના બે C – O બંધના બંધકા૨ક ઇલેક્ટ્રૉનયુગ્મો વચ્ચેનાં અપાકર્ષણ તથા મોટા કદના બે (−R) સમૂહો વચ્ચેની પારસ્પરિક અપાકર્ષણ ક્રિયાના કારણે ઈથરમાં C – O – C બંધકોણ સમચતુષ્કૃલકીય બંધકોણના કરતાં સહેજ વધારે (111.7°) હોય છે. |
ઈથરમાં બે આલ્કાઇલ સમૂહ અવકાશીય અવરોધની અડચણ ઘટાડવા પરસ્પર દૂર ધકેલાવાથી બંધકોણ sp3 ખૂણાથી વધે છે.
![]()
પ્રશ્ન 31.
નીચા આણ્વીયદળ ધરાવતા આલ્કોહોલ શા માટે પાણીમાં દ્રાવ્ય છે તે સમજાવો.
ઉત્તર:
- આલ્કોહૉલ અને પાણીની વચ્ચે આંતર-આણ્વીય હાઇડ્રોજન બંધ બનવાના કારણે આલ્કોહૉલ પાણીમાં દ્રાવ્ય હોય છે.
આલ્કોહૉલની દ્રાવ્યતા જળવિરાગી આલ્કાઇલ સમૂહોના કદ વધવાની સાથે ઘટે છે. નીચા આણ્વીયદળ ધરાવતા મોટાભાગના આલ્કોહૉલ સંયોજનો પાણી સાથેના બધા પ્રમાણમાં મિશ્રિત હોય છે. - આલ્કાઇલ સમૂહ જળવિરાગી હોવાથી જો આલ્કાઇલ સમૂહ મોટું હોય તો દ્રાવ્યતા ઘટે છે, એટલે કે નીચા આણ્વીયદળના આલ્કોહૉલ પાણીમાં દ્રાવ્ય છે.
CH3CH2OH > CH3CH2CH2OH > CH3CH2CH2CH2OH ……………… પ્રમાણે દ્રાવ્યતા છે.
પ્રશ્ન 32.
ફિનોલ કરતાં p-નાઇટ્રોફિનોલ શા માટે વધુ ઍસિડિક છે તે સમજાવો.
ઉત્તર:
(i) o-નાઇટ્રોફિનોલમાં -NO2 અને -OH ટૂંકા અંતરે હોવાથી NO2ના ઑક્સિજન અને OHના હાઇડ્રોજન વચ્ચે આંતઃઆણ્વીય હાઇડ્રોજન બંધન હોવાથી મેં સરળતાથી મુક્ત થતો નથી અને ઍસિડિકતા ઓછી હોય છે.
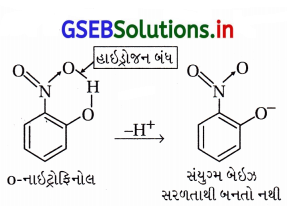
(ii) સસ્પંદનમાં ૦-નાઇટ્રોફિનૉક્સાઇડની સ્થાયિતામાં થતો વધારો p-નાઇટ્રોફિનૉક્સાઇડની સ્થાયિતામાં થતા વધારાના કરતાં ઓછો હોય છે જેના કારણે પણ ૦-નાઇટ્રોફિનોલ ઓછો ઍસિડિક છે.
૦-નાઇટ્રોફિનોલ pKa = 7.2 : ઓછો ઍસિડિક
p-નાઇટ્રોફિનોલ pKa = 7.1 : વધારે ઍસિડિક
જોકે બન્નેની ઍસિડિકતામાં મોટો તફાવત નથી.
પ્રશ્ન 33.
લગભગ સમાન આણ્વીયદળ ધરાવતા આલ્કોહોલ અને ઈથરનાં ઉત્કલનબિંદુ શા માટે જુદાં-જુદાં છે તે સમજાવો.
ઉત્તર:
- દા.ત., ઇથેનોલ અને મિથોક્સિમિથેન બન્ને સમૂહ સમઘટકો (C2H6O)ના આણ્વીયદળ સમાન છે પણ ઇથેનોલનું ઉત્કલનબિંદુ 351K જ્યારે મિથોક્સિમિથેનનું 248K છે, બંનેમાં ઉત્કલનબિંદુ ભિન્ન છે.
- આલ્કોહૉલમાં ભિન્ન અણુઓની વચ્ચે આંતરઆણ્વીય હાઇડ્રોજનબંધ છે જેથી ભિન્ન અણુઓ વધારે પ્રબળ બંધથી જકડાયેલ (આકર્ષાયેલ) રહેવાના કા૨ણે આલ્કોહૉલના ઉત્કલનબિંદુ વધારે હોય છે.
- ઈથર સંયોજનમાં અણુઓની વચ્ચે હાઇડ્રોજન બંધ જેવા વધારાના આકર્ષણ બળોનો અભાવ હોવાથી, ભિન્ન અણુઓ વચ્ચે આકર્ષણ બળો નિર્બળ છે.
- આમ, સમાન આણ્વીયદળના આલ્કોહૉલ અને ઈથર સંયોજનોમાં અણુઓ વચ્ચેના આકર્ષણ બળોની માત્રા સમાન નથી જેથી તેમના ઉત્કલનબિંદુ ભિન્ન હોય છે.
પ્રશ્ન 34.
ફિનોલમાં આવેલ કાર્બન-ઑક્સિજન બંધ મિથેનોલમાંના બંધ કરતાં થોડાક વધુ મજબૂત છે. શા માટે ?
ઉત્તર:
(i) પ્રેરક અસરના કારણે ફિનોલમાં C – O બંધ મિથેનોલમાંના C – O બંધના સાપેક્ષ પ્રબળ છે.

(ii) સસ્પંદન અસર : ફિનોલના સસ્પંદન સ્વરૂપોમાં કાર્બન- ઑક્સિજન વચ્ચે દ્વિબંધ આવે છે જેથી કાર્બન-ઑક્સિજન બંધ પ્રબળ છે જે મિથેનોલમાં ફક્ત એકલબંધ છે.
આથી ફિનોલમાં કાર્બન-ઑક્સિજન બંધ પ્રબળ છે.
પ્રશ્ન 35.
પાણી, ઇથેનોલ અને ફિનોલને ઍસિડિક પ્રબળતાના ચઢતા ક્રમમાં ગોઠવો તથા તમારા જવાબ માટે કારણ આપો.
ઉત્તર:
(a) ઍસિડિકતાનો ચઢતો ક્રમ નીચે પ્રમાણે છે :
ઇથેનોલ < પાણી < ફિનોલ
(b) કારણ કે,
(i) પ્રેરક અસર : ઇથેનોલમાં -OH સાથે ઇલેક્ટ્રૉન મુક્તકર્તા ઇથાઇલ સમૂહ છે જે ઍસિડિકતા ઘટાડે છે અને ફિનોલમાં -OH સાથે ઇલેક્ટ્રૉન આકર્ષક ફિનાઇલ સમૂહ છે જે ઍસિડિકતા વધારે છે.
∴ ઇથેનોલના કરતાં ફિનોલ વધારે ઍસિડિક છે
(ii) સત્પંદન અસર : સત્પંદન અસ૨ના અભાવના કારણે આલ્કોહૉલના સાપેક્ષ આલ્કૉક્સાઇડ આયન વધારે સ્થાયી નથી.
ફિનોલમાં અને ફિનૉક્સાઇડ આયનમાં સસ્પંદન શક્ય છે, ફિનોલમાં વીજભારનું અલગીકરણ પણ ફિનૉક્સાઇડ આયનમાં ઋણભાર વિસ્થાનીકૃત થઈ વિસ્તરેલો હોવાથી ફિનોલ કરતાં ફિનૉક્સાઇડ વધારે સ્થાયી છે. આ કારણથી ફિનોલ વધારે ઍસિડિક છે.
આમ, ઇથેનોલ પાણી કરતાં ઓછો અને ફિનોલ પાણીના કરતાં વધારે ઍસિડિક છે.
![]()
જોડકાં પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
કોલમ – I માં આપેલા સંયોજનનાં બંધારણોને કૉલમ – IIમાં આપેલાં નામ સાથે જોડો.

ઉત્તર:
(A – 4), (B – 3), (C – 6), (D – 1), (E – 7), (F – 2)
પ્રશ્ન 2.
કોલમ – Iમાં આપેલા શરૂઆતનાં પદાર્થોને HI સાથેની પ્રક્રિયા દ્વારા મળતી નીપજો કૉલમ – II સાથે જોડો.
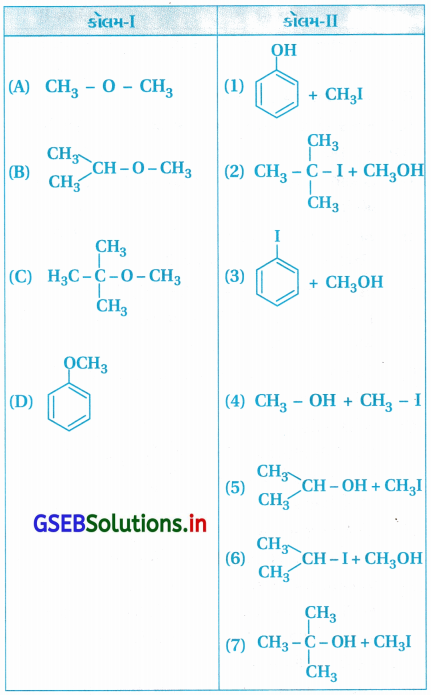
ઉત્તર:
(A – 4), (B – 5), (C – 2), (D – 1)
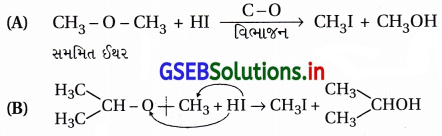
અસમિત ઈથ૨, જેથી નાના -R(-CH3)
સાથે – O – CH3 બંધ તૂટી CH3I બને છે.
(C) તૃતીયક બ્યુટાઇલ છે, જે સ્થાયી કાર્બોકેટાયન રચે જેથી (H3C)3 C – O નો C – O બંધ તૂટે છે અને (CH3)3CI તથા CH3OH બને છે.
(D) C6H5 – O CH3 નો C6H5 – O બંધ પ્રબળ હોવાથી તૂટતો નથી જેથી C6H5OH અને CH3I બને છે.
પ્રશ્ન 3.
કૉલમ – Iમાં આપેલી વિગતોને કૉલમ – IIમાં આપેલી વિગતો સાથે જોડો.
| કોલમ – I | કોલમ – II |
| (A) કાર એન્જિનમાં વપરાતો ઍન્ટિફ્રિઝ | (1) તટસ્થ ફેરિક ક્લોરાઇડ |
| (B) પરફ્યુમમાં વપરાતો દ્રાવક | (2) ગ્લિસરોલ |
| (C) પિક્રિક ઍસિડ માટેનો શરૂઆતનો પદાર્થ | (3) મિથેનોલ |
| (D) વૂડ સ્પિરિટ | (4) ફિનોલ |
| (E) ફિનોલિક સમૂહની પરખ માટે વપરાતો પ્રક્રિયક | (5) ઇથીલિન ગ્લાયકોલ |
| (F) સાબુ ઉધોગની ઉપનીપજ કે જે કોસ્મેટિકની બનાવટમાં ઉપયોગી | (6) ઇથેનોલ |
ઉત્તર:
(A – 5), (B – 6), (C – 4), (D – 3), (E – 1), (F – 2)
| કોલમ – I | કોલમ – II |
| (A) કાર એન્જિનમાં વપરાતો ઍન્ટિફ્રિઝ | (5) ઇથીલિન ગ્લાયકોલ |
| (B) પરફ્યુમમાં વપરાતો દ્રાવક | (6) ઇથેનોલ |
| (C) પિક્રિક ઍસિડ માટેનો શરૂઆતનો પદાર્થ | (4) ફિનોલ |
| (D) વૂડ સ્પિરિટ | (3) મિથેનોલ |
| (E) ફિનોલિક સમૂહની પરખ માટે વપરાતો પ્રક્રિયક | (1) તટસ્થ ફેરિક ક્લોરાઇડ |
| (F) સાબુ ઉધોગની ઉપનીપજ કે જે કોસ્મેટિકની બનાવટમાં ઉપયોગી | (2) ગ્લિસરોલ |
(A) 1, 2-ઇથેનડાયોલ તે ઇથીલિન ગ્લાયકોલ છે અને તે ઍન્ટિફ્રીજ દ્રવ્ય તરીકે કારમાં વપરાય છે.
(B) ઇથેનોલ સારો ઔદ્યોગિક દ્રાવક છે તે સુગંધી દ્રવ્યોના દ્રાવક તરીકે વપરાય છે.
(C) પિક્રિક ઍસિડ (2,4,6-ટ્રાયનાઇટ્રોફિનોલ)ના ઉત્પાદન માટેનો પ્રારંભિક પદાર્થ ફિનોલ છે.
(D) પહેલા કાષ્ઠનિસ્યંદન કરીને મિથેનોલનું ઉત્પાદન કરાતું હતું અને મિથેનોલ (CH3OH) કાષ્ઠ-સ્પિરિટ તરીકે જાણીતો હતો.
(E) પ્રયોગશાળામાં ફિનોલિક સમૂહની હાજરીની કસોટી તટસ્થ FeCl3ના દ્રાવણ સાથેની પ્રક્રિયાથી કરાય છે. ફિનોલિક સમૂહ ધરાવતા સંયોજનની સાથે તટસ્થ FeCl3 નું દ્રાવણ લાલ-૫૨પલ- વાદળી-જાંબલી દ્રાવણ આપે છે.
(F) વનસ્પતિ તેલોનું સાબુનીકરણ કરવા કૉસ્ટિક સોડા (NaOH) સાથે ઉકાળવામાં આવે છે, જેમાં ઉપપેદાશ ગ્લિસરોલ (CH2OHCHOH CH2OH) બને છે.
![]()
પ્રશ્ન 4.
કોલમ – Iની વિગતને કોલમ – IIમાં આપેલી વિગતો સાથે જોડો.
| કોલમ – I | કોલમ – II |
| (A) મિથેનોલ | (1) ફિનોલનું o-હાઇડ્રોક્સિ-સેલિસિલિક ઍસિડમાં રૂપાંતરણ |
| (B) કોલ્લે પ્રક્રિયા | (2) ઇથાઇલ આલ્કોહોલ |
| (C) વિલિયમસન સંશ્લેષણ | (3) ફિનોલનું સેલિસાલ્ડિહાઇડમાં રૂપાંતરણ |
| (D) 2°-આલ્કોહોલનું કિટોનમાં રૂપાંતરણ | (4) વૂડ સ્પિરિટ |
| (E) રીમર-ટીમાન પ્રક્રિયા | (5) 573 K તાપમાને ગરમ કરેલું કોપર |
| (F) આથવણ | (6) આલ્કાઇલ હેલાઇડની સોડિયમ આલ્કૉક્સાઇડ સાથેની પ્રક્રિયા |
ઉત્તર:
(A – 4), (B – 1), (C – 6), (D – 5), (E – 3), (F – 2)
| કોલમ – I | કોલમ – II |
| (A) મિથેનોલ | (4) વૂડ સ્પિરિટ |
| (B) કોલ્લે પ્રક્રિયા | (1) ફિનોલનું o-હાઇડ્રોક્સિ-સેલિસિલિક ઍસિડમાં રૂપાંતરણ |
| (C) વિલિયમસન સંશ્લેષણ | (6) આલ્કાઇલ હેલાઇડની સોડિયમ આલ્કૉક્સાઇડ સાથેની પ્રક્રિયા |
| (D) 2°-આલ્કોહોલનું કિટોનમાં રૂપાંતરણ | (5) 573 K તાપમાને ગરમ કરેલું કોપર |
| (E) રીમર-ટીમાન પ્રક્રિયા | (3) ફિનોલનું સેલિસાલ્ડિહાઇડમાં રૂપાંતરણ |
| (F) આથવણ | (2) ઇથાઇલ આલ્કોહોલ |
(A) મિથેનોલ કાસ્પિરિટ (4) તરીકે જાણીતો છે
(B) કોલ્લે પ્રક્રિયાથી ફિનોલનું o-હાઇડ્રૉક્સિ બેન્ઝોઇક ઍસિડ (સેલિસિલિક)માં રૂપાંતર કરાય છે.
(C) આલ્કાઇલ હેલાઇડની સોડિયમ આલ્કૉક્સાઇડની સાથે પ્રક્રિયા કરીને ઈથર બનાવવો તે વિલિયમસન ઈથર સંશ્લેષણ છે.
RX + ‘ONa → R-O-R’ + NaX CX = Cl, Br, I
(D) દ્વિતીયક આલ્કોહૉલ (R – CHOH – R’)ને 573 K તાપમાને તપાવેલા કૉપરની ઉપર પસાર કરવાથી કિટોન (RCOR’) સંયોજન બને છે
(E) રીમર-ટીમાન પ્રક્રિયાથી ફિનોલમાંથી સેલિસાલ્ડિહાઇડ બનાવાય છે.
(F) સુક્રોઝનું આથવણ કરીને ઇથાઇલ આલ્કોહૉલનું ઉત્પાદન કરાય છે.
વિધાન અને કારણ પ્રકારના પ્રશ્નો
નીચે વિધાન (A) અને પછી કારણ (R) આપેલાં છે. નીચેના જવાબોમાંથી સાચો ઉત્તર પસંદ કરો.
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે, કારણ (R) વિધાન (A)ની સાચી સમજૂતી છે.
(B) વિધાન (A) અને કારણ (R) બંને ખોટાં છે.
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે. (D) વિધાન (A) ખોટું છે પરંતુ કારણ (R) સાચું છે. (E) વિધાન (A) અને કારણ (B) બંને સાચાં છે પરંતુ કારણ (R) વિધાન (A)ની સાચી સમજૂતી નથી.
પ્રશ્ન 1.
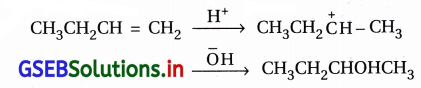
વિધાન (A): એસિડિક માધ્યમમાં બ્યુટ-1-ઇનની પાણી સાથેની યોગશીલ પ્રક્રિયા બ્યુટેન-1-ઑલ નીપજાવે છે.
કારણ (R) : ઍસિડિક માધ્યમમાં પાણીનો ઉમેરો પ્રાથમિક કાર્બોકેટાયન બનવા સાથે આગળ વધે છે.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને ખોટાં છે.
- સાચું વિધાન (A) : ઍસિડિક માધ્યમમાં બ્યુટ-1-ઇન પાણીના ઉમેરણની યોગશીલ પ્રક્રિયાથી બ્યુટેન-2-ઑલ નીપજ બનાવે છે.
- સાચું કારણ (R) : ઍસિડિક માધ્યમમાં પાણીના ઉમેરણની પ્રક્રિયા દ્વિતીયક-કાર્બોકેટાયન બનીને થાય છે.
પ્રશ્ન 2.
વિધાન (A) : ફિનોલ કરતાં p-નાઇટ્રોફિનોલ વધુ ઍસિડિક છે.
કારણ (R): નાઇટ્રો સમૂહ સસ્પંદનને કારણે ઋણવીજભારનો ફેલાવો કરીને ફિનોક્સાઇડ આયનનું સ્થાયિત્વ કરવામાં મદદરૂપ થાય છે.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે, કારણ (R) વિધાન (A)ની સાચી સમજૂતી છે.
પ્રશ્ન 3.
વિધાન (A) : 
સંયોજનનું IUPAC નામ 2-ઇથોક્સિ-2-મિથાઇલ ઇથેન છે.
કારણ (R): IUPAC નામકરણમાં, ઈથરને હાઇડ્રોકાર્બનના વ્યુત્પન્ન તરીકે ગણવામાં આવે છે કે જેમાં હાઇડ્રોજન પરમાણુ -OR અથવા -OAr દ્વારા વિસ્થાપિત થયેલો હોય છે. (જ્યાં R = આલ્કાઇલ સમૂહ અને Ar = એરાઇલ સમૂહ)
જવાબ
(D) વિધાન (A) ખોટું છે પરંતુ કારણ (R) સાચું છે.
સાચું IUPAC નામ : 1-(2-પ્રોપૉક્સિ) પ્રોપેન
પ્રશ્ન 4.
વિધાન (A): ઈથરમાં આવેલો બંધકોણ ચતુલકીય ખૂણા કરતાં થોડાક ઓછો હોય છે.
કારણ (R) : બે મોટા સમૂહ (-R) વચ્ચે અપાકર્ષણ હોય છે.
જવાબ
(D) વિધાન (A) ખોટું છે પરંતુ કારણ (B) સાચું છે.
સાચું વિધાન : ઈથરમાં બંધકોણ સમચતુલકીય કોણના કરતાં સહેજ વધારે હોય છે.

![]()
પ્રશ્ન 5.
વિધાન (A) : આલ્કોહોલ અને ઈથરનાં ઉત્કલનબિંદુ ઊંચાં હોય છે.
કારણ (R) : તેઓ આંતરઆણ્વીય હાઇડ્રોજનબંધ બનાવે છે.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને ખોટાં છે.
- સાચું વિધાન (A) : આલ્કોહૉલના ઉત્કલનબિંદુ સરખાવી શકાય તેવા આણ્વીય દળોના ઈથર કરતાં ઊંચા હોય છે.
- સાચું કારણ (R) : આલ્કોહૉલમાં આંતરઆણ્વીય હાઇડ્રોજન બંધ બને છે પણ ઈથરમાં આંતરઆણ્વીય હાઇડ્રોજન બંધ બની શકતો નથી.
પ્રશ્ન 6.
વિધાન (A) : બેઝિનનું બ્રોમિનેશનની જેમ ફિનોલનું બ્રોમિનેશન પણ લુઇસ એસિડની હાજરીમાં કરવામાં આવે છે.
કારણ (R) : લુઇસ ઍસિડ બ્રોમીન અણુને ધ્રુવીય બનાવે છે.
જવાબ
(D) વિધાન (A) ખોટું છે પરંતુ કારણ (B) સાચું છે.
સાચું વિધાન : બેન્ઝિનના બ્રોમિનેશનની જેમ ફિનોલનું બ્રોમિનેશન પણ લુઇસ ઍસિડની હાજરીમાં કરાતું નથી.
પ્રશ્ન 7.
વિધાન (A) : m- અને p-સમઘટકો કરતાં ૦-નાઇટ્રોફિનોલ પાણીમાં ઓછું દ્રાવ્ય છે.
કારણ (R) : m- અને p-નાઇટ્રોફિનોલ સંઘનિત અણુઓ તરીકે અસ્તિત્વ ધરાવે છે.
જવાબ
(E) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R) વિધાન (A)ની સાચી સમજૂતી નથી.
સાચું કારણ : ૦-નાઇટ્રોફિનોલમાં આંતઃઆણ્વીય હાઇડ્રોજન બંધન હોય છે જેથી ૦-નાઇટ્રોફિનોલ H2Oની સાથે આંતર- આણ્વીય હાઇડ્રોજન બંધ રચતો નથી પણ m અને p-નાઇટ્રોફિનોલ પાણીની સાથે હાઇડ્રોજન બંધ બનાવે છે.
પ્રશ્ન 8.
વિધાન (A) : ઇથેનોલ ફિનોલ કરતાં નિર્બળ એસિડ છે.
કારણ (R) : ઇથેનોલની જલીય NaOH સાથે પ્રક્રિયા કરી સોડિયમ ઇથોક્સાઇડ બનાવી શકાય છે.
જવાબ
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે.
સાચું કારણ (R) : ફિનૉક્સાઇડ આયનનું સસ્પંદનથી સ્થાયીકરણ થાય છે પણ ઇથૉક્સાઇડ આયન સસ્પંદનથી સ્થાયી બનતો નથી.
પ્રશ્ન 9.
વિધાન (A) : 273K તાપમાને કાર્બન ડાયસલ્ફાઇડમાં Br2 સાથેની પ્રક્રિયાથી ફિનોલ 2,4,6-ટ્રાયબ્રોમોફિનોલ બને છે.
કારણ (R) : કાર્બન ડાયસલ્ફાઇડમાં બ્રોમિન ધ્રુવીયભૂત થાય છે.
જવાબ (B) વિધાન (A) અને કારણ (R) બંને ખોટાં છે.
સાચું વિધાન : પાણીમાં બ્રોમીનની સાથે પ્રક્રિયા કરી 2,4,6- ટ્રાયબ્રોમોફિનોલ બનાવે છે.

પ્રશ્ન 10.
વિધાન (A) : ફિનોલ સાંદ્ર HNO3 અને H2SO4ના મિશ્રણ સાથે નાઇટ્રેશનથી o- અને p-નાઇટ્રોફિનોલ આપે છે.
કારણ (R) : ફિનોલમાં –OH સમૂહ 0 −, p – નિર્દેશક છે.
જવાબ
(D) વિધાન (A) ખોટું છે પરંતુ કારણ (R) સાચું છે.
સાચું વિધાન : ફિનોલ મંદ HNO3ની સાથે 298 K તાપમાને ૦- અને p-નાઇટ્રોફિનોલનું મિશ્રણ બનાવે છે.
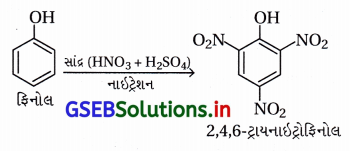
અથવા સાચું વિધાન સાંદ્ર HNO3 અને H2SO4ના મિશ્રણની સાથે નાઇટ્રેશનથી ફિનોલ 2,4,6-ટ્રાયનાઇટ્રોફિનોલ બનાવે છે.
![]()
સવિસ્તર પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
મિથોક્સિબેન્ઝિન સાથેની HIની પ્રક્રિયાની ક્રિયાવિધિ લખો.
ઉત્તર:
આ પ્રક્રિયામાં C6H5O-CH3 બંધ તૂટે છે. આ પ્રક્રિયામાં એરાઇલ-ઑક્સિજન બંધ સ્થાયી હોવાથી તૂટતો નથી.
ક્રિયાવિધિ : નીચે પ્રમાણમાં બે તબક્કામાં થાય છે :
(i) મિથોક્સિબેઝિનનું_H+ વડે પ્રોટોનીકરણ થઈને ઑક્ઝોનિયમ આયન (પ્રોટોનિત મિથોક્સિબેન્ઝિન) બને છે.
(ii) આ ઑક્ઝોનિયમ આયનમાં C6H5 – O બંધના સાપેક્ષમાં O – CH3 બંધ નિર્બળ હોય છે, કારણ કે C6H5 – Oમાં કાર્બન sp2 સંકૃત હોય છે તથા સસ્પંદનથી આંશિક દ્વિબંધ લાક્ષણિક હોય છે.
આથી કેન્દ્રાનુરાગી I–ના હુમલામાં O – CH3 બંધ તૂટે છે અને CH3I બને છે તથા ફિનોલ બને છે.
મિથોક્સિબેન્ઝિનની HI સાથેની પ્રક્રિયા, – O – CH3 બંધ તૂટીને, – કેન્દ્રાનુરાગી I– વડે, C5H3O–નું વિસ્થાપન કરી CH3I નીપજ બનાવતી SN2 (દ્વિઆણ્વીય કેન્દ્રાનુરાગી વિસ્થાપન) ક્રિયાવિધિથી થતી પ્રક્રિયા છે.
પ્રશ્ન 2.
(A) ફિનોલના ઔદ્યોગિક ઉત્પાદન માટે જરૂરી પદાર્થનું નામ લખો.
(B) ફિનોલના જલીય અને બિનજલીય માધ્યમમાં થતી બ્રોમિનેશન પ્રક્રિયા લખો.
(C) ફિનોલના બ્રોમિનેશનમાં લુઇસ ઍસિડ શા માટે જરૂરી નથી તે સમજાવો.
ઉત્તર:
(A) ફિનોલનું ઔદ્યોગિક ઉત્પાદન કરવામાં પ્રારંભિક સંયોજન ક્યુમિન (આઇસોપ્રોપાઇલબેન્ઝિન) છે.
(B)
(i) જલીય માધ્યમમાં ફિનોલનું સંપૂર્ણ બ્રોમિનેશન બ્રોમીન સાથે થઈને 2,4,6–ટ્રાયબ્રોમોફિનોલ બને છે.
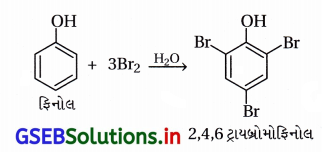
પાણીની હાજરીમાં C6H5OHમાંથી C6H5O– બને છે જે વલયને સક્રિય બનાવે છે અને ટ્રાયબ્રોમો નીપજ બને છે.
(ii) બિનજલીય દ્રાવક CS2માં 298K તાપમાને બ્રોમીન ફિનોલ સાથે પ્રક્રિયા કરીને p-બ્રોમો અને ૦-બ્રોમોફિનોલ બનાવે છે.
ફિનોલની બિનજલીય દ્રાવણમાં Br2 સાથેની પ્રક્રિયામાં -OH સમૂહ રહે છે જે O– કરતાં ઓછું સક્રિયકારક હોવાથી મોનોબ્રોમિનેશન જ થાય છે.
(C) ફિનોલના બ્રોમિનેશનમાં લુઇસ-ઍસિડની જરૂર પડતી નથી કારણ કે,
(i) ફિનોલમાં સક્રિયતાકારક -OH સમૂહની સસ્પંદન અસરના પરિણામે વલયમાં ઋણભાર આવે છે જેથી નિર્બળ ઇલેક્ટ્રૉન-અનુરાગી Br2 પણ પ્રક્રિયા કરે છે.
(ii) ફિનોલના -OH સમૂહ નજીક Br2 આવે ત્યારે પ્રેરણથી Br2 અણુ ધ્રુવીય Brδ+……. Brδ- બને છે, જેથી Brδ+ વલયમાં જોડાઈ શકે છે.
આ σ-સંકીર્ણમાંથી sp3 કાર્બનનો H, Br– વડે ખેંચાઈ HBr સ્વરૂપે દૂર થાય છે અને બ્રોમોફિનોલ બની જાય છે.
લુઇસ ઍસિડની જરૂરિયાત નથી, લુઇસ ઍસિડની ગેરહાજરીમાં પણ ફિનોલનું બ્રોમિનેશન સરળતાથી SE2 ઍરોમેટિક ક્રિયાવિધિથી થાય છે.
પ્રશ્ન 3.
ફિનોલનું એસ્પિરિનમાં રૂપાંતરણ કઈ રીતે કરી શકાય ?
ઉત્તર:
એલેક્ઝાન્ડર વિલિયમ વિલિયમસન (1824-1904)નો લંડનમાં જન્મ થયો હતો અને 1849માં લંડનની યુનિવર્સિટીમાં રસાયણવિજ્ઞાનના પ્રાધ્યાપક હતા. તેમણે સમમિતિય અને અસમિતિય ઈથર સંયોજનો બનાવવાની પદ્ધતિ શોધી હતી.
(i) પદ્ધતિ : આ પદ્ધતિમાં આલ્કાઇલ હેલાઇડ સંયોજનોની સોડિયમ આલ્બૉક્સાઇડની સાથે પ્રક્રિયા કરાય છે, જે સામાન્ય પ્રક્રિયા નીચે પ્રમાણે છે.

(ii) આ પદ્ધતિથી સમમિતિય ઈથર, અસમમિતિય ઈથર અને વિસ્થાપિત આલ્કાઇલ સમૂહો (દ્વિતીયક કે તૃતીયક) ધરાવતા ઈથર સંયોજનો બનાવી શકાય છે જે માટે યોગ્ય આલ્કૉક્સાઇડની પસંદગી કરાય છે. યોગ્ય 1°-આલ્કાઇલ હેલાઇડ ન લેતાં માત્ર આલ્કીન બને છે, ઈથર બનતો નથી.
(iii) વિલિયમસન ઈથર સંશ્લેષણ એ SN2 ક્રિયાવિધિથી થતી પ્રક્રિયા છે, જેમાં કેન્દ્રાનુરાગી આલ્કૉક્સાઇડ આયન હોય છે.
દા.ત.,
(iv) દ્વિતીયક અને તૃતીયક હેલાઇડ હોય તો વિસ્થાપનના સ્થાને વિલોપન પ્રક્રિયા થાય છે, જેનું ઉદાહરણ નીચે મુજબ છે.

અહીં આલ્કૉક્સાઇડ આયન કેન્દ્રાનુરાગી ઉપરાંત પ્રબળ બેઇઝ છે, જેથી તૃતીયક હેલાઇડની સાથે હરીફાઈથી વિલોપન પ્રક્રિયા થાય છે.
(v) ફિનોલની વિલિયમસન ઈથર પ્રક્રિયા : ફિનોલનો ફિનૉક્સાઇડ (C6H5O–) કેન્દ્રાનુરાગી તરીકે વર્તી આલ્કાઇલ હેલાઇડ સાથે ઈથર બનાવે છે.
જો, R = -CH3 તો એનિસોલ (C6H5OCH3)
R = -CH2CH3 તો ફેનિટોલ (C6H5OCH2CH3)
R = -C6H6 તો ડાયફિનાઇલ ઈથર (C6H5 – O – C6H5) બને છે.
![]()
પ્રશ્ન 4.
તમારાથી પરિચિત એવા સંયોજનની ઔદ્યોગિક બનાવટ કે જેમાં જૈવિક ઉદ્દીપક જરૂરી છે તે પ્રક્રિયા સમજાવો.
ઉત્તર:
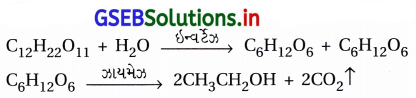
- જૈવિક ઉદ્દીપકો તે ઉત્સેચકો છે. મોલાસીસ, શેરડી અથવા દ્રાક્ષ જેવા ફળોની શર્કરા (સુક્રોઝ)નું આથવણ કરીને ઇથેનોલનું ઉત્પાદન કરાય છે.
- જૈવિક ઉદ્દીપક તરીકે ઉત્સેચક ઇન્વર્ટેઝ વડે આ શર્કરાનું આથવણ કરવાથી ગ્લુકોઝ અને ફ્રુક્ટોઝનું મિશ્રણ બને છે.

- બનેલા C6H12O6 (ગ્લુકોઝ + ફ્રુક્ટોઝ)નું આથવણ ઝાયમેઝ ઉત્સેચક વડે કરવાથી ઇથેનોલ બને છે. ઉત્સેચક ઝાયમેઝ યીસ્ટમાંથી બને છે.

- આમાં જૈવિક ઉદ્દીપકો ઇન્વર્ટેઝ અને ઝાયમેઝ કાર્બનિક અણુનું વિખંડન કરી મોટા અણુઓનું નાના અણુઓમાં રૂપાંતરણ કરે છે. આ દરમિયાન થતી મુખ્ય પ્રક્રિયાઓ ઉપર પ્રમાણે છે. – આથવણની ક્રિયા અજારક પરિસ્થિતિમાં એટલે કે હવાની ગેરહાજરીમાં થાય છે.
- જો આથવણ મિશ્રણમાં હવા મળે તો હવાના ઑક્સિજન વડે ઇથેનોલનું ઑક્સિડેશન થઈને ઇથેનોલ બને છે.