Gujarat Board GSEB Textbook Solutions Class 12 Chemistry Chapter 3 વિદ્યુત-રસાયણવિજ્ઞાન Textbook Questions and Answers.
Gujarat Board Textbook Solutions Class 12 Chemistry Chapter 3 વિદ્યુત-રસાયણવિજ્ઞાન
GSEB Class 12 Chemistry વિદ્યુત-રસાયણવિજ્ઞાન Text Book Questions and Answers
પ્રશ્ન 1.
નીચેની ધાતુઓને તેમના ક્ષારના દ્રાવણોમાંથી એકબીજાને વિસ્થાપિત કરતા ક્રમમાં ગોઠવો :
Al, Cu, Fe, Mg v Zn
ઉત્તર:
- Mg, Al, Zn Fe, Cu અને Ag
ઉદા., Mg(s) + Cu2+(aq) → Mg2+(aq) + Cu(s)
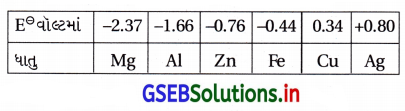
- E⊖ નું મૂલ્ય ક્રમશઃ વધે છે.
સમજૂતી : જેના E⊖નું મૂલ્ય ઓછું હોય તે તેના કરતાં વધારે E⊖ ધરાવતી ધાતુના આયનનું રિડક્શન કરી ધાતુ બનાવે છે. Mg વડે દ્રાવણમાંના Cu2+ નું વિસ્થાપન થઈ દ્રાવણમાં Mg2+ બને છે. Mg(s) ઓગળી Cu(s) બને છે.
પ્રશ્ન 2.
પ્રમાણિત વિધુત પોટેન્શિયલ (વિભવ) આપેલ છે :
K+ | K = −2.93 V,
Ag+ | Ag = 0.80 V, Hg2+ | Hg = 0.79 V,
Mg2+ | Mg = -2.37 V, Cr3+ | Cr = -0.74 V
આ ધાતુઓને તેમની રિડક્શનકર્તા તરીકેની પ્રબળતા (સામર્થ્ય)ના ચઢતા ક્રમમાં ગોઠવો.
ઉત્તર:
- Ag < Hg < Cr < Mg < K
→ ધાતુની રિડક્શનકર્તા તરીકેની ક્ષમતા વધે →

- જે ધાતુનો પ્રમાણિત રિડક્શન પોર્ટેન્શિયલ ઓછો હોય તે ધાતુ પ્રબળ રિડક્શનકર્તા હોય છે.
પ્રશ્ન 3.
જે ગેલ્વનિક કોષમાં પ્રક્રિયા
Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s)થતી હોય તેની આકૃતિ દોરો અને દર્શાવો કે,
(i) કયો વિધુતધ્રુવ ઋણભારિત છે ?
(ii) કોષમાં પ્રવાહનું વહન કરતાં વાહકો.
(iii) દરેક વિધુતધ્રુવ પર તૈયક્તિક (વ્યક્તિગત) પ્રક્રિયા.
ઉત્તર:
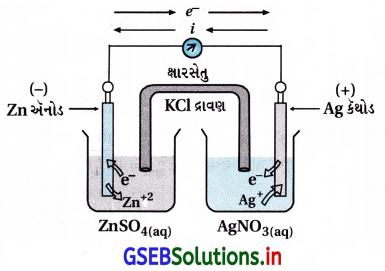
- (i) Zn ધ્રુવ ઋણભારિત છે.
(ii) કોષમાં વિદ્યુતપ્રવાહનું આંતરિક પથમાં Zn(s) → Zn2+ ના દ્રાવણમાંથી ક્ષારસેતુમાંથી Ag(s)માં થઈ વીજતારમાં થઈ બાહ્ય પથમાં Zn(s) તરફ હોય છે. બાહ્ય પથમાં ઇલેક્ટ્રૉન અને આંતરિક પથમાં આયનોના વહનથી વિરુદ્ધ પ્રવાહ વહે છે.
(iii) અનોડ ધ્રુવ (Zn) ઉપર નીચેની ઑક્સિડેશન પ્રક્રિયા થાય છે અને Zn દ્રાવણમાં ઓગળી Zn2+ બને છે.
Zn(s) → Z2+(aq) + 2e– …(ઑક્સિડેશન) - Ag કૅથોડ (+ve) ધ્રુવ ઉપ૨ દ્રાવણમાંનો Ag+ આયનો ઇલેક્ટ્રૉન મેળવી રિડક્શન પામે છે અને Ag ધાતુના કણો Ag ના ધ્રુવની ઉપર જમા થાય છે (નિક્ષેપન પામે છે).
Ag+(aq) + e– → Ag(s) …….. (રિડક્શન)
પ્રશ્ન 4.
ગેલ્વેનિક કોષોમાં નીચેની પ્રક્રિયાઓ થતી હોય તેના પ્રમાણિત કોષ પોટેન્શિયલ ગણો :
(i) 2Cr(s) + 3Cd+(aq) → 2Cr3+(aq) + 3Cd
(ii) Fe2+(aq) + Ag+(aq) → Fe3+(aq) + Ag(s)
પ્રક્રિયાનો ΔrG⊖ અને સંતુલન અચળાંક ગણો.
ઉત્તર:

જેથી ઑક્સિડેશન અર્ધપ્રક્રિયા : Cr(s) → Cr3+(aq) + 3e–
∴ આ અર્ધકોષ ગૅલ્વેનિક કોષમાં ડાબી તરફ હોય.

રિડક્શન અર્ધપ્રક્રિયા : Cd2+ + 2e– → Cd(s)
∴ રિડક્શન થતું હોવાથી આ અર્ધકોષ ગૅલ્વેનિક કોષમાં જમણી તરફ હોય.
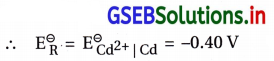
∴ પ્રમાણિત કોષ પોટૅન્શિયલ \(\Delta \mathrm{E}_{\text {cell }}^{\ominus}=\left(\mathrm{E}_{\mathrm{R}}^{\ominus}-\mathrm{E}_{\mathrm{L}}^{\ominus}\right)\)
= [-0.40 – (-0.74)] V
= [-0.40 + 0.74] V
= 0.34 V
– ગિબ્સની મુક્તઊર્જાની ગણતરી :
જ્યાં,ΔrG⊖ = કોષની ગિબ્સની મુક્તઊર્જા, n = 6 મોલ
F = 96500 કુલંબ મોલ-1, \(\mathrm{E}_{\text {cell }}^{\ominus}\) = 0.34V
ΔrG⊖ = -nF\(\mathrm{E}_{\text {cell }}^0\)
∴ ΔrG⊖ = -(6 mol) × (96500 C mol-1) × (0.34V)
= -196860 C V
= -196860 J
=-196.860 kJ
– સંતુલન અચળાંક KC ની ગણતરી :
ΔrG⊖ = -2.303 RT log KC
∴ log KC = \(\frac{-196860}{2.303 \times 8.314 \times 298}\) = 34.5014
∴ KC = Antilog 34.5014 3.174 × 1034
(ii) Fe2+(aq) + Ag+(aq) → Fe3+(aq) + Ag(s) કોષ પોટેન્શિયલની ગણતરી :
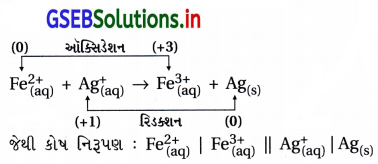
ઑક્સિડેશન અર્ધપ્રક્રિયા : Fe2+(aq) → Fe3+(aq) + e–
∴ આ અર્ધકોષ ગૅલ્વેનિક કોષમાં ડાબી તરફ હોય.

રિડક્શન અર્ધપ્રક્રિયા : Ag2+(aq) + e– → Ag(s)
∴ રિડક્શન થતું હોવાથી આ અર્ધકોષ ગૅલ્વેનિક કોષમાં જમણી તરફ હોય.
∴ \(\mathrm{E}_{\mathrm{R}}^{\ominus}=\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}\) = 0.80 V
∴ પ્રમાણિત કોષ પોટૅન્શિયલ \(\Delta \mathrm{E}_{\text {cell }}^{\ominus}=\left(\mathrm{E}_{\mathrm{R}}^{\ominus}-\mathrm{E}_{\mathrm{L}}^{\ominus}\right)\)
= 0.80 – 0.77 V
= 0.03 V
ગિબ્સની મુક્તઊર્જાની ગણતરી :
જ્યાં,ΔrG⊖ = કોષની ગિબ્સની મુક્તઊર્જા, n = 1 મોલ
F = 96500 કુલંબ મોલ-1, \(\mathrm{E}_{\text {cell }}^{\ominus}=\Delta_{\mathrm{r}} \mathrm{E}_{\text {cell }}^{\ominus}\) = 0.03V
ΔrG⊖ = -nF\(\mathrm{E}_{\text {cell }}^O\)
∴ ΔrG⊖ = -(1 mol) × (96500 C mol-1) × (0.03V)
= -2895 C V
= -2895 J
= -2.895 kJ
સંતુલન અચળાંક (KC)ની ગણતરી :
ΔrG⊖ = -2.303 RT log KC
∴ -2895 J = -(2.303) × (8.314 J) × (298 K) log KC
∴ log KCc = –\(\frac{-2895}{2.303 \times 8.314 \times 298}\) = 0.5074
∴ KC = Antilog 0.5074 = 3.216 ≈ 3.22
![]()
પ્રશ્ન 5.
નીચેના કોષના 298K તાપમાને નર્સ્ટ સમીકરણ અને ઇ.એમ.એફ. લખો :
(i) Mg(s) | Mg2+ (0.001 M) || Cu2+ (0.0001 M) | Cu(s)
(ii) Fe(s) | Fe2+ (0.001 M) || H+ (1 M) | H2(g) (1 bar) | Pt(s)
(iii) Sn(s) | Sn2+ (0.050 M) || H+ (0.020 M) | H2(g) (1 bar) | Pt(s)
(iv) Pt(s) | Br– (0.010 M) | Br2(l) || H+ (0.030 M) | H2(g) (1 bar) | Pt(s)
ઉત્તર:

(i) Mg(s) | Mg2+ (0.001 M) || Cu2+ (0.0001 M) | Cu(s)
પ્રમાણિત કોષ પોટૅન્શિયલ \(\mathrm{E}_{\text {cell }}^{\ominus}\) ની ગણતરી :

આ કોષ પ્રક્રિયામાં પ્રમાણિત સાંદ્રતા નથી અને તેનું નર્સ્ટ સમીકરણ નીચે પ્રમાણે થાય છે.


= 0.34 – (-2.37 V)
= 2.71 V
[Mg2+] = 0.001 M [Cu2+] = 0.0001 M
∴ Ecell = 2.71 V + (\(\frac{0.0591}{2}\)) × log (\(\frac{0.0001 \mathrm{M}}{0.001 \mathrm{M}}\))
= 2.71 + (\(\frac{0.0591}{2}\))(log 0.1)
= 2.71 0.02955 × (-1.0)
= 2.71 0.02955
= 2.68045 V ≈ 2.68 V
(ii) Fe(s) | Fe2+ (0.001 M) || H+ (1 M) | H2(g) (1 bar) | Pt(s)
પ્રમાણિત કોષ પોર્ટેન્શિયલ \(\mathrm{E}_{\text {cell }}^{\ominus}\) ની ગણતરી :
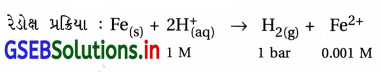
ઍનોડ અર્ધકોષ (Fe | Fe2+) નો હોવાથી ડાબી તરફના કોષની
અર્ધપ્રક્રિયા : Fе(s) → Fe2+(aq)

જમણી તરફ કૅથોડ (+ve) અર્ધકોષ હોવાથી તેમાં રિડક્શન પ્રક્રિયા : 2H+(aq) + 2e – → H2(g)

= [0.0 – (-0.44)] V
= 0.44 V
– ન સમીકરણ અને કોષ પોટૅન્શિયલ Ecell ની ગણતરી :
Ecell = \(\mathrm{E}_{\text {cell }}^{\ominus}\) + \(\frac{0.0591}{n}\) log \(\frac{\left[\mathrm{H}^{+}\right]^2}{\left[\mathrm{Fe}^{2+}\right] \times\left(p_{\mathrm{H}_2}\right)}\)
જ્યાં, n = 2
= 0.44 + \(\frac{0.0591}{n}\) log \(\frac{(1)^2}{(0.001)}\)
= 0.44 +0.02955 log (103)
= 0.44+ (0.02955) (3) = 0.44 + 0.08865
= 0.52865 V
= 0.529 V
(iii) Sn(s) | Sn2+ (0.050 M) || H+ (0.020 M) | H2(g) (1 bar) | Pt(s)
પ્રમાણિત કોષ પોટૅન્શિયલ \(\mathrm{E}_{\text {cell }}^{\ominus}\) ની ગણતરી :

ડાબી તરફના ઍનોડ અર્ધકોષમાં Snના ઍનોડની ઉ૫૨ ઑક્સિડેશન પ્રક્રિયા : Sn(s) → Sn2+(aq) + 2e–
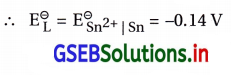
જમણી તરફના રિડક્શન અર્ધકોષમાં Ptના કૅથોડની ઉપર નીચે પ્રમાણેની રિડક્શન પ્રક્રિયા : 2Н+(aq) + 2e – → H(2g)

= 0.0 – (-0.14)
= +0.14 V
નર્સ્ટ સૂત્ર અને કોષ પોર્ટેન્શિયલ Ecell ની ગણતરી :

= 0.14 – 0.062
= 0.078 V
(iv) Pt(s) | Br– (0.010 M) | Br2(l) || H+ (0.030 M) | H2(g) (1 bar) | Pt(s)

= -1.08 + (-0.2082)
= -1.2882 V
નોંધ : ઋણ મૂલ્ય હોવાથી આ સાચો ગૅલ્વેનિક કોષ નથી.
: વધારાની સમજૂતી :

ડાબી તરફ : ઍનોડ હોય અને તેમાં ઑક્સિડેશન થતું હોય તે માટે 2Br– → Br2 + 2e– તરીકે પ્રક્રિયા લખી છે.
જમણી તરફ : 2H+ + 2e– → H2 તે રિડક્શન છે અને કૅથોડની યોગ્ય પ્રક્રિયા છે. જેથી સાચી પ્રક્રિયા નીચે મુજબ છે.

નોંધ : આ કોષનો emf ધન મેળવવા નીચે પ્રમાણે નિરૂપણ કરવું જોઈએ.

પ્રશ્ન 6.
બટન સેલ જે બહોળા પ્રમાણમાં કાંડા ઘડિયાળ અને અન્ય ઉપકરણોમાં વપરાય છે, તેમાં નીચેની પ્રક્રિયા થાય છે.
Zn(s) + Ag2O(s) + H2O(l) → Zn2+(aq) + 2Ag(s) + 2OH–(aq)
પ્રક્રિયા માટે ΔrG⊖ E⊖ ગણો.
ઉત્તર:
(a) પ્રમાણિત પોર્ટેન્શિયલ \(\mathrm{E}_{\text {cell }}^{\ominus}\) ની ગણતરી : બટન સેલમાં નીચે પ્રમાણેની પ્રક્રિયા થાય છે.
Zn(s) + Ag2O(s) + H2O(l) → Zn2+(aq) + 2Ag(s) + 2OH–(aq)
ઑક્સિડેશન : Zn(s) → Zn2+(aq) + 2e–

= 0.344 – (-0.76)
= +1.104 V
(b) પ્રક્રિયા ΔrG⊖ ની ગણતરી :
ΔrG⊖ – nF\(\mathrm{E}_{\text {cell }}^{\ominus}\)
જ્યાં n = 2 mol
\(\mathrm{E}_{\text {cell }}^{\ominus}\) = 1.104 V
F = 96500 C mol-1
∴ ΔrG⊖ = -(2 mol) × (96500 C mol-1) × (1.104V)
= -213072 C V
= -213072 J
= −2.13 × 105J
= -213.072 kJ ≈ -213 k J
પ્રશ્ન 7.
વિદ્યુતવિભાજ્યના દ્રાવણ માટે વાહકતા અને મોલર વાહકતા વ્યાખ્યાયિત કરો. તેમની સાંદ્રતાના ફેરફાર સાથેના ફેરફારની ચર્ચા કરો.
ઉત્તર:
- વિદ્યુતવિભાજ્યના દ્રાવણની સાંદ્રતા બદલાય તો, તે દ્રાવણની વાહકતા (k) તેમજ મોલર વાહકતા (∧m) બંને બદલાય છે.
- નિર્બળ તેમજ પ્રબળ વિદ્યુતવિભાજ્યનાં દ્રાવણોની સાંદ્રતા ઘટે તો હંમેશાં વાહકતામાં ઘટાડો થાય છે.
કારણકે, જો વિદ્યુતવિભાજ્યના દ્રાવણનું મંદન કરાય તો તે મંદ દ્રાવણના એકમ કદમાં આયનોની સંખ્યા ઘટે છે અને આયનનો પ્રવાહને લઈ જતા હોય છે. દ્રાવણમાં વિદ્યુતપ્રવાહનું વહન આયનોની ગતિથી થાય છે. - દ્રાવણની વાહકતા : આપેલી કોઈપણ સાંદ્રતાઓ દ્રાવણની વાહકતા તે 1 એકમ વિસ્તારના આડછેદના અને એક એકમ લંબાઈના અંતરે રાખેલા Pt બે વિદ્યુતધ્રુવોની વચ્ચેના એકમ કદના દ્રાવણની વાહકતા છે.
- જો દ્રાવણની વાહકતા = G
વાહકના આડછેદનું ક્ષેત્રફળ = A
બે Pt ધ્રુવો વચ્ચેનું અંતર = l તો,
G = k(\(\frac{\mathrm{A}}{l}\)) પણ જો A = 1 અને l = 1 તો,
G = k(\(\frac{1}{1}\)) ∴ G = k = દ્રાવણની વાહકતા - દ્રાવણની મોલર વાહકતા (∧m) અને દ્રાવણનું કદ : આપેલી સાંદ્રતાએ બે Pt વિદ્યુતધ્રુવો જેમના આડછેદ A અને l એકમ કદની લંબાઈના Pt ધ્રુવની વચ્ચે રાખેલા દ્રાવણના કદ V કે જે 1 મોલ વિદ્યુતવિભાજ્ય ધરાવે છે, તેની વાહકતા (∧m) છે.
∧m = \(\frac{k \mathrm{~A}}{l}\)
જો A = 1 તથા l = 1 તો, ∧m = k
જો l = 1, A = V = 1 મોલ વિદ્યુતવિભાજ્ય ધરાવતું દ્રાવણ તો ∧m = kV
આમ, એકમ આડછેદ (A) અને એકમ લંબાઈ 1 ના અંતરે સમાંતર રહેલા બે Pt ધ્રુવોની વચ્ચે ભરેલા 1 મોલ વિદ્યુત- વિભાજ્યના V કદના દ્રાવણની વાહકતાને ભરેલા (રાખેલા) દ્રાવણની મોલ વાહકતા કહે છે. - દ્રાવણની મોલર વાહકતામાં સાંદ્રતાના ફેરફારની અસર : જો આ દ્રાવણની સાંદ્રતામાં ઘટાડો કરવામાં આવે તો, 1 મોલ વિદ્યુતવિભાજ્ય ધરાવતા દ્રાવણનું કુલ કદ (V) વધે છે અને દ્રાવણની મોલર વાહકતા વધે છે તથા દ્રાવણનું કદ વધારતાં સાંદ્રતા ઘટે છે.

- દ્રાવણની સાંદ્રતાનો ઘટાડો એટલે દ્રાવણને મંદ બનાવવું દ્રાવણના મંદનના કારણે વાહકતા માં થતો ઘટાડો તેના કદ (V) માં થયેલા વધારાને સરભર કરતાં વધારે હોય છે.
- આપેલી સાંદ્રતાએ ∧m એ વિદ્યુતવિભાજ્યના બે દ્રાવણની વાહકતા છે જેને વાહકતા કોષના બે Pt ધ્રુવોની વચ્ચે એકમ અંતરે રાખેલા છે પણ એટલો મોટો આડછેદ ધરાવે છે કે જે દ્રાવણના પૂરતા કદને સમાવી શકે, જે દ્રાવણ 1 મોલ વિદ્યુત- વિભાજ્ય ધરાવે છે.
- સીમિત મોલર વાહકતા : જ્યારે દ્રાવણની સાંદ્રતા શૂન્ય તરફ જાય છે ત્યારે મોલર વાહકતાને સીમિત વાહકતા કહે છે. સીમિત વાહકતાની સંજ્ઞા \(\Lambda_{\mathrm{m}}^0\) છે.
ચલની સાંદ્રતાના ફેરફાર પ્રબળ અને નિર્બળ વિદ્યુતવિભાજ્યના દ્રાવણોના માટે એક સમાન નહીં પણ ભિન્ન હોય છે.
પ્રશ્ન 8.
0.20 M KCl ના દ્રાવણની વાહકતા 298K તાપમાને 0.0248 S cm-1 છે. તેની મોલર વાહકતા ગણો.
ઉત્તર:
આણ્વીય વાહકતા / મોલર વાહકતા ∧m :
મોલ૨ વાહકતા (∧m) = \(\frac{k \times 1000}{c}\)
જ્યાં, વાહકતા k = 0.0248 S cm-1
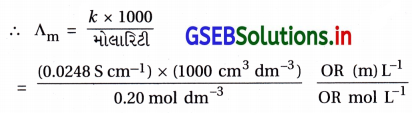
= 124.0 S cm2 mol-1
![]()
પ્રશ્ન 9.
0.001 M KCl દ્રાવણ ધરાવતા વાહકતા કોષનો અવરોધ 298 K તાપમાને 1500 Ω છે. જો 0.001 M KCl દ્રાવણની 298 K તાપમાને વાહકતા 0.146 × 10-3 S cm-1 હોય, તો કોષ અચળાંક કેટલો હશે ?
ઉત્તર:

= \(\frac{k}{c}\) = k × R (∵ \(\frac{1}{c}\) = R)
જ્યાં k = 10-3 S cm-1
અવરોધ = 1500 Ω
∴ કોષ અચળાંક = (0.146 × 10-3 S cm-1) × (1500 Ω)
= 0.219 S cm-1 Ω
= 0.219 cm-1 (∵ S = Ω-1)
પ્રશ્ન 10.
સોડિયમ ક્લોરાઇડની વાહકતા જુદી જુદી સાંદ્રતાએ 298K તાપમાને માપવામાં આવી હતી અને પરિણામો નીચે પ્રમાણે નોંધવામાં આવ્યા છે :

બધી જ સાંદ્રતાઓ માટે ∧m ગણો અને ∧m વિરુદ્ધ \(c^{\frac{1}{2}}\) નો આલેખ દોરો. \(\Lambda_{\mathrm{m}}^{\mathrm{O}}\) નું મૂલ્ય શોધો.
ઉત્તર:
- અહીં, આપેલી સાંદ્રતા અને વાહકતા તથા ગણેલા \(c^{\frac{1}{2}}\) અને ∧m ના મૂલ્યો નીચેના કોષ્ટકમાં આપ્યા છે.
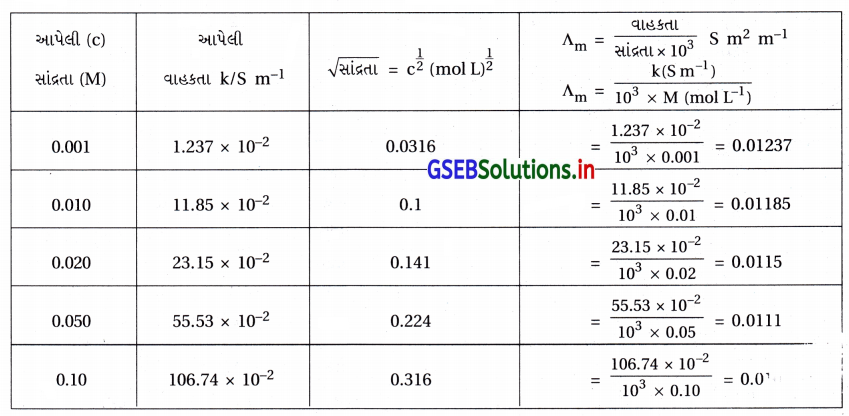
- ઉપરના કોઠાની ગણતરીમાંથી \(c^{\frac{1}{2}}\) ને X ધરી ઉપર અને તેને આનુષંગિક ∧m ના મૂલ્યો Y ધરી મૂકીને ગ્રાફ દોરવાનો છે. આ આલેખ નીચે આકૃતિમાં આપ્યો છે. ∧m અને \(c^{\frac{1}{2}}\) નો આલેખ નીચે પ્રમાણે છે.
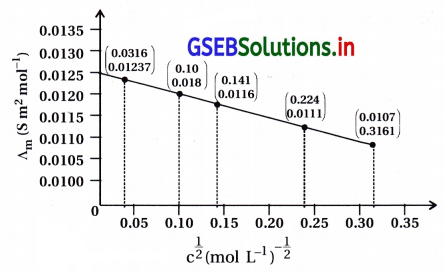
- આ આલેખ ઋણ ઢાળ ધરાવતી સીધી રેખા છે.
\(\Lambda_{\mathrm{m}}^0\) S m2 mol-1નું મૂલ્ય : \(c^{\frac{1}{2}}\) 0 તે \(\Lambda_{\mathrm{m}}^0\) નું મૂલ્ય થાય. - આ મૂલ્ય આલેખને લંબાવતાં 0.0125 S m2 mol-1 છે.
પ્રશ્ન 11.
0.00241 M એસિટિક ઍસિડની વાહકતા 7.896 × 10-5 S cm-1 છે. તેની મોલર વાહકતા ગણો. જો એસિટિક એસિડ માટે \(\Lambda_{\mathrm{m}}^O\) નું મૂલ્ય 390.5 S cm2 mol-1 હોય, તો તેનો વિયોજન અચળાંક ગણો.
ઉત્તર:
- મોલર વાહકતા \(\Lambda_{\mathrm{m}}^c\) ની ગણતરી :
જ્યાં M = 0.00241 CH3COOH,
k = 7.896 × 10-5 S cm-1

= 32.763 S cm2 mol-1
- CH3COOH ના વિયોજન અંશ (α)ની ગણતરી :
∴ α = \(\frac{\Lambda_{\mathrm{m}}^{\mathrm{c}}}{\Lambda_{\mathrm{m}}^{\mathrm{o}}}\)
જ્યાં, α = વિયો અંશ
\(\Lambda_{\mathrm{m}}^{\mathrm{c}}\) = 32.763 S cm2 mol-1
\(\Lambda_{\mathrm{m}}^{\mathrm{O}}\) = 390.5 S cm2 mol-1
α = \(\frac{32.763}{390.5}\)
= 0.0839 - વિયોજન અચળાંકની (Ka) ગણતરી : એસેટિક આસડ (CH3COOH)ના દ્રાવણમાં નીચે પ્રમાણેનું સંતુલન હોય છે.

પ્રશ્ન 12.
નીચેનાનાં રિડક્શન માટે કેટલો વિધુતભાર (charge) જોઇએ ?
(i) 1 mol Al3+ માંથી Al
(ii) 1 mol Cu2+ માંથી Cu
(iii) 1 mol \(\mathrm{MnO}_4^{-}\) માંથી Mn2+
ઉત્તર:
(i) 1 mol Al3+ નું Alમાં રિડક્શન કરવા જરૂરી વિદ્યુતભારની ગણતરી :
Alના ધ્રુવ ઉપરનું રિડક્શન : 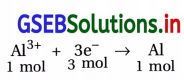
આ પ્રક્રિયા પ્રમાણે 1 mol Al3+ નું Alમાં રિડક્શન કરવા માટે 3 mol ઇલેક્ટ્રૉન જરૂરી છે.
∴ 1 mol ઇલેક્ટ્રૉનનો વીજભાર 1F = 96500 કુલંબ
∴ 3 mol ઇલેક્ટ્રૉનનો વીજભાર 3F = 3(96500)
= 289500 કુલંબ
(ii) 1 mol Cu2+ નું Cuમાં રિડક્શન કરવા જરૂરી વિદ્યુતભાર :
કૉપરના ધ્રુવની ઉપર રિડક્શન : 
આ અનુસાર 1 mol Cu2+ નું રિડક્શન ક૨વામાં 2 mol ઇલેક્ટ્રૉન વપરાય છે, અને
∴ 2 mol ઇલેક્ટ્રૉન = 2 ફેરાડે વિદ્યુતભારની જરૂર પડે.
= 2 × 96500 કુલંબ વિદ્યુતભાર
= 193000 કુલંબ વિદ્યુતભાર
(iii) 1 mol \(\mathrm{MnO}_4^{-}\) માંથી Mn2+ માં રિડક્શન કરવા જરૂરી વિદ્યુતભાર :
1 mol \(\mathrm{MnO}_4^{-}\) માંથી Mn2+ માં રિડક્શન થાય ત્યારે ધ્રુવની ઉપર નીચેની પ્રક્રિયા થાય.

આ પ્રક્રિયા પ્રમાણે 1 mol \(\mathrm{MnO}_4^{-}\) નું રિડક્શન કરવા માટે 5 mol ઇલેક્ટ્રૉનની જરૂર પડે છે, અને
∴ 5 mol ઇલેક્ટ્રૉનનો વિદ્યુતભાર = 5 ફેરાડે
(5 × 96500) = 193000 કુલંબ
∴ 5 ફેરાડે = 193000 કુલંબ વીજભારની જરૂર પડે.
![]()
પ્રશ્ન 13.
નીચેના ઉત્પાદન માટે ફેરાડેના પર્યાયમાં કેટલી વિધુતની જરૂર પડશે ?
(i) પિગલિત CaCl2 માંથી 20.0 g Ca
(ii) પિગલિત Al2O3 માંથી 40.0 g Al
ઉત્તર:
(i) પીગાળેલા CaCl2 માંથી 20.0g કૅલ્શિયમ (Ca) મેળવવા જરૂરી વિદ્યુત ફેરાડેમાં ગણવી : (Ca = 40)
આયનીકરણ પ્રક્રિયા : CaCl2 → Ca2+ + 2Cl–
કૅથોડ ઉપર રિડક્શન પ્રક્રિયા : Ca2+ + 2e– → Ca
∴ 2 mol e– થી → 1 mol Ca
∴ 2F → 40g Ca
∴ 20 g Ca મેળવવા જરૂરી ફેરાડે = \(\frac{20 \mathrm{~g} \times 2 \mathrm{~F}}{40 \mathrm{~g}}\) = 1F
(ii) પીગાળેલા Al2O3 માં 40.0 g Al મેળવવા માટે જરૂરી વિદ્યુત ફેરાડેમાં ગણવી. (Al = 27.0)
પીગાળેલ Al2O3ના વિદ્યુતવિભાજનનાં કૅથોડની ઉપર નીચે પ્રમાણે પ્રક્રિયા થાય છે.
Al2O3(l) → 2Al3+ + 3O2-
અને રિડક્શન Al3+ + 3e– → Al
જેથી 3 મોલ e– વડે 1 મોલ Al મળે.
∴ 3F વિદ્યુતથી 27.0 ગ્રામ Al મળે.
જેથી 40.0 g Al મેળવવા માટે જરૂરી વિદ્યુત
= \(\frac{3 \mathrm{~F} \times 40.0 \mathrm{~g}}{27.0 \mathrm{~g}}\) = 4.444 F
પ્રશ્ન 14.
નીચેના ઉત્પાદન માટે ઑક્સિડેશન પર્યાયમાં કેટલી વિધુતની જરૂર પડશે ?
(i) 1 mol H2O માંથી O2
(ii) 1 mol FeO માંથી Fe2O3
ઉત્તર:
(i) 1 મોલ H2O ના ઑક્સિડેશનથી O2 ના ઉત્પાદન માટે જરૂરી વિદ્યુતની ગણતરી : નીચેની પ્રક્રિયા પ્રમાણે H2O ના 1 મોલનું
ઑક્સિડેશન થઈને \(\frac{1}{2}\) મોલ O2 બને છે.
H2O(l) → \(\frac{1}{2}\)O2(g) + 2H+ + 2e–
1 મોલ H2O → \(\frac{1}{2}\) મોલ O2 બને તેમાં 2 મોલ 2e– વપરાય.
∴ 1 મોલ H2Oમાંથી O2ના ઉત્પાદનમાં 2F વિદ્યુતની જરૂર પડે.
આમ, 2F = 2 × 96500 = 193000 કુલંબ વિદ્યુત
(ii) 1 મોલ FeO માંથી Fe2O3 ઑક્સિડેશનથી મેળવવા જરૂરી વિદ્યુતની ગણતરી : 1 મોલ FeO નું ઑક્સિડેશન નીચેની પ્રક્રિયા પ્રમાણે થઈને Fe2O3 બને છે.
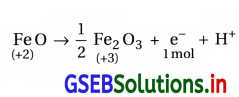
જેથી 1 મોલ FeO નું ઑક્સિડેશન \(\frac{1}{2}\) મોલ Fe2O3 રચે અને
તેમાં 1 મોલ ઇલેક્ટ્રૉન = 1F = 96500 કુલંબ વિદ્યુત વપરાય.
પ્રશ્ન 15.
5 એમ્પિયર પ્રવાહનો 20 મિનિટ માટે ઉપયોગ કરી Ni(N03)2 ના દ્રાવણનું પ્લેટિનમ વિધુતધ્રુવો વચ્ચે વિદ્યુતવિભાજન કરવામાં આવ્યું. કેથોડ ઉપર Ni નું કેટલું દળ નિક્ષેપિત (deposited) થશે ? [Ni = 58.7 u]
ઉત્તર:
- પસાર કરેલો વિદ્યુતજથ્થો (Q) = 5A × 20 × 60s
= 6000 C - નીચેની પ્રક્રિયા થઈ Ni બને છે.
આયનીકરણ : Ni(NO3)2(aq) → Ni2+2(aq) + 2NO–3(aq)
કૅથોડ ઉપર રિડક્શન :
- આ પ્રક્રિયા પ્રમાણે 2 મોલ e– = 2F વિદ્યુતથી 1 મોલ Ni
= 58.7 g Ni
જેથી 2 × 96500 કુલંબ વિદ્યુતથી 58.79 ગ્રામ Ni બને અને તેથી 6000 કુલંબ વિદ્યુતથી મળતા Ni નું દળ
= \(\frac{6000 \times 58.79}{2 \times 96500}\)
= 1.8277 g Ni
પ્રશ્ન 16.
ત્રણ વિદ્યુતવિભાજન કોષ A, B, C જે અનુક્રમે ZnSO4, AgNO3 અને CuSO4 ના દ્રાવણ ધરાવે છે. તેમને શ્રેણીમાં જોડેલ છે. કોષ B માં 1.45 g સિલ્વર કેથોડ પર જમા થયું ત્યાં સુધી 1.5 એમ્પિયર સ્થિર પ્રવાહ પસાર કરવામાં આવ્યો. કેટલા સમય માટે પ્રવાહનું વહન થયું હશે ? કોપર અને ઝિંકના કેટલા દળ નિક્ષેપિત થયા હશે ?
ઉત્તર:
- ZnSO4, AgNO3 અને CuSO4 ના વિદ્યુતવિભાજનની પ્રક્રિયાઓ :
(B) AgNO3 → Ag+ + NO–3 (આયનીકરણ)
અને Ag+ + e– → Ag (રિડક્શન)
(A) ZnSO4 → Zn2+ + SO2-4 (આયનીકરણ)
અને Zn2+ + 2e– → Zn (રિડક્શન)
(C) CuSO4 → Cu2+ + SO2-4 (આયનીકરણ)
અને Cu2+ + 2e– → Cu (રિડક્શન)
∴ 1F = 96500 કુલંબથી 1 મોલ Ag, \(\frac{1}{2}\)Zn અને \(\frac{1}{2}\) મોલ Cu નિક્ષેપન પામે. - Ag નાં મોલની ગણતરી :
1.45 g Ag = \(\frac{1.45 \mathrm{~g}}{108 \mathrm{~g} \mathrm{~mol}^{-1}}=\frac{1.45}{108}\) mol Ag બને છે. - વપરાતી વિદ્યુત કુલંબની ગણતરી : સિલ્વરના ઇલેક્ટ્રૉડ ઉપર નીચેની રિડક્શન પ્રક્રિયા થાય અને સિલ્વરના 1.45/108 મોલ છૂટા પડે.
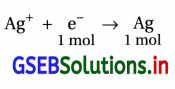
∴ 1 F = 96500 કુલંબ વિદ્યુતથી 1 મોલ Ag જમા થાય.
પણ 1.45/108 મોલ Ag જમા થાય ત્યારે વપરાતી વિદ્યુત (Q)
તો Q = \(\frac{1.45}{108} \times \frac{96500}{1}=\frac{1.45 \times 96500}{108}\) કુલંબ
= 1295.6 C
- વિદ્યુત પસાર કરવાના સમયની ગણતરી :
કુલંબ Q it માટે t = \(\frac{Q}{i}\)
જ્યાં, i = 1.5 એમ્પીયર
t = (?) સેકન્ડ
∴ t = \(\frac{1.45 \times 96500}{108 \times 1.5}\)
= 893.7 sec = \(\frac{863.7}{60}\) = 14.399 ≈ 14.4 મિનિટ - ત્રણેય વિદ્યુતવિભાજન કોષ શ્રેણીમાં જોડેલા છે, જેથી ત્રણેયમાં એક જ સરખો વિદ્યુતજથ્થો (Q) પસાર થાય છે અને ત્રણેય માટે Q = 1295.6 કુલંબ છે.
- Zn ના વજનની ગણતરી :
Zn2+ + 2e– → Zn
જેથી 2 મોલ ઇલેક્ટ્રૉનથી 1 મોલ Zn પ્રાપ્ત થાય.
= 2F વિદ્યુતથી 1 મોલ Zn પ્રાપ્ત થાય.
∴ 2 × 96500 કુલંબથી 65g Zn
∴ 1295.6 કુલંબ વિદ્યુતથી પ્રાપ્ત થતું Zn

- નિક્ષેપન પામતા Cu ના દળની ગણતરી :
પ્રક્રિયા : Cu2+ + 2e– → Cu
પ્રક્રિયા પ્રમાણે 2 મોલ ઇલેક્ટ્રૉન વડે 1 મોલ Cu નું નિક્ષેપન થાય. જેથી 2F = 2 × 96500 કુલંબ વડે 63.5g Cuનું નિક્ષેપન થાય.
∴ 1295.6 કુલંબ વિદ્યુતથી જમા થતા Cu નું દળ
= \(\frac{1295.6 \times 63.5}{2 \times 96500}\) = 0.4263g Cu જમા થાય.
![]()
પ્રશ્ન 17.
કોષ્ટક-3.1માં આપેલ પ્રમાણિત વિધુતધ્રુવ પોટેન્શિયલનો ઉપયોગ કરીને અનુમાન કરો કે નીચેના વચ્ચે પ્રક્રિયા શક્ય છે ?
(i) \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\) અને \(\mathrm{I}_{\text {(aq) }}^{-}\)
(ii) \(\mathbf{A g}_{(\mathrm{aq})}^{+}\) અને Cu(s)
(iii) \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\) અને \(\mathrm{Br}_{\text {(aq) }}^{-}\)
(iv) Ag(s) અને \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\)
(v) Br2(aq)અને \(\mathrm{Fe}_{(\mathrm{aq})}^{2+}\)
ઉત્તર:
(i) \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\) અને \(\mathrm{I}_{\text {(aq) }}^{-}\)

= (0.77 – 0.54)V
= 0.23V
આ મૂલ્ય ધન હોવાથી Fe3+ અને I– વચ્ચે પ્રક્રિયા થશે.
(ii) \(\mathbf{A g}_{(\mathrm{aq})}^{+}\) અને Cu(s) વચ્ચે પ્રક્રિયાની સંભાવના નક્કી કરવી.

= 0.80V – 0.34V = 0.46V
આ પ્રક્રિયાનો પ્રમાણિત પોર્ટેન્શિયલ ધન 0.46V છે. જેથી \(\mathbf{A g}_{(\mathrm{aq})}^{+}\) અને Cu(s)ની વચ્ચે પ્રક્રિયા શક્ય છે. બીજી રીતે શ્રેણીમાં Ag ની નીચે Cu છે અથવા \(\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}>\mathrm{E}_{\mathrm{Cu}^{2+} \mid \mathrm{Cu}}^{\ominus}\)
છે. જેથી Cu(s) વડે દ્રાવણમાંથી Ag+ નું વિસ્થાપન થઈ Ag(s) બને તેવી પ્રક્રિયા થાય છે.
(iii) \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\) અને \(\mathrm{Br}_{\text {(aq) }}^{-}\)

= 0.77V – 1.09V
= -0.32V
\(\mathrm{Br}_{\text {(aq) }}^{-}\) અને \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\) વચ્ચે પ્રક્રિયા થશે નહીં. કારણ કે તેમની વચ્ચેની શક્ય રેડોક્ષ પ્રક્રિયાનો પ્રમાણિત પોર્ટેન્શિયલ ઋણ છે.
બીજી રીતે વિદ્યુતરાસાયણિક શ્રેણીમાં Br2 ઉપર અને Fe3+ નીચે છે. એટલે કે im વચ્ચે પ્રક્રિયા થશે કે નહીં તે નક્કી કરવું :
વડે Br– નું ઑક્સિડેશન શક્ય નથી.
(iv) Ag(s) અને \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\) વચ્ચે પ્રક્રિયા થશે કે નહીં તે નક્કી કરવું :
Ag(s)નું ઑક્સિડેશન અને અને Fe+ નું રિડક્શન થાય તેવી નીચે પ્રમાણેની પ્રક્રિયાઓ થઈ શકે છે.

= 0.77V – (0.80V)
= -0.03V
તારવણી : આ રેડોક્ષ પ્રક્રિયાનો પ્રમાણિત પોર્ટેન્શિયલ ઋણ છે. જેથી, પ્રક્રિયા થશે નહીં. \(\mathrm{Fe}_{(\mathrm{aq})}^{3+}\) અને Ag(s) વચ્ચે પ્રક્રિયા થતી નથી.
(E⊖ રિડક્શન પ્રક્રિયાનો < E⊖ ઑક્સિડેશનનો હોય તો ઉપર પ્રમાણેની રેડોક્ષ પ્રક્રિયા થતી નથી.)
(v) Br2(aq)અને \(\mathrm{Fe}_{(\mathrm{aq})}^{2+}\) વચ્ચે પ્રક્રિયા થશે કે નહીં તે નક્કી કરવું :
Br2(aq) અને \(\mathrm{Fe}_{(\mathrm{aq})}^{2+}\) ની વચ્ચે નીચેની પ્રક્રિયા થઈ શકે.

= (1.09V) – (0.77V)
= 0.32V
આ મૂલ્ય ધન હોવાથી પ્રક્રિયા શક્ય છે.

જેથી Br2(aq) અને \(\mathrm{Fe}_{(\mathrm{aq})}^{2+}\) વચ્ચે પ્રક્રિયા થાય છે.
(જો પ્રમાણિત E⊖ મોટો હોય તો તેનું રિડક્શન થાય છે.)
પ્રશ્ન 18.
નીચેનામાંના દરેક વિદ્યુતવિભાજનમાં નીપજ માટે પ્રાકકથન કરો :
(i) AgNO3 નું જલીય દ્રાવણ સિલ્વર વિધુતધ્રુવો સાથે
(ii) AgNO3 નું જલીય દ્રાવણ પ્લેટિનમ વિધુતધ્રુવો સાથે
(iii) H2SO4 નું મંદ દ્રાવણ પ્લેટિનમ વિધુતધ્રુવો સાથે
(iv) CuCl2 નું જલીય દ્રાવણ પ્લેટિનમ વિધુતધ્રુવ સાથે
ઉત્તર:
(i) AgNO3 ના જલીય દ્રાવણનું Agના ધ્રુવોમાં વિદ્યુતવિભાજનનું પ્રાકકથન :
દ્રાવણમાં નીચેના આયનો હોય છે.
(a) AgNO3 માંથી \(\mathrm{Ag}_{(\mathrm{aq})}^{+}+\mathrm{NO}_{3(\mathrm{aq})}^{-}\)
શક્ય પ્રક્રિયા (a) Ag+નું રિડક્શન :
\(\mathrm{Ag}_{(\mathrm{aq})}^{+}\) + e– → Ag(s), \(\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}\) = 0.80 V
શક્ય પ્રક્રિયા (c) \(\mathrm{NO}_{3(\mathrm{aq})}^{-}\) નું ઑક્સિડેશન :
(c) \(\mathrm{NO}_{3(\mathrm{aq})}^{-}\) → NO3 + e–
(b) \(\mathrm{NO}_3^{-}\) નું રિડક્શન :
\(\mathrm{NO}_3^{-}\) + 4H+ + 3e– → NO(g) + 2H2O
(f) Ag ના ધ્રુવનું ઑક્સિડેશન : Ag(S) → Ag+ + e–
\(\mathrm{E}_{\mathrm{NO}_3^{-} \mid \mathrm{NO}}^{\ominus}\) 0.97 V, \(\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}\) = 0.80 V
(e) દ્રાવણમાંના H2Oનું ઑક્સિડેશન :
2H2O → O2(g) + 4H+ + 4e– (\(\mathrm{E}_{\mathrm{O}_2 \mid \mathrm{H}_2 \mathrm{O}}^{\ominus}\) = 1.23V )
દ્રાવણમાંના H0Oનું રિડક્શન :
2H2O(l) + 2e– → H2(g) + \(2 \mathrm{OH}_{\text {(aq) }}^{-}\) (\(\mathrm{E}_{\mathrm{H}_2 \mathrm{O} \mid \mathrm{H}_2}^{\ominus}\) = -0.83)
આથી, કૅથોડ પાસે Ag+, H2O અને \(\mathrm{NO}_3^{-}\) ત્રણ (a), (b), (c) માંથી જેનો E⊖ વધારે હોય તેનું રિડક્શન થાય જેથી Ag+ નું રિડક્શન થઈને Ag(s) કૅથોડની ઉપર જમા થશે.
દ્રાવણમાંના \(\mathrm{NO}_3^{-}\) નું ઑક્સિડેશન (d) તથા પાણીનું ઑક્સિડેશન (e) અને Ag ના ધ્રુવના Ag નું ઑક્સિડેશન (f) માંથી Ag માં E⊖ લઘુતમ છે તેથી Ag નું ઑક્સિડેશન થાય.
Ag(s) → Ag+(aq) + e– ઍનોડ ઉપર થતી કુલ પ્રક્રિયા Ag(s) ઍનોડ ઉપરથી Ag(s) કૅથોડ ઉપ૨. ઍનોડના Agનું દળ ઘટતું અને કૅથોડના Ag નું દળ વધતું જશે.
(ii) Pt ના ઇલેક્ટ્રૉડમાં AgNO3ના દ્રાવણનું વિદ્યુતવિભાજન :
કૅથોડ ઉપર AgNO3 ના દ્રાવણમાંના Ag+ આયનો આવે છે, કૅથોડ ઉપ૨થી ઇલેક્ટ્રૉન સ્વીકારે છે તથા Ag+ રિડક્શન પામી કૅથોડ ઉપ૨ નિક્ષેપન પામે છે.
Ag+(aq) + e– → Ag(s) (રિડક્શન)
ઍનોડ ઉપર ઑક્સિડેશન પ્રક્રિયા : દ્રાવણમાંના \(\mathrm{NO}_3^{-}\) આયનો, Pt ધ્રુવ અને H2Oમાંથી H2Oનું ઑક્સિડેશન થઈને O2 વાયુ મુક્ત થાય છે.
(1.23V) 2H2O → O2(G) + 4H+(aq) + 4e– (ઑક્સિડેશન)
(iii) Pt ના ઇલેક્ટ્રૉડમાં મંદ H2SO4 નું ઑક્સિડેશન :

કૅથોડ પાસે રિડક્શન :
(H+)નું : 2H+(aq) + 2e– → H2(g) (\(\mathrm{E}_{\mathrm{H}^{+} \mid \mathrm{H}_2}^{\ominus}\)= 0.0V) )
(H2O)નું: 2H2O + 2e– → H2(g) + OH–(aq) (\(\mathrm{E}_{\mathrm{O}_2 \mid \mathrm{H}_2\mathrm{O}}^{\ominus}\) = -0.83V)
આ બેમાંથી H2Oનું રિડક્શન થઈને H2 બને છે.
ઍનોડ ઉપર ઑક્સિડેશન :

\(\mathrm{SO}_4^{2-}\) અને H2O માંથી H2Oનું ઑક્સિડેશન થઈ O2 બને છે. આમ H2Oનું વિદ્યુતવિભાજન થાય છે અને ઍનોડ પાસે O2 તથા કૅથોડ પાસે H2 વાયુઓના પરપોટા નીકળે છે.
નોંધ : \(\mathrm{E}_{\text {red }}^{\ominus}\) વધુ તેનું ઑક્સિડેશન અને \(\mathrm{E}_{\text {red }}^{\ominus}\) ઓછું તેનું રિડક્શન
(iv) Pt ના વિદ્યુતધ્રુવોમાં CuCl2 ના દ્રાવણનું વિદ્યુતવિભાજન :

H2O ના ઑક્સિડેશન માટે \(\mathrm{E}_{\mathrm{O}_2 \mid \mathrm{H}_2 \mathrm{O}}^{\ominus}\) = 1.23V ઓછો છે.
આમ, ઍનોડ ઉપર Cu જમા થાય છે અને કૅથોડની પાસે Cl2 વાયુ મુક્ત થાય છે.
નોંધ : દ્રાવણમાં પાણીનું રિડક્શન કે ઑક્સિડેશન થતું નથી.
![]()
GSEB Class 12 Chemistry વિદ્યુત-રસાયણવિજ્ઞાન NCERT Exemplar Questions and Answers
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-I)
નીચેના પ્રશ્નોમાં એક જ વિકલ્પ સાચો છે.
પ્રશ્ન 1.
કયો કોષ કોપર વિદ્યુતધ્રુવનો પ્રમાણિત વિધુતધ્રુવ પોટેન્શિયલ માપશે ?

જવાબ

કોઈપણ વિદ્યુતધ્રુવનો પ્રમાણિત પોર્ટેન્શિયલ નક્કી કરવા માટે અર્ધ-કોષમાં સાંદ્રતા = 1M અને વાયુનાં દબાણ 1 bar જરૂરી છે.
પ્રશ્ન 2.
Mg વિધુતધ્રુવનો વિધુતધ્રુવ પોટેન્શિયલ આપેલા સમીકરણ મુજબ છે :
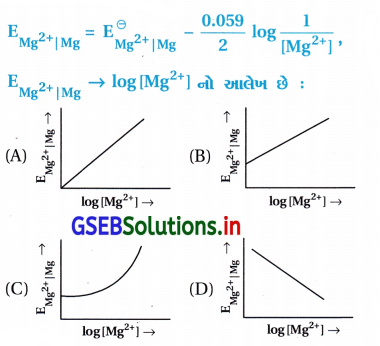
જવાબ
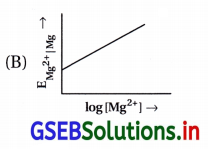
- આ કોયડામાં નર્સ્ટ સમીકરણનું સુરેખ સમીકરણમાં પરિવર્તન કરવાથી મળે.
- Mg વિદ્યુતધ્રુવનો પોર્ટેન્શિયલ નીચેના સૂત્ર પ્રમાણે ફેરફાર પામતા (નર્સ્ટ સમીકરણથી) દર્શાવાય છે.

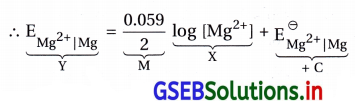
- Mg ના વિદ્યુતધ્રુવના પોર્ટેન્શિયલને ગણવાનું આ સૂત્ર સુરેખાના સમીકરણ Y = MX + C રજૂ કરે છે. આલેખ સીધી રેખાનો.
આથી ઢાળ = M = + \(\frac{0.059}{2}\)
એટલે કે ઢાળ ધન સંખ્યા છે, ઉપર તરફ જતી રેખા હોય. - X ધરી ઉપર log[Mg2+] અને Y ધરીની ઉપર EMg2+]Mg નું મૂલ્ય હોય.
- ધન ઢાળની રેખાને Y ધરી સુધી લંબાવતાં રચાતો આંતરછેદ = C = \(\mathrm{E}_{\mathrm{Mg}^{2+}}^{\ominus}\) દર્શાવશે. આ બધું જ આકૃતિ (B)ના આલેખમાં છે.
પ્રશ્ન 3.
નીચેનામાંથી કયું વિધાન સાચું છે ?
(A) કોષપ્રક્રિયા માટે Ecell અને ΔrG બંને માત્રાત્મક ગુણધર્મો છે.
(B) કોષપ્રક્રિયા માટે Ecell અને ΔrG બંને વિશિષ્ટ ગુણધર્મો છે.
(C) કોષપ્રક્રિયા માટે Ecell વિશિષ્ટ જ્યારે ΔrG માત્રાત્મક ગુણધર્મ છે.
(D) કોષપ્રક્રિયા માટે Ecellcell માત્રાત્મક જ્યારે ΔrG વિશિષ્ટ ગુણધર્મ છે.
જવાબ
(C) કોષપ્રક્રિયા માટે Ecell વિશિષ્ટ જ્યારે ΔrG માત્રાત્મક ગુણધર્મ છે.
- કોષપ્રક્રિયા માટે Ecell નું મૂલ્ય દ્રવ્યનાં દળ કે કણની સંખ્યા ઉપર આધાર રાખતું નથી. જેથી તે વિશિષ્ટ ગુણધર્મ છે.
- ΔrGનું મૂલ્ય દ્રવ્યના દળ (કણની સંખ્યા)ના જથ્થા પર આધાર રાખે છે. જેથી તે માત્રાત્મક ગુણધર્મ છે.
પ્રશ્ન 4.
જ્યારે પ્રવાહ મેળવવામાં આવતો ના હોય ત્યારે બે વિધુતધ્રુવોના વિધુતધ્રુવ પોટેન્શિયલોના તફાવતને ………………… કહે છે.
(A) કોષ પોટૅન્શિયલ
(B) કોષ emf
(C) પોટૅન્શિયલ તફાવત
(D) કોષ વૉલ્ટેજ
જવાબ
(B) કોષ emf
કોષ emf તે બે ભિન્ન ઇલેક્ટ્રૉડને જોડીને રચેલા કોષમાંથી પ્રવાહનો ઉપયોગ ન કરતા હોય ત્યારે તેમની વચ્ચેનો પોટૅન્શિયલ તફાવત છે.
પ્રશ્ન 5.
કોષમાં નિષ્ક્રિય વિદ્યુતધ્રુવ માટે નીચેનું કયું વિધાન સાચું નથી ?
(A) તે કોષપ્રક્રિયામાં ભાગ લેતો નથી.
(B) તે ઑક્સિડેશન અથવા તો રિડક્શન માટે સપાટી પૂરી પાડે છે.
(C) તે ઇલેક્ટ્રૉનના વહન માટે સપાટી પૂરી પાડે છે.
(D) તે રેડોક્ષ પ્રક્રિયા માટે સપાટી પૂરી પાડે છે.
જવાબ
(D) તે રેડોક્ષ પ્રક્રિયા માટે સપાટી પૂરી પાડે છે.
નિષ્ક્રિય વિદ્યુતધ્વની સપાટી ઉપર ઑક્સિડેશન અથવા રિડક્શન પ્રક્રિયા થાય છે, પણ રેડોક્ષ પ્રક્રિયા થતી નથી.
![]()
પ્રશ્ન 6.
એક વિધુતરાસાયણિક કોષ વિદ્યુતવિભાજનીય કોષ તરીકે ત્યારે વર્તે જ્યારે ……………………
(A) Ecell = 0
(B) Ecell > Eext
(C) Eext > Ecell
(D) Ecell = Eext
જવાબ
(C) Eext > Ecell
જ્યારે વિદ્યુતરસાયણ કોષમાં બાહ્ય વિદ્યુત (Eext), વિરુદ્ધ દિશામાંથી તે કોષના પોટેન્શિયલ (Ecell) કરતાં વધારે પસાર કરવામાં આવે છે, ત્યારે તે વિદ્યુતરાસાયણિક કોષનું વિદ્યુતવિભાજનીય કોષમાં રૂપાંતર થાય છે.
પ્રશ્ન 7.
વિધુતવિભાજ્યોનાં દ્રાવણો માટે નીચેનાં વિધાનોમાંથી કયું સાચું નથી ?
(A) દ્રાવણની વાહકતાનો આધાર આયનોના કદ પર રહેલો હોય છે.
(B) વાહકતાનો આધાર દ્રાવણની સ્નિગ્ધતા પર રહેલો હોય છે.
(C) વાહકતાનો આધાર દ્રાવણમાં રહેલાં આયનોના દ્રવીકરણ પર નથી.
(D) તાપમાન વધતા દ્રાવણની વાહકતા વધે છે.
જવાબ
(C) વાહકતાનો આધાર દ્રાવણમાં રહેલાં આયનોના દ્રવીકરણ પર નથી.
જે દ્રાવણમાં વિદ્યુતવિભાજ્ય દ્રાવ્ય કરેલો હોય તેવા દ્રાવણોમાં આયનો હોય છે અને તે વિદ્યુતનાં વાહક હોય છે. આવાં દ્રાવણની વાહકતા નીચેની બાબતો ઉપર આધાર રાખે છે :
(i) આયનોના કદ મોટાં તેમ તે દ્રાવણની વાહકતા ઓછી.
(ii) તાપમાન વધે તેમ વાહકતા વધે છે.
(iii) સ્નિગ્ધતા ઉપર : દ્રાવકની સ્નિગ્ધતા વધારે તેમ દ્રાવણની વાહકતા ઓછી હોય છે.
(iv) વિદ્યુતવિભાજ્યના આયનોનું દ્રાવક યોજન વધારે તેમ વિદ્યુતવિભાજ્યના દ્રાવણની વિદ્યુતવાહકતા ઓછી હોય છે. વાહકતા આયનોના દ્રાવક યોજન ઉપર આધાર રાખે છે.
પ્રશ્ન 8.
નીચે આપેલી માહિતીને આધારે સૌથી પ્રબળ રિડક્શનકર્તા શોધો.

(A) Cl–
(B) Cr
(C) Cr3+
(D) Mn2+
જવાબ
(B) Cr
- અહીં આપેલા બધા જ (રિડક્શન) પ્રમાણિત પોટૅન્શિયલમાંથી
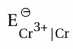 = -0.74V તે લઘુતમ (મહત્તમ ઋણ) મૂલ્ય છે.
= -0.74V તે લઘુતમ (મહત્તમ ઋણ) મૂલ્ય છે.
∴ Cr સૌથી પ્રબળ રિડક્શનકર્તા છે.
Cr → Cr3+ + 3e– (ઑક્સિડેશન) - Cr સૌથી સરળતાથી ઑક્સિડેશન પામે અને તે સૌથી પ્રબળ રિડક્શનકર્તા છે.
Mn2+ < Cl– < Cr3+ < Cr
[રિડક્શનકર્તા તરીકેની પ્રબળતા વધે ∵ E⊖ ઘટે છે.]
પ્રશ્ન 9.
પ્રશ્ન-8 માં આપેલી માહિતીને આધારે શોધી કાઢો કે સૌથી પ્રબળ ઑક્સિડેશનકર્તા કર્યો છે ?
(A) Cl–
(B) Mn2+
(C) \(\mathrm{MnO}_4^{-}\)
(D) Cr3+
જવાબ
(C) \(\mathrm{MnO}_4^{-}\)
- જેમ વિદ્યુતધ્રુવનો પ્રમાણિત પોટૅન્શિયલ (રિડક્શન) વધારે હોય છે તેમ તે વધારે પ્રબળ ઑક્સિડેશનકર્તા હોય છે.
આ અનુસાર \(\mathrm{E}_{\mathrm{MnO}_4^{-} \mid \mathrm{Mn}^{2+}}^{\ominus}\) = 1.51V મહત્તમ છે.
જેથી \(\mathrm{MnO}_4^{-}\) પ્રબળ ઑક્સિડેશનકર્તા છે.
\(\mathrm{MnO}_4^{-}\) > Cl2 < \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}\) > Cr3+ ∵ E⊖ વધે છે.
← ઑક્સિડેશનકર્તા વૃત્તિ પ્રબળ બને છે ← - રિડક્શન અર્ધકોષ (ધ્રુવ)માં રિડક્શન પામનાર ઑક્સિડેશનકર્તા અને રિડક્શનની નીપજ ડિક્શનકર્તા હોય છે.
પ્રશ્ન 10.
પ્રશ્ન-8 માં આપેલી માહિતીને આધારે રિડક્શનકર્તા તરીકેની પ્રબળતાનો કયો ક્રમ સાચો છે તે શોધો.
(A) Cr3+ < Cl– < Mn2+ < Cr
(B) Mn2+ < Cl– < Cr3+ < Cr
(C) Cr3+ < Cl– < \(\mathrm{Cr}_2 \mathrm{O}_7^{2-}\) < \(\mathrm{MnO}_4^{-}\)
(D) Mn < Cr3+ < ClF < Cr
જવાબ
(B) Mn2+ < Cl– < Cr3+ < Cr
કારણ કે ← પ્રમાણિત રિડક્શન પોટૅન્શિયલ E⊖ વધે છે ←

![]()
પ્રશ્ન 11.
પ્રશ્ન-8 માં આપેલી માહિતીને આધારે રિડ્યુસ્ડ અવસ્થામાં સૌથી વધુ સ્થાયી આયન શોધો.
(A) Cl–
(B) Cr3+
(C) Cr
(D) Mn2+
જવાબ
(D) Mn2+
| રિડક્શન પામેલો આયન | E⊖ |
| Mn2+ (\(\mathrm{MnO}_4^{-}\) માંથી) | 1.51V |
| Cl– (Cl2 માંથી) | 1.36V |
| Cr3+ (Cr2O2-7 માંથી) | 1.33V |
| Cr (Cr3+ માંથી) | -0.74V |
\(\mathrm{E}_{\mathrm{MnO}_4^{-} / \mathrm{Mn}^{2+}}^{\ominus}\) નો પોટૅન્શિયલ મહત્તમ (1.51V) છે, જેથી
Mn2+ આયન મહત્તમ સ્થાયી છે.
પ્રશ્ન 12.
પ્રશ્ન-8 માં આપેલી માહિતીનો ઉપયોગ કરો અને સૌથી સ્થાયી ઑક્સિડાઇઝ્ડ સ્પિસીઝ શોધો.
(A) Cr3+
(B) \(\mathrm{MnO}_4^{-}\)
(C) Cr2O2-7
(D) Mn2+
જવાબ
(A) Cr3+
- ⊖ Cr3+ | Cr નું મૂલ્ય -0.74V છે.
જે આપેલાં ચારેયમાં લઘુતમ છે.
રિડક્શન : Cr3+ + 3e– → Cr
ઑક્સિડેશન : Cr → Cr3+ + 3e–
જેથી ઑક્સિડેશન પામેલો (ઑક્સિડેશનની નીપજ) Cr3+ અને ઑક્સિડેશન પામનાર Cr છે. - તેનો પ્રમાણિત રિડક્શન પોર્ટેન્શિયલ (SRP) લઘુતમ (મહત્તમ ઋણ) છે. જેથી Cr3+ આપેલા ચારમાંથી સૌથી વધારે સ્થિર છે.
પ્રશ્ન 13.
Al2O3 માંથી 1 મોલ એલ્યુમિનિયમ મેળવવા જરૂરી વિધુતભારનો જથ્થો ……………………… છે.
(A) 1F
(B) 6F
(C) 3F
(D) 2F
જવાબ
(C) 3F
- પ્રક્રિયા (આયનીકરણ) : Al2O3 → 2AI3+ + 3O2-
Al બનાવતી રિડક્શન પ્રક્રિયા : Al3+ + 3e– → Al 3 મોલ e → 1 મોલ - જેથી 3F વિદ્યુતથી 1 મોલ Al ઉત્પન્ન થાય છે.
પ્રશ્ન 14.
વાહકતા કોષનો કોષ-અચળાંક …………………..
(A) વિદ્યુતવિભાજ્યમાં ફેરફાર કરતાં બદલાય છે.
(B) વિદ્યુતવિભાજ્યની સાંદ્રતામાં ફેરફાર કરતાં બદલાય છે.
(C) વિદ્યુતવિભાજ્યના તાપમાનમાં ફેરફાર કરતાં બદલાય છે.
(D) આપેલ કોષ માટે અચળ હોય છે.
જવાબ
(D) આપેલ કોષ માટે અચળ હોય છે.
- કોષ અચળાંક = \(\frac{l}{\mathrm{~A}}\) જ્યાં, l = કોષની લંબાઈ A = કોષના આડછેદનું ક્ષેત્રફળ
- દરેક કોષ માટે l અને Aનું મૂલ્ય અચળ રહે છે, બદલાતું નથી. જેથી કોષનો કોષ અચળાંક બદલાતો નથી.
પ્રશ્ન 15.
લૅડ સંગ્રાહક કોષને ચાર્જ કરતાં
(A) ઍનોડ પર PbSO4 Pb માં રિડક્શન પામે છે.
(B) કૅથોડ પર PbSO4 Pb માં રિડક્શન પામે છે.
(C) કૅથોડ પર PbSO4 Pb માં ઑક્સિડેશન પામે છે.
(D) ઍનોડ પર PbSO4 PbO2 માં ઑક્સિડેશન પામે છે.
જવાબ
(A) ઍનોડ પર PbSO4 Pb માં રિડક્શન પામે છે.
- લૅડ સંગ્રાહક કોષની બૅટરીનું ચાર્જિંગ કરવામાં આવે ત્યારે બાહ્ય વિદ્યુતપ્રવાહ પસાર કરાય છે. ચાર્જિંગમાં સામાન્ય વપરાતી બૅટરી કરતાં વિરુદ્ધ પ્રક્રિયા થાય છે.
- તેમાં ઍનોડ/કૅથોડ (-ve) ધ્રુવ ઉપર PbSO4 નું રિડક્શન થઈ નીચે પ્રમાણે Pb બને છે.
PbSO4(s) + 2e– → Pb(s) + SO2-4(aq) - ચાર્જિંગ ન હોય ત્યારે આ જ ધ્રુવ ઍનોડ હોય છે. જેથી તેના અનુસંધાન પ્રમાણે મૂળ ઍનોડના PbSO4 નું Pbમાં રિડક્શન થાય છે. તેવું વિચારી શકાય છે, જેથી વિકલ્પ (A) સાચો બને છે.
![]()
પ્રશ્ન 16.
\(\Lambda_{\mathrm{m}\left(\mathrm{NH}_4 \mathrm{OH}\right)}^{\mathrm{O}}\) = …………………….

જવાબ

NH4Clપ્રબળ વિદ્યુતવિભાજ્ય છે.
કોહલરોશના નિયમ પ્રમાણે વિદ્યુતવિભાજ્યની સીમિત મોલર વાહકતા (\(\Lambda_{\mathrm{m}}^{\mathrm{o}}\)) તે વિદ્યુતવિભાજ્યના ધન આયન અને ઋણ આયનોના વ્યક્તિગત ફાળાના સરવાળા બરાબર હોય છે.


પ્રશ્ન 17.
જલીય સોડિયમ ક્લોરાઈડના દ્રાવણના વિદ્યુતવિભાજનમાં કઈ અર્ધકોષપ્રક્રિયા એનોડ પર થશે ?

જવાબ

- ઍનોડ પાસે હંમેશાં ઑક્સિડેશન થાય છે.
NaCl નું દ્રાવણમાં નીચે પ્રમાણે આયનીકરણ હોય છે.
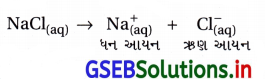
- આ ઋણ આયન (એનાયન), ઍનોડ (+ve) ધ્રુવ નજીક જઈને નીચે પ્રમાણે ઑક્સિડેશન પામી શકે છે.
\(\mathrm{Cl}_{\text {(aq) }}^{-}\) → \(\frac{1}{2}\) Cl2 + e– (\(\mathrm{E}_{\text {cell }}^{\ominus}\) = 1.36V) - ઍનોડ નજીક દ્રાવણમાંનું પાણી પણ હોય છે. આ પાણીનું ઑક્સિડેશન (B) પ્રમાણે થાય.

- “જે વિદ્યુતધ્રુવના અર્ધ-કોષનો પોટેન્શિયલ ઓછો હોય તેનું રિડક્શન થાય.” આ અનુસાર પાણીનું ઑક્સિડેશન થઈને (B) પ્રમાણે O2 વાયુ ઍનોડની પાસે બનતો હોવો જોઈએ.
- વાસ્તવિકતામાં (D) પ્રમાણે પ્રક્રિયા થઈને Cl2 વાયુ ઍનોડ પાસે બને છે. જો NaClની સાંદ્રતા વધારે હોય તો. કારણ કે Cl2 બનવાની પ્રક્રિયા રાસાયણિક ગતિકી પ્રમાણે ઝડપી અને ઓછા વૉલ્ટેજે થાય છે.
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-II)
નીચેના પ્રશ્નોમાં બે કે વધારે વિકલ્પો સાચા હોઈ શકે છે.
પ્રશ્ન 1.
Cu2+/Cu ના પ્રમાણિત વિધુતધ્રુવ પોટેન્શિયલનું ધન મૂલ્ય દર્શાવે છે કે …………………….
(A) આ રેડોક્ષયુગ્મ H+/H2 યુગ્મ કરતાં પ્રબળ રિડક્શનકર્તા છે.
(B) આ રેડોક્ષયુગ્મ H+/H2 યુગ્મ કરતાં પ્રબળ ઑક્સિડેશનકર્તા છે.
(C) Cu ઍસિડમાંથી H2 વિસ્થાપિત કરી શકે.
(D) Cu ઍસિડમાંથી H2 વિસ્થાપિત કરી શકે નહિ.
જવાબ
(B, D)

જેથી નીચે મુજબ પ્રક્રિયા થાય.
Cu+2 + H2 → Cu + 2H+
H2 નું ઑક્સિડેશન થાય. Cu2+|Cu યુગ્મ પ્રબળ ઑક્સિડેશનકર્તા છે.
વધારે E⊖ વાળું યુગ્મ પ્રબળ ઑક્સિડેશનકર્તા હોય છે. Cu પ્રક્રિયામાં ઑક્સિડેશન પામતો નથી. Cu ઍસિડમાંથી H2 વિસ્થાપિત કરી શકે નહીં.
પ્રશ્ન 2.
કેટલાક અર્ધકોષના E⊖ નીચે આપેલા છે તેના આધારે સાચો જવાબ ચિહ્નિત કરો.

(A) મંદ સલ્ફ્યુરિક ઍસિડના દ્રાવણમાં, કૅથોડ ઉપર હાઇડ્રોજન રિડક્શન પામશે.
(B) સાંદ્ર સલ્ફ્યુરિક ઍસિડના દ્રાવણમાં, ઍનોડ ઉપર પાણી ઑક્સિડેશન પામશે.
(C) મંદ સલ્ફ્યુરિક ઍસિડના દ્રાવણમાં, ઍનોડ ઉપર પાણી ઑક્સિડેશન પામશે.
(D) મંદ સલ્ફ્યુરિક ઍસિડના દ્રાવણમાં, ઍનોડ ઉપર SO2-4 આયન ટેટ્રાથાયોનેટ આયનમાં ઑક્સિડેશન પામશે.
જવાબ
(A, C)
H2SO4 નું આયનીકરણ થઈને H+ અને SO2-4 આયનો દ્રાવણમાં હોય છે. અનોડ ઉપર હંમેશાં ઑક્સિડેશન થાય, આ ઉદાહરણમાં પાણી અથવા SO2-4 નું ઑક્સિડેશન નીચે પ્રમાણે થાય.
H2O ના ઑક્સિડેશનની પ્રક્રિયા થઈને O2 બને છે.
2H2O(l) → O2(g) + 4H+(aq) + 4e– (\(\mathrm{E}_{\text {cell }}^{\ominus}\) = 1.23V)
- SO2-4 નું ઑક્સિડેશન ટેટ્રાથાયોસાયનેટ (S2O2-8) માં પ્રક્રિયા, જે થતું નથી.
2SO2-4(aq) → S2O2-8(aq) + 2e–
(\(\mathrm{E}_{\text {cell }}^{\ominus}\) = 1.96V) - પાણીનું ઑક્સિડેશન થાય છે, વિકલ્પ (C) સાચો છે. જેના “\(\mathrm{E}_{\text {cell }}^{\ominus}\) ઓછો હોય તે ઝડપી ઑક્સિડેશન પામે છે.” પાણીનું ઑક્સિડેશન થાય છે.
- કૅથોડની પાસે રિડક્શન થાય છે, અહીં H+ નું H2માં રિડક્શન થાય છે પણ H2O નું રિડક્શન નથી થતું. જેથી વિકલ્પ (A) સાચો છે.
H+નું રિડક્શન : H+(aq) + e– → \(\frac{1}{2}\)H2(g) (\(\mathrm{E}_{\text {cell }}^{\ominus}\) = 0.00V) - પાણીનું રિડક્શન થતું નથી, \(\mathrm{E}_{\mathrm{H}_2 \mathrm{O} \mid \mathrm{H}_2}^{\ominus}\) નું મૂલ્ય ઋણ છે.
પ્રશ્ન 3.
ડેનિયલ કોષનો \(\mathrm{E}_{\text {cell }}^{\ominus}\) = 1.1V છે. નીચેની અભિવ્યક્તિઓ પૈકીની કઈ આ કોષની સંતુલન અવસ્થાનું સાચું વર્ણન કરે છે ?
(A) 1.1 = KC
(B) \(\frac{2.303 \mathrm{RT}}{2 \mathrm{~F}}\)logKC = 1.1
(C) log KC = \(\frac{2.2}{0.059}\)
(D) log KC = 1.1
જવાબ
(B, C)

![]()
પ્રશ્ન 4.
વિદ્યુતવિભાજનીય દ્રાવણની વાહકતાનો આધાર ……………………. છે.
(A) વિદ્યુતવિભાજ્યના સ્વભાવ પર
(B) વિદ્યુતવિભાજ્યની સાંદ્રતા ૫૨
(C) AC સ્રોતના પાવર પર
(D) વિદ્યુતધ્રુવો વચ્ચેના અંતર પર
જવાબ
(A, B)
વાહકતા AC સ્રોતના પાવર અને આયનો વચ્ચેના અંતર ઉપર આધાર રાખતી નથી.
- વિદ્યુતવિભાજયના દ્રાવણની વાહકતાનો આધાર તેમાં (i) ઉમેરેલા વિદ્યુતવિભાજ્યનો સ્વભાવ (પ્રકૃતિ). (ii) નીપજેલા આયનોનું કદ અને તેમનું દ્રાવક યોજન. (iii) દ્રાવકનો સ્વભાવ અને તેની સ્નિગ્ધતા. (iv) તાપમાન ઉપર છે.
- આમ, વાહકતાનો આધાર (A) વિદ્યુતવિભાજ્યની પ્રકૃતિ અને (B) વિદ્યુતવિભાજ્યની સાંદ્રતાની ઉપર આધાર રાખે છે.
પ્રશ્ન 5.
\(\boldsymbol{\Lambda}_{\mathrm{m}}^{\mathbf{o}}\) H2O ના બરાબર ………………. છે.

જવાબ
(A, C)

(B) વિકલ્પ સાચો નથી.

(D) વિકલ્પ સાચો લાગે છે, પણ સાચો લેવાય નહીં.

Na4OH નિર્બળ વિદ્યુતવિભાજ્ય છે જેનું પૂર્ણ આયનીકરણ હોતું નથી.
પ્રશ્ન 6.
CuSO4 ના જલીય દ્રાવણનું પ્લેટિનમના વિધુતધ્રુવો વાપરી
વિદ્યુતવિભાજન કરતાં શું પ્રાપ્ત થશે ?
(A) કૅથોડ ઉપર કૉપર જમા થશે.
(B) ઍનોડ ઉપર કૉપર જમા થશે.
(C) ઍનોડ ઉપર ઑક્સિજન મુક્ત થશે.
(D) ઍનોડ ઉપર કૉપર દ્રાવ્ય થશે.
જવાબ
(A, C)
- (A) Pt નો ધ્રુવ નિષ્ક્રિય છે, તે પ્રક્રિયા થવાની સપાટી આપે છે.
CuSO4(aq) ના વિદ્યુતવિભાજનમાં નીચેની પ્રક્રિયા થાય છે. આયનીકરણ :

આમ, કૅથોડની ઉપર કૉપરનું નિક્ષેપન થાય છે. આથી વિકલ્પ (A) સાચો છે.
- (C) ઍનોડ (+ve) ઉપર \(\mathrm{SO}_4^{2-}\) નું નહીં પણ પાણીનું ઑક્સિડેશન થઈને O2 વાયુ છૂટો પડે છે.

આથી, વિકલ્પ (C) સાચો છે.
પ્રશ્ન 7.
CuSO4 ના જલીય દ્રાવણનું Cuના વિધુતધ્રુવો વાપરી
વિધુતવિભાજન કરતાં શું થશે ?
(A) કૅથોડ ઉપર કૉપર જમા થશે.
(B) ઍનોડ ઉપર કૉપર દ્રાવ્ય થશે.
(C) ઍનોડ ઉપર ઑક્સિજન મુક્ત થશે.
(D) ઍનોડ ઉપ૨ કૉપર જમા થશે.
જવાબ
(A, B)
- આ વિદ્યુતવિભાજનમાં નીચેની પ્રક્રિયાઓ થાય છે.
- ઍનોડ (+ve) ધ્રુવ કૉપર છે, જે પોતે ઑક્સિડેશન પામી દ્રાવ્ય બને છે. તેનું વજન ઘટતું જાય છે. વિકલ્પ (B) સાચો છે.
Cu(s)(ઍનોડમાંનો) → Cu2+(aq) + 2e– (ઑક્સિડેશન) - કૅથોડ (-ve) ધ્રુવ કૉપર છે. ધન કૉપર આયનો (Cu2+) કૉપર ધ્રુવની સપાટી ઉ૫૨થી ઇલેક્ટ્રૉન સ્વીકારી કૉપર ધાતુ બને છે, અને કૅથોડની ઉ૫૨ નિક્ષેપન પામે છે. વિકલ્પ (A) સાચો છે.
રિડક્શન Cu2+(aq) + 2e– → Cu(s) (કૅથોડની ઉ૫૨)
પ્રશ્ન 8.
વાહકતા k, ……………… છે.
(A) \(\frac{1}{\mathrm{R}} \frac{l}{\mathrm{~A}}\)
(B) \(\frac{\mathrm{G}^*}{\mathrm{R}}\)
(C) ∧m
(D) \(\frac{l}{\mathrm{~A}}\)
જવાબ
(A, B)
કોઈપણ પદાર્થનો વિદ્યુતીય અવરોધ (R) તેની લંબાઈ (I)ના સમપ્રમાણમાં અને તેના આડછેદ (A)ના વ્યસ્ત પ્રમાણમાં હોય છે.

![]()
પ્રશ્ન 9.
આયનીય દ્રાવણની મોલર વાહકતાનો આધાર ……………………. છે.
(A) તાપમાન પર
(B) વિદ્યુતધ્રુવો વચ્ચેનાં અંતર ૫૨
(C) દ્રાવણમાં વિદ્યુતવિભાજ્યોની સાંદ્રતા પર (D) વિદ્યુતધ્રુવોની સપાટીનાં ક્ષેત્રફળ પર
જવાબ
(A, C)
(A) તાપમાન વધે તેમ મોલર વાહકતા વધે છે.
(B) મોલર વાહકતા સાંદ્રતામાં ઘટાડાની સાથે વધે છે.
પ્રશ્ન 10.
આપેલા કોષ, Mg | Mg2+ || Cu2+| Cu
(A) Mg કૅથોડ છે.
(B) Cu કૅથોડ છે.
(C) કોષપ્રક્રિયા, Mg + Cu2+ → Mg2+ + Cu છે.
(D) Cu ઑક્સિડેશનકર્તા છે.
જવાબ
(B, C)
- આ ગૅલ્વેનિક કોષમાં ડાબી તરફ ઍનોડ ધ્રુવ Mg | Mg2+ છે, જ્યાં ઑક્સિડેશન થાય છે.
ઑક્સિડેશન : Mg(s) → Mg2+ + 2e– …………… (i)
∴ (A) સાચું નથી. - આ કોષમાં જમણી તરફ કૅથોડ ધ્રુવ Cu | Cu2+ છે, જ્યાં રિડક્શન થાય છે.
રિડક્શન : Cu2+ + 2e– → Cu ……….. (ii)
કોષમાં કુલ પ્રક્રિયા (iii) = (i) + (ii)
(iii) રેડોક્ષ પ્રક્રિયા :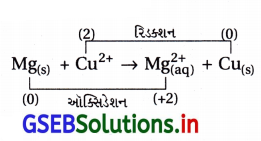
આ પ્રક્રિયા થતી હોવાથી (C) સાચું છે. - આ પ્રક્રિયામાં Mg નું ઑક્સિડેશન અને Cu2+ નું રિડક્શન થાય છે, Cu2+ ઑક્સિડેશનકર્તા છે, Cu ઑક્સિડેશનકર્તા નથી.
∴ વિકલ્પ (D) ખોટો છે.
ટૂંક જવાબી પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
વિધુતધ્રુવનો નિરપેક્ષ વિધુતધ્રુવ પોટેન્શિયલ માપી શકાય ?
ઉત્તર:
વિદ્યુતધ્રુવનો નિરપેક્ષ પોટેન્શિયલ ના માપી શકાય. કારણ કે કોઈ એક જ વિદ્યુતધ્રુવમાં ફક્ત ઑક્સિડેશન અથવા રિડક્શન થાય છે. બે ભિન્ન વિદ્યુતવ હોય તો જ ઑક્સિડેશન- રિડક્શન થઈને પ્રક્રિયા થઈ શકે છે.
પ્રશ્ન 2.
કોષપ્રક્રિયા માટે \(\mathrm{E}_{\text {cell }}^{\ominus}\) અથવા A>G ક્યારેય શૂન્ય થશે ખરાં ?
ઉત્તર:
ના, \(\mathrm{E}_{\text {cell }}^{\ominus}\) અથવા ΔrG⊖ ક્યારેય શૂન્ય થઈ શકે નહીં. કારણ કે જો તેમનાં મૂલ્ય શૂન્ય થાય તો પ્રક્રિયા સંતુલન મેળવે અને પ્રક્રિયા અટકી જાય, કોષનો કોઈ જ અર્થ રહે નહીં.
પ્રશ્ન 3.
કઈ પરિસ્થિતિમાં Ecell = 0 અથવા ΔrG = 0 થાય ?
ઉત્તર:
જ્યારે પ્રક્રિયા રાસાયણિક સંતુલનની સ્થિતિ પ્રાપ્ત કરે ત્યારે પ્રક્રિયા થતી અટકી જાય છે અને Ecell તથા A,G નું મૂલ્ય શૂન્ય બને છે.
પ્રશ્ન 4.
\(\mathrm{E}_{\mathrm{Zn}^{2+} \mid \mathrm{Zn}}^{\ominus}\) = – 0.76V માં ઋણ સંજ્ઞાનો અર્થ શું છે ?
ઉત્તર:
ધાતુના પ્રમાણિત રિડક્શન પોર્ટેન્શિયલનું મૂલ્ય જેમ વધુ ઋણ હોય તેમ ધાતુ વધુ સક્રિય છે. તે ધાતુનું ઑક્સિડેશન H2 કરતાં સરળ છે. અને તે ધાતુની ઍસિડના (H+) ની સાથે પ્રક્રિયા થઈને H2 વાયુ મુક્ત થાય છે. ધાતુ ઍસિડમાં દ્રાવ્ય બને છે. H+ નું રિડક્શન અને ધાતુ Zn નું ઑક્સિડેશન થાય છે. તેના ગેલ્વેનિક કોષમાં Zn ઍનોડ અને H2 કૅથોડ બને છે.
![]()
પ્રશ્ન 5.
બે જુદા-જુદા વિધુતવિભાજનીય કોષમાં કૉપર સલ્ફેટ તથા સિલ્વર નાઈટ્રેટના જલીય દ્રાવણનું 1 એમ્પિયર પ્રવાહ વાપરી 10 મિનિટ સુધી વિદ્યુતવિભાજન કરવામાં આવ્યું. કેથોડ પર જમા થતાં કૉપર અને સિલ્વરનાં દળ સમાન હશે કે જુદાં-જુદાં ? તમારો ઉત્તર સમજાવો.
ઉત્તર:
- Cu અને Ag નાં દળ ભિન્ન હશે. બંનેમાં વિદ્યુતજથ્થો Q એક સમાન છે પણ Ag અને Cuનાં તુલ્યાંક ભિન્ન છે.
Ag+ + e– → Ag અને Cu2+ + 2e– → Cu - જેથી 1F વિદ્યુતથી 1 મોલ Ag અને \(\frac{1}{2}\) મોલ Cu નું નિક્ષેપન થાય. આમ, વિદ્યુતજથ્થો સમાન હોવા છતાં મુક્ત થતાં Ag અને Cu નાં દળ ભિન્ન હોય છે.
પ્રશ્ન 6.
કોષપ્રક્રિયા Cu + 2Ag+ → 2Ag + Cu2+ થતી હોય તેવા ગેલ્વેનિક કોષનું નિરૂપણ કરો.
ઉત્તર:
ગેલ્વેનિક કોષના નિરૂપણમાં ઑક્સિડેશન અર્ધ-પ્રક્રિયા ડાબી ત૨ફ અને રિડક્શન અર્ધ-પ્રક્રિયા જમણી તરફ લખાય છે. Cu નું ઑક્સિડેશન અને Ag નું રિડક્શન થાય છે અને ક્ષારસેતુને બે ઊભી સમાંતર લીટી વડે દર્શાવતા આ કોષનું નિરૂપણ નીચે પ્રમાણે છે :
Cu | Cu2+ || Ag+ | Ag
પ્રશ્ન 7.
Cl– આયનોના ઓક્સિડેશન માટેના પ્રમાણિત વિધુતધ્વ પોટેન્શિયલનું મૂલ્ય પાણીના કરતાં વધારે ધન છે, તેમ છતાં જલીય સોડિયમ ક્લોરાઈડના વિદ્યુતવિભાજન દરમિયાન એનોડ પર પાણીના બદલે Cl– ઑક્સિડેશન પામે છે, શા માટે ?
ઉત્તર:
- સામાન્ય રીતે જેનો પોટેન્શિયલ ઓછો હોય તેનું ઑક્સિડેશન વિદ્યુતધ્રુવની ઉપર થાય છે.
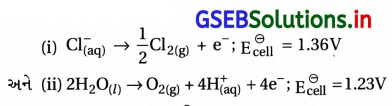
- આ મૂલ્યો પ્રમાણે ઓછો \(\mathrm{E}_{\text {cell }}^{\ominus}\) ધરાવતા પાણીનું ઑક્સિડેશન થવું જોઈએ. વાસ્તવિકતામાં Cl– નું ઑક્સિડેશન થાય છે. પણ H2O નું ઑક્સિડેશન નથી થતું.
- ઑક્સિજનના “ઓવર પોટૅન્શિયલ”ના કારણે પ્રક્રિયા (i) થાય છે, પણ પ્રક્રિયા (ii) નથી થતી. H2Oનું ઑક્સિડેશન થવા માટે ઓવર પોર્ટેન્શિયલ જરૂરી છે. જે ન હોવાથી પાણીનું નહીં પણ Cl– નું ઑક્સિડેશન થઈને Cl2 બને છે.
પ્રશ્ન 8.
ઇલેક્ટ્રોડ પોટેન્શિયલ એટલે શું ?
ઉત્તર:
વિદ્યુતરાસાયણિક કોષમાં વિદ્યુતધ્રુવ અને વિદ્યુતવિભાજ્યની વચ્ચેના પોર્ટેન્શિયલના તફાવતને ઇલેક્ટ્રૉડ પોટૅન્શિયલ કહે છે. વિદ્યુતધ્રુવ અને તેના વિદ્યુતવિભાજ્યના દ્રાવણની વચ્ચે ઉદ્ભવેલ વિદ્યુત પોટૅન્શિયલના તફાવતને ઇલેક્ટ્રૉડ પોટેન્શિયલ કહે છે.
પ્રશ્ન 9.
નીચેની આકૃતિ ધ્યાનમાં લો જેમાં એક વિધુતરાસાયણિક કોષને વિધુતવિભાજનીય કોષ સાથે જોડ્યો છે. વિદ્યુત- વિભાજનીય કોષમાં વિધુતધ્રુવો ‘A તથા ‘B’ ની ધ્રુવીયતા (સંજ્ઞા) શું હશે ?
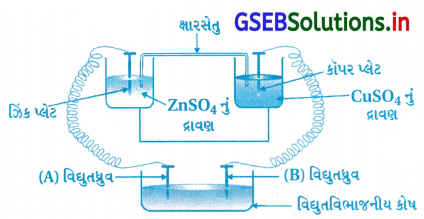
ઉત્તર:
- (A) વિદ્યુતધ્રુવનો વીજભાર ઋણ (−ve) અને વિદ્યુતધ્રુવ (B) નો વીજભાર ધન (+ve) હશે. કારણ કે Zn Cu ના વિદ્યુત- રાસાયણિક કોષને વિદ્યુતવિભાજનીય કોષની સાથે જોડેલો છે.
- વિદ્યુતરાસાયણિક કોષમાં Zn નું ઑક્સિડેશન થાય છે. (Zn → Zn2+ + 2e–). આ ઇલેક્ટ્રૉન Znની ઉપર આવવાથી Zn ઋણ હોય છે. જેથી તેની સાથે જોડેલા (A) ધ્રુવ ધન બને છે.
- કોષમાં કૉપર આયનનું કૉપરમાં રિડક્શન થવાથી ઇલેક્ટ્રૉન ઘટવાના કારણે કૉપર ધન હોય છે અને તેની સાથે જોડેલો (B) ધ્રુવ ઋણ હોય છે.
પ્રશ્ન 10.
વિધુતવિભાજનીય દ્રાવણનો અવરોધ માપવા શા માટે ઊલટસૂલટ પ્રવાહ (a.c.) વાપરવામાં આવે છે ?
ઉત્તર:
(a.c.) વિદ્યુતનો ઉપયોગ કરવાથી વિદ્યુતવિભાજ્યમાં આયનોનું સાંદ્રણ અચળ રહે છે, વિદ્યુતવિભાજ્યની પ્રક્રિયા થતી નથી અને દ્રાવણના અવરોધનું ચોક્કસ મૂલ્ય મળે છે.
પ્રશ્ન 11.
એક ગૅલ્વેનિક કોષનો પોટેન્શિયલ 1.1V છે. જો આ કોષને 1.1V નો પોટેન્શિયલ વિરુદ્ધ દિશામાં લગાડવામાં આવે, તો કોષપ્રક્રિયા તથા કોષમાંથી વહેતા પ્રવાહનું શું થશે ?
ઉત્તર:
- \(\mathrm{E}_{\text {cell }}^{\ominus}\) = 1.1V અને \(\mathrm{E}_{\text {ext }}^{\ominus}\) = 1.1V વિરુદ્ધ દિશામાં પસાર કરવાથી \(\mathrm{E}_{\text {cell }}^{\ominus}\) = \(\mathrm{E}_{\text {ext }}^{\ominus}\) થાય છે.
- તેથી, કોષપ્રક્રિયા અટકી જાય છે, એટલે કે કોષમાં રાસાયણિક પ્રક્રિયા થતી નથી અને કોષમાં વિદ્યુતપ્રવાહ વહેતો નથી.
![]()
પ્રશ્ન 12.
જ્યારે બ્રાઈન (જલીય NaCl નું દ્રાવણ)નું વિદ્યુતવિભાજન કરવામાં આવે ત્યારે તેની pH કેવી રીતે અસર પામશે ?
ઉત્તર:
- pH માં વધારો થશે.
- બ્રાઈન (NaCl)ના વિદ્યુતવિભાજનમાં કૅથોડની ઉપર Na+નું રિડક્શન નથી થતું પણ પાણીનું રિડક્શન નીચેની પ્રક્રિયા પ્રમાણે થઈને કૅથોડની પાસે (H2 + OH–) બને છે.
2H2O(l) + 2e– → H2(g) + 2OH–(aq)….(રિડક્શન) અને pOH = −log10[OH–] - આથી [OH–] કૅથોડની નજીક વધે છે, દ્રાવણ બેઝિક બને છે અને pOH ઘટે છે તથા pH વધે છે.
સમજો : [OH–] = 0.1M તો pOH = 1 અને pH = 13
જો [OH–] = 0.01M તો pOH = 2 અને pH = 12
આમ, [OH–] વધે તેમ POH વધે પણ pH ઘટે છે.
પ્રશ્ન 13..
સૂકા કોષથી ઊલટું, મરક્યુરી કોષનો કોષ પોટેન્શિયલ તેના ઉપયોગી જીવનકાળ દરમિયાન અચળ રહે છે. શા માટે ?
ઉત્તર:
- કારણ કે મરક્યુરી કોષની કુલ પ્રક્રિયા દરમિયાન કોઈ જ આયનો પ્રક્રિયામાં ભાગ લેતા નથી.
- મરક્યુરી કોષમાં ઍનોડ તરીકે ઝિંકનો મરક્યુરી સાથેનો સંરસ ઍનોડ તરીકે હોય છે અને HgO અને કાર્બનની લૂગદી કૅથોડ તરીકે હોય છે. તેમાં ધ્રુવોની ઉપર નીચેની પ્રક્રિયા થાય છે.

- આ કોષનો પોટૅન્શિયલ 1.35V તેના આવરદા દરમિયાન અચળ રહે છે કારણ કે એકંદરે કોષપ્રક્રિયામાં કોઈ પણ આયન સમાવિષ્ટ નથી.
પ્રશ્ન 14.
બે વિદ્યુતવિભાજ્યો ‘A’ અને ‘B’ નાં દ્રાવણોને મંદ કરવામાં આવ્યાં. પરિણામે ‘B’ ની ∧m 1.5 ગણી જ્યારે A ની 25 ગણી વધે છે. બેમાંથી કયો પ્રબળ વિદ્યુતવિભાજ્ય છે ? તમારા ઉત્તરનું વાજબીપણું ઠરાવો.
ઉત્તર:
- વિદ્યુતવિભાજ્ય Bના સાપેક્ષમાં A પ્રબળ વિદ્યુતવિભાજ્ય છે.
- વિદ્યુતવિભાજ્ય (A) પ્રબળ હોઈ તેનું પૂર્ણ આયનીકરણ થાય છે, અને મંદન સાથે તેનાં આયનોની સાંદ્રતામાં ખાસ ફેર પડતો નથી. જેથી ∧m ના મૂલ્યમાં ઓછો (1.5 ગણો જ) ફે૨ પડે છે.
- વિદ્યુતવિભાજય (B) નિર્બળ હોઈ તેનું મંદન કરવાથી આયનીકરણમાં અધિક વધારો થાય છે. પરિણામે મંદન સાથે તેના ∧m માં તીવ્ર વધારો (25 ગણો) થાય છે. ∧mના આ ફેરફારો મંદન થતાં આયનો વચ્ચેનાં અંતરો વધવાથી તેઓની વચ્ચે આંતરઆયન આકર્ષણો ઘટવાથી થાય છે. જેના ∧m માં મંદન કરવાથી ઓછો વધારો થાય તે પ્રબળ વિદ્યુતવિભાજ્ય હોય છે.”
પ્રશ્ન 15.
જ્યારે ઍસિડિક પાણી (મંદ H2SO4 નું દ્રાવણ)નું વિદ્યુત- વિભાજન કરવામાં આવે ત્યારે, દ્રાવણની pH અસર પામશે ? તમારા ઉત્તરનું વાજબીપણું ઠરાવો.
ઉત્તર:
- pH મૂલ્ય ઉપર કોઈ જ અસર થશે નહીં. કોઈ પણ દ્રાવણનું pH મૂલ્ય તે દ્રાવણમાં રહેલા H+ ની સાંદ્રતાના મૂલ્ય ઉપર આધાર રાખે છે.
- ઍસિડિક પાણી એટલે કે અહીં H2SO4 ના મંદ દ્રાવણના વિદ્યુતવિભાજનમાં નીચે પ્રમાણે પ્રક્રિયા થાય છે.
H2SO4 → 2H+ + \(\mathrm{SO}_4^{2-}\) - કૅથોડ પાસે કેટાયન H+ નું રિડક્શન થાય છે.
2H+ + 2e– → H2(g) ………(i) - ઍનોડની સપાટી ઉપર \(\mathrm{SO}_4^{2-}\) નું નહીં પણ H2O ઑક્સિડેશન પામે છે.
H2O(l) → \(\frac{1}{2}\) O2 + 2H+ + 2e– ………. (ii)
કુલ પ્રક્રિયા = (i) + (ii)
H2O(l) → H2(g) + \(\frac{1}{2}\)O2(g)
આ પ્રક્રિયામાં H+ અથવા OH– ની સાંદ્રતામાં કોઈ જ ફેરફાર થતો નથી. pH અચળ જળવાઈ રહે છે.
પ્રશ્ન 16.
જલીય દ્રાવણમાં પાણી ઉમેરતાં વિદ્યુતવિભાજ્યની વિશિષ્ટ વાહકતા કેવી રીતે બદલાય છે ?
ઉત્તર:
દ્રાવણના મંદનની સાથે દ્રાવણની વિશિષ્ટ વાહકતા ઘટે છે. વિદ્યુતવિભાજ્યના દ્રાવણમાં પાણી ઉમેરવાથી મંદન થવાથી દ્રાવણમાં આયનો વચ્ચેના અંતરમાં વધારો થાય છે. તેથી દ્રાવણના એકમ કદમાં આયનોની સંખ્યામાં ઘટાડો થાય છે. આ કારણથી મંદન કરવાથી તેની વિશિષ્ટ વાહકતા ઘટે છે.
પ્રશ્ન 17.
અન્ય વિધુતધ્રુવોના વિધુતધ્રુવ પોટેન્શિયલ માપવા માટે કયો સંદર્ભ વિધુતધ્રુવ વપરાય છે ?
ઉત્તર:
- પ્રમાણિત હાઇડ્રોજન વિદ્યુતધ્રુવ
- પ્રમાણિત હાઇડ્રોજન વિદ્યુતધ્રુવનો પોટેન્શિયલ 0.0 વૉલ્ટ સ્વીકારવામાં આવ્યો છે અને તેના સંદર્ભમાં કોઈપણ અન્ય વિદ્યુતધ્રુવનો પોટૅન્શિયલ માપવામાં આવે છે.
પ્રશ્ન 18.
નીચેનો કોષ ધ્યાનમાં લો :
Cu | Cu2+ || C– | Cl2, Pt
એનોડ અને કેથોડ પર થતી પ્રક્રિયાઓ લખો.
ઉત્તર:
- Cu નું ઑક્સિડેશન અને Cl2 નું રિડક્શન થશે.
ઍનોડ Cu ઉપર ઑક્સિડેશન : Cu(s) → Cu2+(aq) + 2e–
કૅથોડ (Pt) ઉપર Cl2 નું રિડક્શન : Cl2 + 2e– → 2Cl–(aq) - ઍનોડમાંનો Cu(s) દ્રાવ્ય બને અને કૅથોડ પાસે Cl2 ના રિડક્શનથી Cl– આયન છૂટો પડે છે.
![]()
પ્રશ્ન 19.
ડેનિયલ કોષમાં થતી કોષપ્રક્રિયા માટેનું નર્નસ્ટ સમીકરણ લખો. જ્યારે Zn2+ આયનોની સાંદ્રતા વધારવામાં આવે ત્યારે Eell કેવી રીતે અસર પામશે ?
ઉત્તર:
- ડેનિયલ કોષ માટે નર્સ્ટ સમીકરણ નીચે પ્રમાણે છે :
Ecell = \(\mathrm{E}_{\text {cell }}^{\ominus}\) – \(\frac{0.0591}{2}\) log10 [latex]\frac{\mathrm{Zn}^{2+}}{\mathrm{Cu}^{2+}}[/latex] - જો Zn2+ ની સાંદ્રતા વધારવામાં આવે તો Ecell મૂલ્યમાં ઘટાડો થાય છે.
- Zn2+ ની સાંદ્રતા વધારવાથી [latex]\frac{\mathrm{Zn}^{2+}}{\mathrm{Cu}^{2+}}[/latex] નું મૂલ્ય વધે છે, જેથી
log [latex]\frac{\mathrm{Zn}^{2+}}{\mathrm{Cu}^{2+}}[/latex] નું મૂલ્ય વધે છે. - આથી \(\mathrm{E}_{\text {cell }}^{\ominus}\)માં બાદ કરાતું મૂલ્ય વધે છે અને પરિણામે Ecell ઘટે છે.
પ્રશ્ન 20.
પ્રાથમિક અને દ્વિતીયક બેટરીની તુલનામાં બળતણ કોષનો ફાયદો શું છે ?
ઉત્તર:
- પ્રાથમિક બૅટરીમાં પ્રક્રિયકો પ્રક્રિયા થવાથી વપરાઈ જાય અને બૅટરી બિનઉપયોગી બની જાય છે.
- દ્વિતીયક બૅટરીનું ચાર્જિંગ કરી શકાય છે પણ તેમાં લાંબો સમય જાય છે.
(i) બળતણ કોષમાં જ્યાં સુધી બળતણ આપવામાં આવે ત્યાં સુધી તે સતત ચાલુ રહે છે અને નીપજો સતત દૂર કરાય છે.
(ii) બળતણ કોષનું ચાર્જિંગ કરવું પડતું નથી.
પ્રશ્ન 21.
લેડ સંગ્રાહક કોષ જ્યારે ડિસ્ચાર્જ થતો હોય ત્યારે તેની કોષપ્રક્રિયા લખો. જ્યારે કોષ સંપૂર્ણ ડિસ્ચાર્જ થઈ જાય ત્યારે વિદ્યુતવિભાજ્યની ઘનતામાં શું ફેરફાર થાય છે ?
ઉત્તર:
- લૅડ સંગ્રાહક કોષ ડિસ્ચાર્જ પામતો હોય ત્યારે તેમાં નીચેની પ્રક્રિયા થતી હોય છે :
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l) - જ્યારે કોષ ડિસ્ચાર્જ થાય ત્યારે વિદ્યુતવિભાજ્યની ઘનતા ઘટે છે. આ કોષમાં વિદ્યુતવિભાજ્ય તરીકે 38% H2SO4 લેવાય છે. H2SO4 ની ઘનતા પાણી કરતાં વધારે છે.
- પ્રક્રિયામાં H2SO4 વપરાય છે અને પાણી બને છે. આથી વિદ્યુતવિભાજ્યની ઘનતા ઘટતી જાય છે, ઘટે છે.
પ્રશ્ન 22.
CH3COOH નું મંદન કરતાં તેની ∧m એકાએક વધે છે, જ્યારે CH3COONa ની ધીમે-ધીમે વધે છે ? શા માટે ?
ઉત્તર:
- CH3COOH તે નિર્બળ વિદ્યુતવિભાજ્ય હોવાથી તેના દ્રાવણને મંદ કરવાથી દ્રાવણમાં વિયોજન વધારે થાય છે અને આયનોની સાંદ્રતા વધે છે જેથી ઝડપથી ∧m વધે છે.

- CH3COONa પ્રબળ વિદ્યુતવિભાજ્ય છે. તેનું દ્રાવણમાં સંપૂર્ણ આયનીકરણ હોવાથી મંદન કરવાથી આયનોની સાંદ્રતા લગભગ અચળ રહે છે.
CH3COONa(l) → CH3COO–(aq) + Na+(aq)
પણ દ્રાવણમાં આયનો વચ્ચેનું અંતર દ્રાવણને મંદ કરવાથી વધે છે અને પરિણામે આયનો વચ્ચેના આંતર આકર્ષણો ઘટવાથી ∧mના મૂલ્યમાં ધીમો (ઓછો) વધારો થાય છે.
જોડકાં પ્રકારના પ્રશ્નો
નીચેના કેટલાક પ્રશ્નોમાં ડાબી બાજુની કોલમનો એક વિકલ્પ જમણી બાજુની કોલમના એક અથવા એકથી વધુ વિકલ્પો સાથે સંલગ્ન હોઈ શકે છે.
પ્રશ્ન 1.
કૉલમ – Iમાં આપેલાં પદોને કૉલમ – IIમાં આપેલા એકમોની સાથે જોડો :
| કૉલમ – I | કોલમ – II |
| (A) ∧m | (1) S Cm-1 |
| (B) Ecell | (2) m-1 |
| (C) k | (3) S cm2 mol-1 |
| (D) G* | (4) V |
ઉત્તર:
| કૉલમ – I | કોલમ – II |
| (A) ∧m | (3) S cm2 mol-1 |
| (B) Ecell | (4) V |
| (C) k | (1) S Cm-1 |
| (D) G* | (2) m-1 |
પ્રશ્ન 2.
કૉલમ – I માં આપેલાં પદોને કૉલમ – II માં આપેલી વિગતો સાથે જોડો.
| કૉલમ – I | કોલમ – II |
| (A) ∧m | (1) વિશિષ્ટ ગુણધર્મ |
| (B) \(\mathrm{E}_{\text {cell }}^{\ominus}\) | (2) આયનોની સંખ્યા/કદ પર આધાર રાખે છે |
| (C) k | (3) માત્રાત્મક ગુણધર્મ |
| (D) ΔrGcell | (4) મંદન કરતા વધે છે. |
ઉત્તર:
| કૉલમ – I | કોલમ – II |
| (A) ∧m | (4) મંદન કરતા વધે છે. |
| (B) \(\mathrm{E}_{\text {cell }}^{\ominus}\) | (1) વિશિષ્ટ ગુણધર્મ |
| (C) k | (2) આયનોની સંખ્યા/કદ પર આધાર રાખે છે |
| (D) ΔrGcell | (3) માત્રાત્મક ગુણધર્મ |
![]()
પ્રશ્ન 3.
કૉલમ – I અને કૉલમ – II ની વિગતોને જોડો.
| કૉલમ – I | કોલમ – II |
| (A) લૅડ સંગ્રાહક કોષ | (1) મહત્તમ કાર્યક્ષમતા |
| (B) મરક્યુરી કોષ | (2) ગેલ્વેનાઇઝેશન વડે અટકાવી શકાય |
| (C) બળતણ કોષ | (3) સ્થિર પોટેન્શિયલ આપે છે. |
| (D) ક્ષારણ | (4) Pb નો એનોડ, PbO2 નો કેથોડ |
ઉત્તર:
| કૉલમ – I | કોલમ – II |
| (A) લૅડ સંગ્રાહક કોષ | (4) Pb નો એનોડ, PbO2 નો કેથોડ |
| (B) મરક્યુરી કોષ | (3) સ્થિર પોટેન્શિયલ આપે છે. |
| (C) બળતણ કોષ | (1) મહત્તમ કાર્યક્ષમતા |
| (D) ક્ષારણ | (2) ગેલ્વેનાઇઝેશન વડે અટકાવી શકાય |
- (A) લેંડ સંગ્રાહક કોષ
ઍનોડ (Pb)ની પ્રક્રિયા (Pb)નું ઑક્સિડેશન થાય છે.
Pb(s) + SO2-4(aq) → PbSO4(s) + 2e–
કૅથોડ (PbO2)ની ઉપર રિડક્શન થાય છે.
PbO2(s) + SO2-4(aq) + 4H+(aq) + 2e– → PbSO4(s) + 2H2O(l) - (B) મરક્યુરી કોષ આયનો ધરાવતો નથી જેથી તેનો પોટેન્શિયલ સ્થાયી (અચળ) જળવાઈ રહે છે.
- (C) બળતણ કોષમાં બળતણનું દહન ઊંચી ક્ષમતા ધરાવે છે. તેમાં ઊર્જાનો વ્યય લઘુતમ થાય છે અને બાકીનાં દહનનાં સાપેક્ષ વધારે ઊર્જા મળે છે.
- (D) ધાતુનું ક્ષારણ અટકાવવા માટે તેની ઉપર ધાતુઓનું પાતળું સ્તર ચઢાવાય છે એટલે કે ઢોળ ચઢાવાય છે. જેમ કે લોખંડનાં ગૅલ્વેનાઇઝ્ડ પતરામાં Feની ઉપર સક્રિય Znનું સ્તર ચઢાવાય છે.
પ્રશ્ન 4.
કૉલમ – I અને કૉલમ – II ની વિગતોને જોડો.
| કોલમ – I | કોલમ – II |
| (A) k | (1) i × t |
| (B) ∧m | (2) ∧m / \(\Lambda_{\mathrm{m}}^0\) |
| (C) α | (3) \(\frac{k}{\mathrm{c}}\) |
| (D) Q | (4) \(\frac{\mathrm{G}^*}{\mathrm{R}}\) |
ઉત્તર:
| કોલમ – I | કોલમ – II |
| (A) k | (4) \(\frac{\mathrm{G}^*}{\mathrm{R}}\) |
| (B) ∧m | (3) \(\frac{k}{\mathrm{c}}\) |
| (C) α | (2) ∧m / \(\Lambda_{\mathrm{m}}^0\) |
| (D) Q | (1) i × t |

પ્રશ્ન 5.
કૉલમ – I અને કૉલમ – II ની વિગતોને જોડો.
| કૉલમ – I | કૉલમ – II |
| (A) લેકલેન્થે કોષ | (1) કોષપ્રક્રિયા : 2H2 + O2 → 2H2O |
| (B) Ni-Cd કોષ | (2) દ્રાવણમાં કોઈ આયન સંકળાયેલો હોતો નથી અને સાંભળવાનાં સાધનોમાં વપરાય છે. |
| (C) બળતણ કોષ | (3) પુનઃજીવિત કરી શકાય. |
| (D) મરક્યુરી કોષ | (4) અનોડ પર પ્રક્રિયા : Zn → Zn2+ + 2e– |
| (5) દહનઊર્જાનું વિદ્યુતઊર્જામાં રૂપાંતર |
ઉત્તર:
| કૉલમ – I | કૉલમ – II |
| (A) લેકલેન્થે કોષ | (4) અનોડ પર પ્રક્રિયા : Zn → Zn2+ + 2e– |
| (B) Ni-Cd કોષ | (3) પુનઃજીવિત કરી શકાય. |
| (C) બળતણ કોષ | (1) કોષપ્રક્રિયા : 2H2 + O2 → 2H2O, (5) દહનઊર્જાનું વિદ્યુતઊર્જામાં રૂપાંતર |
| (D) મરક્યુરી કોષ | (2) દ્રાવણમાં કોઈ આયન સંકળાયેલો હોતો નથી અને સાંભળવાનાં સાધનોમાં વપરાય છે. |
- (A) બેંકલાસે કોષ : તેને સૂકો કોષ પણ કહે છે. તેમાં Znનું નળાકાર પાત્ર વપરાય છે. જે ઍનોડ હોય છે અને તેના ઉપર (4) પ્રમાણે નીચેની ઑક્સિડેશન પ્રક્રિયા થાય છે.
Zn(s) → Zn2+ + 2e– - (B) Ni – Cd કોષ : તે દ્વિતીયક કોષ છે. તેને પુનઃચાર્જ કરી શકાય છે.
- (C) બળતણ કોષ : આવા કોષમાં હાઇડ્રોજન, મિથેન, મિથેનોલ વગેરે ઈંધણોની દહનઊર્જા (રાસાયણિક ઊર્જા)નું સીધું જ વિદ્યુતઊર્જામાં પરિવર્તન કરવામાં આવે છે.
- હાઇડ્રોજન બળતણ કોષમાં જલીય NaOH ના સાંદ્ર દ્રાવણમાં હાઇડ્રોજન અને ઑક્સિજન વાયુઓ પસાર કરાય છે ત્યારે નીચેની રેડોક્ષ પ્રક્રિયા થાય છે :
2H2(g) + O2(g) → 2H2O(l)
પ્રશ્ન 6.
નીચે આપેલી માહિતીને આધારે કૉલમ – I અને કૉલમ – II ની વિગતોને જોડો.

| કૉલમ – I | કૉલમ – II |
| (A) F2 | (1) ધાતુ સૌથી પ્રબળ રિડક્શનકર્તા છે. |
| (B) Li | (2) ધાતુ આયન કે જે સૌથી નિર્બળ ઑક્સિડેશનકર્તા છે. |
| (C) Au3+ | (3) અધાતુ કે જે સૌથી શ્રેષ્ઠ ઑક્સિડેશનકર્તા છે. |
| (D) Br– | (4) નિષ્ક્રિય ધાતુ |
| (E) Au | (5) Au3+ વડે ઑક્સિડેશન પામતો એનાયન |
| (F) Li+ | (6) એનાયન કે જે સૌથી નિર્બળ રિડક્શનકર્તા છે. |
| (7) ધાતુ આયન કે જે ઑક્સિડેશનકર્તા છે. |
ઉત્તર:
| કૉલમ – I | કૉલમ – II |
| (A) F2 | (3) અધાતુ કે જે સૌથી શ્રેષ્ઠ ઑક્સિડેશનકર્તા છે. |
| (B) Li | (1) ધાતુ સૌથી પ્રબળ રિડક્શનકર્તા છે. |
| (C) Au3+ | (7) ધાતુ આયન કે જે ઑક્સિડેશનકર્તા છે. |
| (D) Br– | (5) Au3+ વડે ઑક્સિડેશન પામતો એનાયન |
| (E) Au | (4) નિષ્ક્રિય ધાતુ |
| (F) Li+ | (2) ધાતુ આયન કે જે સૌથી નિર્બળ ઑક્સિડેશનકર્તા છે. |
| (G) F– | (6) એનાયન કે જે સૌથી નિર્બળ રિડક્શનકર્તા છે. |
- આપેલાં E⊖ ના મૂલ્યોથી નીચેની emf શ્રેણી બને છે.

- કોઈપણ રિડક્શન અર્ધ-પ્રક્રિયા :

- (A) F2 અધાતુ છે. તેનો E⊖ મહત્તમ છે. જેથી આ F2 સરળતાથી રિડક્શન પામે અને સૌથી શ્રેષ્ઠ ઑક્સિડેશનકર્તા છે.
- (B) Li : ધાતુ છે, આ ઉપરાંત અહીં બીજી ધાતુ Au છે. આ બેમાંથી Li ધાતુ માટે E⊖ ઓછો હોવાથી Li ધાતુ સૌથી પ્રબળ રિડક્શનકર્તા છે.
- (C) Au3+ ધાતુ આયન છે. Au3+ નો રિડક્શન પોટૅન્શિયલ વધારે છે. આથી આપેલ ધાતુ આયનોમાં Au3+ ઑકિસડેશનકર્તા છે.
- (D) Br– ઋણ આયન છે. Br– → \(\frac{1}{2}\)Br તે ઑક્સિડેશન અર્ધ- પ્રક્રિયા છે, Br– નું ઑક્સિડેશન થાય.
3Br– → \(\frac{1}{2}\)Br2 + 3e– (ઑક્સિડેશન) E⊖ = 1.09
Au3+ 3e– → Au (રિડક્શન) E⊖ = 1.4V
Br– નો રિડક્શન પોટેન્શિયલ Au3+ ના કરતાં ઓછો છે, જેથી Br–નું ઑક્સિડેશન Au3+ વડે થાય. - (E) Au નિષ્ક્રિય ધાતુ છે, કારણ કે બધી જ ધાતુઓ તેનો E⊖ મહત્તમ છે.
- (F) Li+ ધાતુ આયન છે અને પ્રમાણિત (રિડક્શન) પોર્ટેન્શિયલ E⊖ લઘુતમ (-3.05V) છે. જેથી તે સૌથી નિર્બળ ઑક્સિડેશનકર્તા છે.
(G) F– ઋણ આયન છે, તેનું ઑક્સિડેશન F– → F2 માં થાય અને F– રિડક્શનકર્તા છે. તેનો E⊖ મહત્તમ (2.87V) હોવાથી તે સૌથી નિર્બળ રિડક્શનકર્તા છે.
![]()
વિધાન અને કારણ પ્રકારના પ્રશ્નો
નીચેના પ્રશ્નોમાં વિધાન (A) અને ત્યાર પછી કારણ (R) આપેલું છે. પ્રશ્નોની નીચે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરો.
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે.
(D) વિધાન (A) અને કારણ (R) બંને ખોટાં છે.
(E) વિધાન (A) ખોટું પરંતુ કારણ (R) સાચું છે.
પ્રશ્ન 1.
વિધાન (A) : હાઇડ્રોજન કરતાં કોપર ઓછું પ્રતિક્રિયાત્મક છે.
કારણ (R) : \(\mathbf{E}_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{\ominus}\) ઋણ છે.
જવાબ
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે.
- કૉપર માટે Cu2+/ Cu = 0.34V અને હાઇડ્રોજન માટે \(\mathrm{E}_{\mathrm{H}^{+} / \mathrm{H}_2}^{\ominus}\) 0.0V છે. આમ હોવાથી કૉપરની સ્થિરતા H2 ના કરતાં વધારે છે, Cu ની પ્રક્રિયા H+ ની સાથે થતી નથી.
- R : Cu2+ / Cu ઋણ નથી પણ ધન (+ 0.34V) છે, જેથી કારણ ખોટું છે.
પ્રશ્ન 2.
વિધાન (A) : કોષ કાર્યરત રહે તે માટે Ecell નું મૂલ્ય ધન હોવું જોઈએ.
કારણ (R) : Ecathode < Eanode
જવાબ
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે.
- કોઈપણ પ્રક્રિયા પુરોગામી થવા માટે -ΔG⊖ = nF \(\mathrm{E}_{\text {cell }}^{\ominus}\) આપ્યા પ્રમાણે Ecell ધન હોવાથી ΔG⊖ ઋણ થશે અને આથી પ્રક્રિયા પુરોગામી થાય, જેથી વિધાન (A) સાચું છે.
- (R) કારણ ખોટું છે. જો E(કૅથોડ) < E(ઍનોડ) હોય તો
Ecell = Eકૅથોડ < Eઍનોડ
= ઋણ થશે અને પ્રક્રિયા પુરોગામી થાય નહીં.
પ્રશ્ન 3.
વિધાન (A) : બધાં જ વિધુતવિભાજ્યોની વાહકતા મંદન કરતાં ઘટે છે.
કારણ (R) : મંદન કરતાં એકમ કદમાં રહેલાં આયનોની સંખ્યા ઘટે છે.
જવાબ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
વિદ્યુતવિભાજ્ય દ્રાવણની વાહકતા દ્રાવણના એકમ કદમાં રહેલા આયનોની સંખ્યા ઉપર આધાર રાખે છે. દ્રાવણનું મંદન કરવાથી એકમ કદમાં આયનોની સંખ્યા ઘટે છે, જેના કારણે દ્રાવણની વાહકતા ઘટે છે.
પ્રશ્ન 4.
વિધાન (A) : વિદ્યુતવિભાજનીય દ્રાવણને મંદ કરતાં નિર્બળ વિધુતવિભાજ્ય માટે ∧m તીવ્ર વધારો દર્શાવે છે.
કારણ (R) : દ્રાવણને મંદ કરવાથી નિર્બળ વિદ્યુતવિભાજ્યના વિયોજન અંશમાં વધારો થાય છે.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
- નિર્બળ વિદ્યુતવિભાજ્યની મોલ૨ વાહકતા (∧m) નું મૂલ્ય દ્રાવણનું મંદન કરવાથી વધે છે. નિર્બળ વિદ્યુતવિભાજ્યના દ્રાવણનું મંદન કરવાથી વિયોજન વધે છે.
- આયનોની સાંદ્રતા અને સંખ્યા વધે છે. જેથી વાહકતા તેમજ મોલ વાહકતા ∧m માં તીવ્ર વધારો થાય છે.
પ્રશ્ન 5.
વિધાન (A) : મરક્યુરી કોષ સ્થિર પોટેન્શિયલ આપતો નથી.
કારણ (R) : કોષપ્રક્રિયામાં, દ્રાવણમાં આયનો સંકળાયેલાં નથી.
જવાબ
(E) વિધાન (A) ખોટું પરંતુ કારણ (R) સાચું છે.
- મરક્યુરી કોષ સ્થાયી (અચળ) પોટેન્શિયલ આપે છે. તે સાચું વિધાન છે.
- કારણ (R) તે સાચું છે. મરક્યુરી કોષમાં પ્રક્રિયા દરમિયાન આયનો હોતા જ નથી. જેથી કોષ પોટૅન્શિયલ બદલાતો નથી અને સ્થાયી (અચળ) રહે છે.
![]()
પ્રશ્ન 6.
વિધાન (A) : NaClના દ્રાવણનું વિદ્યુતવિભાજન ઍનોડ પર O2ને બદલે ક્લોરિન આપે છે.
કારણ (R) : એનોડ પર ઑક્સિજન ઉદ્ભવવા માટે ઓવર વોલ્ટેજની જરૂર પડે છે.
જવાબ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
- NaCl ના દ્રાવણનું આયનીકરણ (NaCl → Na+ + Cl–) થવાથી ઍનોડ નજીક ઋણ આયનો Cl– તથા પાણી છે. જેમના ઑક્સિડેશનની પ્રક્રિયા નીચે આપી છે.
\(\mathrm{E}_{\text {cell }}^{\ominus}\) =1.36V; Cl–(aq) → \(\frac{1}{2}\) Cl2(g) + e– …(ઑક્સિડેશન)
અને \(\mathrm{E}_{\text {cell }}^{\ominus}\) = 1.23V H2O(l) → \(\frac{1}{2}\) O2(g) + 2e– + 2H+(aq) …(ઑક્સિડેશન) - જેથી પાણીના E⊖ નું મૂલ્ય ઓછું હોવાથી પાણીનું ઑક્સિડેશન થઈને O2 બનવો જોઈએ પણ O2 બનતો નથી. કારણ કે O2 બનવા માટે વધારે (ઓવર) પોટેન્શિયલ જરૂરી છે, જે હોતો નથી.
પ્રશ્ન 7
વિધાન (A) : આયનીય દ્રાવણનો અવરોધ માપવા AC સ્રોત વપરાય છે.
કારણ (R) : જો DC સ્રોત વાપરવામાં આવે તો આયનીય દ્રાવણની સાંદ્રતા બદલાઈ જાય છે.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
DC સ્રોતમાંથી DC પ્રવાહ વાપરવાથી રાસાયણિક પ્રક્રિયા થઈને આયનોની સાંદ્રતા બદલાય છે. અવરોધ માપવામાં આયનોની સાંદ્રતા અચળ રાખવી જરૂરી છે. જે માટે AC પ્રવાહ વપરાય છે. જેથી પ્રક્રિયા થાય નહીં અને અવરોધનું સાચું મૂલ્ય મળે છે.
પ્રશ્ન 8.
વિધાન (A) : જ્યારે Ecell = 0 થાય ત્યારે પ્રવાહ વહેતો બંધ થઈ જાય છે.
કારણ (R) : કોષપ્રક્રિયા સંતુલન પ્રાપ્ત કરે છે.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
જો Ecell = 0.0V થાય તો તે કોષમાં પ્રવાહ વહેતો નથી. કારણ કે કોષમાં પ્રક્રિયા થતી નથી અને સંતુલન સ્થિતિ રચાયેલી હોય છે.
પ્રશ્ન 9.
વિધાન (A) : Ag+ આયનોની સાંદ્રતા વધે તેમ \(\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}\) વધે છે.
કારણ (R) : \(\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}\) નુ મૂલ્ય ધન છે.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
Ag+ | Ag ના ધ્રુવના માટે : Ag+ + e– → Ag
Ecell = \(\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}\) – \(\frac{0.0591}{1}\) log10(\(\frac{1}{\left[\mathrm{Ag}^{+}\right]}\))
\(\mathrm{E}_{\mathrm{Ag}^{+} \mid \mathrm{Ag}}^{\ominus}\) + 0.0591 log [Ag+]
આથી [Ag+] વધે તો log[Ag+] માં વધારો થાય.
પ્રશ્ન 10.
વિધાન (A) : ઝિંકના પાત્રમાં કૉપર સલ્ફેટનો સંગ્રહ કરી શકાય.
કારણ (R) : કોપર કરતાં ઝિંક ઓછું પ્રતિક્રિયાત્મક છે.
જવાબ
(D) વિધાન (A) અને કારણ (B) બંને ખોટાં છે.
- Zn ના પાત્રમાં કૉપર સલ્ફેટને ભરીને રાખી શકાય નહીં. કારણ કે કૉપરના (+0.34V) કરતાં ઝિંકનો (0.76V) પોટેન્શિયલ ઓછો છે. ઝિંકની સાથે કૉપર આયન પ્રક્રિયા કરે છે.
Zn(s) + Cu2+ → Cu(s) + Zn2+ - કૉપર કરતાં ઝિંકની સક્રિયતા વધારે છે.
સવિસ્તર પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
આકૃતિ ધ્યાનમાં લો અને નીચેના પ્રશ્નોના ઉત્તર આપો :
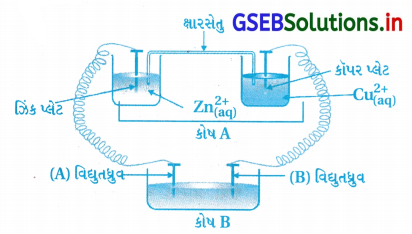
(i) કોષ ‘A નો Ecell = 2V અને કોષ ‘B’ નો Ecell = 1.1V છે.
બેમાંથી કયો કોષ ‘A’ કે ‘B’ વિધુતવિભાજનીય કોષ તરીકે વર્તશે ? આ કોષમાં કઈ ઇલેક્ટ્રોડ પ્રક્રિયા થશે ?
(ii) જો કોષ ‘A’ નો Ecell = 0.5V અને કોષ ‘B’ નો Ecell = 1.1 હોય, તો એનોડ અને કેથોડ પર કઈ પ્રક્રિયાઓ થશે ?
ઉત્તર:
- (i) કોષ B તે વિદ્યુતવિભાજન કોષ તરીકે વર્તશે.
(∵ કોષ A નો Ecell 2.0V > B નો Ecell 1.1V છે.)
∴ B કોષ વિદ્યુતવિભાજનીય કોષ તરીકે વર્તશે અને તેમાં Zn2+ નું રિડક્શન તથા Cu નું ઑક્સિડેશન થાય.
કૅથોડ ઉપર રિડક્શન : Zn2+ + 2e– → Zn
ઍનોડ ઉપર ઑક્સિડેશન : Cu → Cu2+ + 2e– - (ii) (કોષ A માટે Ecell = 0.5V) < (કોષ Bનો Ecell = 1.1V)
∴ B નો પોટૅન્શિયલ વધારે છે.
∴ B ગૅલ્વેનિક (વિદ્યુતરાસાયણિક) કોષ હશે. - જેથી B માંથી ઇલેક્ટ્રૉન A તરફ જશે. આ સ્થિતિમાં Zn ઍનોડ થશે અને તેનું ઑક્સિડેશન થશે.
Zn → Zn2+ + 2e– - વળી કૉપર કૅથોડ હશે અને કૉપર આયનોનું રિડક્શન થશે.
Cu2+ + 2e– → Cu
![]()
પ્રશ્ન 2.
આકૃતિને ધ્યાનમાં લો અને નીચેના (i) થી (vi) પ્રશ્નોના
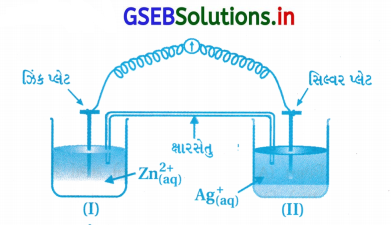
(i) ઇલેક્ટ્રોનના વહનની દિશા દર્શાવવા આકૃતિ ફરીથી દોરો.
(ii) સિલ્વર પ્લેટ ઍનોડ છે કે કેથોડ ?
(iii) જો ક્ષારસેતુ દૂર કરવામાં આવે તો શું થશે ?
(iv) કોષ કાર્ય કરતો બંધ ક્યારે થશે ?
(v) કોષ કાર્યરત હોય ત્યારે Zn2+ અને Ag+ આયનોની સાંદ્રતા શું અસર પામશે ?
(vi) કોષ ‘મૃત’ બને પછી Zn2+ અને Ag+ આયનોની સાંદ્રતા શું અસર પામશે ?
ઉત્તર:
(i) બાહ્ય પથમાં ઇલેક્ટ્રૉન પ્રવાહ Zn થી Ag ધ્રુવની દિશામાં વહેશે.
Zn → Zn2+ + 2e–
Zn2+ આયનો દ્રાવણમાં જાય અને ઇલેક્ટ્રૉન Znની પટ્ટી ઉપર આવશે તથા ત્યાંથી Ag ઉ૫૨ જશે. જ્યાં Ag+ આયનો ઇલેક્ટ્રૉન સ્વીકારી રિડક્શન પામી Ag(s) માં ફેરવાશે.

(ii) Agની પ્લેટ કૅથોડ છે, કારણ કે તેની પટ્ટી ઉપર Ag+ ઇલેક્ટ્રૉન
સ્વીકારીને રિડક્શન પામે છે.
Ag+ + e– → Ag, જેથી Ag કૅથોડ
(iii) ક્ષારસેતુ દૂર કરવાથી કોષ કાર્ય કરતો અટકી જાય છે, કારણ કે બે કોષ વચ્ચેનો વિદ્યુતમાર્ગ પૂર્ણ થતો નથી અને કોષ પોટૅન્શિયલ શૂન્ય થઈ જશે. પ્રક્રિયાઓ થતી નથી.
(iv) જો Ecell = 0 થાય તો કોષ કાર્ય કરતો બંધ થઈ જશે. એટલે કે કોષોમાં પ્રક્રિયા અટકી જાય તો કોષ કાર્ય કરતો નથી.
(v) કોષ કાર્ય કરતો હોય ત્યારે Zn2+ આયનો બનતા હોવાથી Zn2+ નું સાંદ્રણ વધતું જાય છે. વળી Ag+ આયનોનું રિડક્શન થતું હોવાથી Ag+ આયનો ઘટતા જાય છે.
(vi) જ્યારે આ કોષ મૃત થશે એટલે કે કાર્ય કરતો બંધ થઈ જશે.
– કોષનો પોર્ટેન્શિયલ = \(E_{\text {cell }}^O\) = 0.0V થશે.
– Zn2+ અને Ag+ની સાંદ્રતા બદલાશે નહીં.
– Zn નું ઑક્સિડેશન તથા Ag+ નું રિડક્શન થશે નહીં.
પ્રશ્ન 3.
ગેલ્વેનિક કોષમાં કોષપ્રક્રિયાની ગિબ્સ મુક્ત ઊર્જા તથા કોષના emf વચ્ચે શો સંબંધ છે ? ગેલ્વેનિક કોષોમાંથી ક્યારે મહત્તમ કાર્ય પ્રાપ્ત થઈ શકે ?
ઉત્તર:
- Ecell = \(E_{\text {cell }}^O\) અને ΔrGO = nF \(E_{\text {cell }}^O\)
= -Wmax
જો પ્રક્રિયા કરતા સ્પિસીઝોની સાંદ્રતા એકમ હોય તો
ΔrGO = પ્રક્રિયાની પ્રમાણિત ગિબ્સ મુક્તઊર્જા
\(\mathrm{E}_{\text {cell }}^{\ominus}\) = કોષનો પ્રમાણિત પોર્ટેન્શિયલ
nF = પસાર કરેલો વિદ્યુતજથ્થો - જો ગૅલ્વેનિક કોષમાંથી મહત્તમ કાર્ય મેળવવું હોય તો પ્રતિવર્તીપણે ગૅલ્વેનિક કોષમાંથી વિદ્યુતભાર પસાર કરવો પડે. ગૅલ્વેનિક કોષ વડે પ્રતિવર્તીપણે કરેલું કાર્ય, ગિબ્સઊર્જાના ઘટાડાના જેટલું હોય છે.
ΔrG = -nFEcell - Ecell માત્રાત્મક ગુણ છે, પણ ΔrG તે ગહન ઉષ્મીય ગુણ છે, n ઉપર આધાર રાખે છે.
દા.ત., Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) ના ગૅલ્વેનિક કોષ માટે n = 2 છે અને ΔrG = −2FEcell