This GSEB Class 9 Science Notes Chapter 4 પરમાણુનું બંધારણ covers all the important topics and concepts as mentioned in the chapter.
પરમાણુનું બંધારણ Class 9 GSEB Notes
→ જુદા જુદા પ્રકારનાં દ્રવ્યોનું અસ્તિત્વ તે દ્રવ્યોની રચના કરતાં જુદા જુદા પરમાણુઓને લીધે હોય છે.
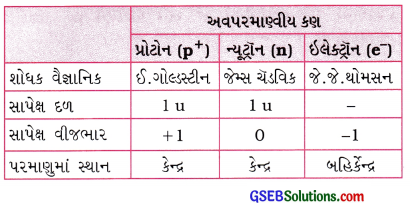
→ પરમાણુઓ અવિભાજ્ય નથી, તેનો સંકેત સ્થિર વિદ્યુત અને જુદા જુદા પદાર્થોની વિદ્યુતના વહનની પરિસ્થિતિનો અભ્યાસ પરથી મળ્યો.
→ ધન વીજભારિત વિકિરણોને કેનાલ કિરણો, જ્યારે ઋણ વીજભારિત વિકિરણોને કેથોડ કિરણો કહે છે.
→ થોમસનનો પરમાણુ નમૂનો (Thomson’s Model of an Atom) :
- પરમાણુ એ ધનભારિત ગોળો છે અને ઇલેક્ટ્રૉન તેમાં જડિત થયેલા છે.
- પરમાણુમાં ઋણ અને ધનભાર સમાન માત્રામાં હોય છે. તેથી પરમાણુ વીજભારની દષ્ટિએ તટસ્થ હોય છે.
→ રુથરફોર્ડનો પરમાણુ નમૂનો (Rutherford’s Model of an Atom) :
- પરમાણુમાં રહેલ ધનભારિત કેન્દ્રને પરમાણુકેન્દ્ર કહે છે. પરમાણુનું મોટા ભાગનું દળ તેના કેન્દ્રમાં સમાયેલું હોય છે.
- ઇલેક્ટ્રૉન કેન્દ્રની આસપાસ નિશ્ચિત કક્ષાઓમાં ભ્રમણ કરે છે.
- પરમાણુના કદની સાપેક્ષે તેના કેન્દ્રનું કદ ખૂબ જ સૂક્ષ્મ છે.
![]()
→ બોની પરમાણુ બંધારણ વિશેની અભિધારણાઓ :
- ઇલેક્ટ્રૉનની સ્વતંત્ર કક્ષાઓ પૈકી અમુક ચોક્કસ કક્ષાઓને માન્ય કક્ષાઓ કહે છે.
- સ્વતંત્ર (માન્ય) કક્ષાઓમાં પરિભ્રમણ દરમિયાન ઇલેક્ટ્રૉન વિકિરણ સ્વરૂપે ઊર્જામુક્ત કરતા નથી.
- કક્ષાઓ અથવા કોશને ઊર્જાસ્તર કહે છે.
→ જુદા જુદા ઊર્જાસ્તર (કોશ)માં ઇલેક્ટ્રૉનની સંખ્યા દર્શાવવા માટેના નિયમો :
- કોઈ પણ કક્ષામાં રહેલા મહત્તમ ઇલેક્ટ્રૉનની સંખ્યા = 2n2 જ્યાં, n = કક્ષાનો ક્રમ.
- સૌથી બહારની કક્ષામાં મહત્તમ 8 ઈલેક્ટ્રૉન સમાવી શકાય છે.
- પરમાણુની અંદરની કક્ષા જ્યાં સુધી ઇલેક્ટ્રૉનથી સંપૂર્ણ ના ભરાય ત્યાં સુધી બહારની કક્ષામાં ઇલેક્ટ્રૉન દાખલ કરી શકાય નહિ.
- પ્રથમ કક્ષા સિવાયની કક્ષાઓમાં ગૌણ (પેટા) કક્ષાઓ હોય છે, જેને કક્ષક કહે છે.
→ સંયોજકતા (Valency) : દરેક તત્ત્વના પરમાણુની અન્ય તત્ત્વ સાથે સંયોજાવાની નિશ્ચિત ક્ષમતાને સંયોજકતા કહે છે.
→ પરમાણ્વીય ક્રમાંક (Atomic Number –Z) : તત્ત્વના તટસ્થ પરમાણુમાં રહેલા પ્રોટોન અથવા ઇલેક્ટ્રૉનની સંખ્યાને પરમાવીય ક્રમાંક કહે છે.
Z = પ્રોટોનની સંખ્યા
= તટસ્થ પરમાણુમાં ઇલેક્ટ્રૉનની સંખ્યા
→ દળાંક (Mass Number – A) તત્ત્વના પરમાણુકેન્દ્રમાં રહેલા પ્રોટોન (p) અને ન્યૂટ્રૉન (n)ની કુલ સંખ્યાના સરવાળાને દળાંક કહે છે.
A = p + n
અથવા
A = 2 + n
પ્રોટોન અને ન્યૂટ્રૉનને ન્યુક્લિન્સ કહે છે.
→ કોઈ પણ પરમાણુને દર્શાવવા માટે તેના પરમાણ્વીય ક્રમાંક, દળાંક અને તત્ત્વની સંજ્ઞાને નીચે મુજબ દર્શાવી શકાય : દળાંક

દા. ત., 714N ને નાઇટ્રોજન પરમાણુનું ન્યુક્લિઇડ્ઝ કહે છે.
→ સંયોજકતા ઇલેક્ટ્રૉન અને સંયોજકતા (Valence Electrons and valency) : તત્ત્વના પરમાણુની સૌથી બહારની કક્ષામાં રહેલા ઇલેક્ટ્રૉનને સંયોજકતા ઇલેક્ટ્રૉન કહે છે અને તે કક્ષાને સંયોજકતા કક્ષા કહે છે. • સંયોજકતા કક્ષામાંના અમુશ્મિત ઇલેક્ટ્રૉનની સંખ્યાને તે પરમાણુની સંયોજકતા કહે છે.
→ સમસ્થાનિકો (Isotopes) : એક જ તત્ત્વના જુદા જુદા પરમાણુઓ કે જેમના દળાંક અસમાન હોય પણ પરમાણ્વીય ક્રમાંક સમાન હોય, તો તેવા પરમાણુઓને એકબીજાના સમસ્થાનિકો કહે છે. દા. ત., Hના ત્રણ સમસ્થાનિકો છેઃ 11H (બોટિયમ). 12H (વટેરિયમ) અને 13H (ટ્રિટિયમ)
![]()
→ સમદળીય (Isobars) : જુદાં જુદાં તત્ત્વોના પરમાણ્વીય ક્રમાંક અસમાન હોય છે. પરંતુ જો તેમના દળાંક સમાન હોય, તો તેવા પરમાણુઓને એકબીજાના સમદળીય (આઇસોબાર) કહે છે. દા. ત., આર્ગોન (Ar), પોટેશિયમ (K) અને કૅલ્શિયમ(Ca)ના પરમાણ્વીય ક્રમાંક અનુક્રમે 18, 19 અને 20 છે, એટલે કે જુદા જુદા છે; પરંતુ તેમના દળાંક 40 છે, એટલે કે સમાન છે. આમ, 1840Ar, 1940K અને 2040ca સમદળીય પરમાણુઓ છે.