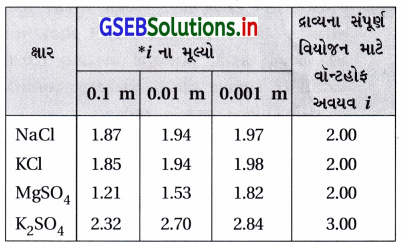
Gujarat Board GSEB Textbook Solutions Class 12 Chemistry Chapter 2 દ્રાવણો Textbook Questions and Answers.
Gujarat Board Textbook Solutions Class 12 Chemistry Chapter 2 દ્રાવણો
GSEB Class 12 Chemistry દ્રાવણો Text Book Questions and Answers
પ્રશ્ન 1.
દ્રાવણ – પર્યાયની વ્યાખ્યા આપો. કેટલા પ્રકારના દ્રાવણો બની શકે છે ? દરેક વિશે ઉદાહરણસહ ટૂંકમાં સાથે લખો.
ઉત્તર:
- દ્રાવક : સમાંગ મિશ્રણમાં જે ઘટક સૌથી વધારે પ્રમાણમાં હોય તે દ્રાવક તરીકે ઓળખાય છે.
- દ્રાવ્યો : દ્રાવક સિવાયના એક અથવા વધારે ઘટકો જે દ્રાવણમાં હાજર હોય છે, તેમને દ્રાવ્યો કહે છે.
- દ્રાવણ : બે કે તેથી વધુ પદાર્થોના એકરૂપ મિશ્રણને દ્રાવણ કહે છે.
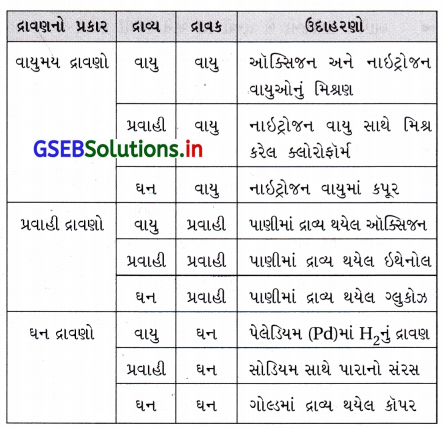
પ્રશ્ન 2.
એક એવા ઘન દ્રાવણનું ઉદાહરણ આપો જેમાં દ્રાવ્ય વાયુ હોય.
ઉત્તર:
પેલેડિયમમાં હાઇડ્રોજનનું દ્રાવણ
પ્રશ્ન 3.
નીચેના પર્યાયોને વ્યાખ્યાયિત કરો :
(i) મોલ અંશ
(ii) મોલાલિટી
(iii) મોલારિટી
(iv) દળ ટકાવારી
ઉત્તર:
(i) મોલ અંશ : દ્રાવણમાં રહેલા કોઈ એક ઘટકના મોલની સંખ્યા અને કુલ મોલની સંખ્યાના ગુણોત્તરને મોલ અંશ કહે છે.

ઘટકના મોલની સંખ્યા બધા જ ઘટકોના મોલની કુલ સંખ્યા ઉદાહરણ તરીકે, એક દ્વિઅંગી મિશ્રણમાં જો Aની મોલ સંખ્યા અને Bની મોલ સંખ્યા અનુક્રમે nA અને nB હોય તો Aનો મોલ અંશ અને Bનો મોલ અંશ xA અને XB થશે.
xA = \(\frac{n_{\mathrm{A}}}{n_{\mathrm{A}}+n_{\mathrm{B}}}\); xB = \(\frac{n_{\mathrm{B}}}{n_{\mathrm{A}}+n_{\mathrm{B}}}\)
આપેલા દ્રાવણમાં રહેલા બધા જ ઘટકોના મોલ અંશનો સરવાળો 1 થાય છે.
(ii) મોલાલિટી : એક કિલોગ્રામ દ્રાવકમાં ઓગળેલા દ્રાવ્યના મોલની સંખ્યાને મોલાલિટી કહે છે.

(iii) મોલારિટી (M) : એક લિટર દ્રાવણમાં ઓગળેલા દ્રાવ્યના મોલની સંખ્યાને મોલારિટી કહે છે.

(iv) દળ ટકાવારી (w/w %) : 100 ગ્રામ દ્રાવણમાં રહેલા દ્રાવ્યના વજનના દળની ટકાવારી કહે છે.

પ્રશ્ન 4.
પ્રયોગશાળા કાર્યમાં વપરાતો સાંદ્ર નાઇટ્રિક એસિડ દળથી 68% નાઇટ્રિક એસિડ તરીકે જલીય દ્રાવણમાં છે. જો દ્રાવણની ઘનતા 1.504g mL-1 હોય, તો ઍસિડના આવા નમૂનાની મોલારિટી કેટલી હશે ?
ઉત્તર:
68 % દળથી HNO3 એટલે,
HNO3 (નાઇટ્રિક ઍસિડ)નું દળ = 68 ગ્રામ
દ્રાવણનું દળ = 100 ગ્રામ
HNO3 નો અણુભાર = 63 ગ્રામ/મોલ

પ્રશ્ન 5.
પાણીમાં ગ્લુકોઝના દ્રાવણ પર 10% w/w એમ લેબલ લગાવેલું છે, તો દ્રાવણની મોલાલિટી અને દરેક ઘટકનો મોલ અંશ કેટલો હશે ? જો દ્રાવણની ઘનતા 1.2 g mL-1 હોય, તો દ્વાવણની મોલારિટી કેટલી થશે ?
ઉત્તર:
- 10 % w/w એટલે
ગ્લુકોઝનું દળ = 10 ગ્રામ
દ્રાવણોનું દળ = 100 ગ્રામ
દ્રાવકનું દળ = 100 – 10 = 90 ગ્રામ
= 0.09 kg
ગ્લુકોઝનો અણુભાર = 180 ગ્રામ/મોલ

- મોલ અંશની ગણતરી :
ગ્લુકોઝના મોલ = \(\frac{10}{180}\) = 0.055 મોલ
પાણીના મોલ = \(\frac{90}{18}\) = 5.0 મોલ
ગ્લુકોઝના મોલ અંશ = \(\frac{0.055}{0.055+5.0}\) = 0.01
પાણીના મોલ અંશ = \(\frac{5.0}{0.055+5.0}\) = 0.99 - મોલારિટીની ગણતરી :

![]()
પ્રશ્ન 6.
Na2CO3 અને NaHCO3 બંને પદાર્થોનો સમમોલર જથ્થો ધરાવતા 1 g મિશ્રણને સંપૂર્ણપણે પ્રક્રિયા કરવા માટે 0.1 M HClના કેટલા mLની જરૂર પડશે ?
ઉત્તર:
- Na2CO3 અને NaHCO3ના દળની ગણતરી :
મિશ્રણનું દળ = 1.0 ગ્રામ
Na2CO3 નું દળ = x ગ્રામ
NaHCO3 નું દળ = (1 – x) ગ્રામ

Na2CO3ના મોલ = NaHCO3ના મોલ
\(\frac{x}{106}=\frac{(1-x)}{84}\)
∴ 84x = 106 – 106 x
∴ 190 x = 106
∴ x = 0.558 ગ્રામ
∴ NaHCO3નું કુલ દળ = 1 − 0.558 = 0.442 ગ્રામ
- HCl ના દળની ગણતરી :
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
∴ 106 ગ્રામ Na2CO3ની સંપૂર્ણ પ્રક્રિયા માટે 73 ગ્રામ HCl જરૂરી છે.
∴ 0.558 ગ્રામ Na2CO3 માટે (?)
= \(\frac{73 \times 0.558}{106}\)
= 0.384 ગ્રામ - NaHCO3 + HCl → NaCl + H2O + CO2
∴ 84 ગ્રામ NaHCO3 માટે 36.5 ગ્રામ HCl જરૂરી છે.
∴ 0.442 ગ્રામ NaHCO3 = \(\frac{36.5 \times 0.442}{84}\)
= 0.192 ગ્રામ
∴ HCl નું કુલ દળ = (0.384 + 0.192) = 0.576 ગ્રામ - જરૂરી HCl નું કદ :

∴ V = 0.1578 લિટર
પ્રશ્ન 7.
દળથી 25% દ્રાવણના 300g અને 40% દ્રાવણના દળથી 400g મિશ્ર કરીને એક દ્રાવણ બનાવવામાં આવ્યું. પરિણમતા દ્રાવણના દળની ટકાવારી ગણો.
ઉત્તર:
દ્રાવણ-1 માં દ્રાવણનું દળ = \(\frac{25}{100}\) × 300 = 75 ગ્રામ
દ્રાવણ-2 માં દ્રાવણનું દળ = \(\frac{40}{100}\) × 400 = 160 ગ્રામ
બંને દ્રાવણોને મિશ્ર કર્યા પછી;
દ્રાવ્યનું કુલ દળ = (75 + 160) = 235 ગ્રામ
દ્રાવણનું કુલ દળ = 300 + 400 = 700 ગ્રામ
– અંતિમ દ્રાવણમાં દ્રાવ્યના દળથી % = \(\frac{235}{700}\) × 100
= 33.57 %
– અંતિમ દ્રાવણમાં દ્રાવકના દળથી % = 100 – 33.57
= 66.43 %
પ્રશ્ન 8.
એક પ્રતિહીમ (antifreeze) દ્રાવણ 222.6g ઈથીલીન ગ્લાયકોલ (C2H6O2) અને 200g પાણી મિશ્ર કરી બનાવવામાં આવ્યું. દ્રાવણની મોલાલિટી ગણો. જો દ્રાવણની ઘનતા 1.072g mL-1 હોય, તો દ્રાવણની મોલારિટી કેટલી થશે ?
ઉત્તર:
(i) દ્રાવણની મોલાલિટી શોધવી :
ઈથીલીન ગ્લાયકોલનું દળ = 222.6 ગ્રામ
ઈથીલીન ગ્લાયકોલનો અણુભાર = 62 ગ્રામ/મોલ
પાણીનું દળ = 0.2 kg
m = \(\frac{222.6}{62 \times 0.2}\)
= 17.95 મોલ/kg
(ii) દ્રાવણની મોલારિટી શોધવી :
દ્રાવણની ઘનતા = 1.072 ગ્રામ/મિલિ
દ્રાવણનું દળ = દ્રાવ્યનું દળ + દ્રાવણનું દળ
= 222.6+ 200
= 422.6 ગ્રામ

પ્રશ્ન 9.
પીવાના પાણીનો એક નમૂનો ખૂબ જ ખરાબ રીતે ક્લૉરોફૉર્મ (CHCl3) વડે સંદૂષિત થયેલો જણાયો છે જેને કેન્સરજન્ય ધારવામાં આવ્યો છે. સંદૂષણનું સ્તર (પ્રમાણ) 15ppm (દળથી) જણાયું છે.
(i) આને દળથી ટકાવારીમાં દર્શાવો.
(ii) પાણીના નમૂનામાં ક્લૉરોફૉર્મની મોલાલિટી નક્કી કરો.
ઉત્તર:

પ્રશ્ન 10.
આલ્કોહોલ અને પાણીના દ્રાવણમાં આણ્વીય પારસ્પરિક ક્રિયા શું ભાગ ભજવે છે ?
ઉત્તર:
આલ્કોહૉલ અને પાણીના અણુઓ વચ્ચે H બંધ અસ્તિત્વ ધરાવે છે. જ્યારે આલ્કોહૉલ અને પાણીને મિશ્ર કરવામાં આવે છે. ત્યારે નવા H બંધ આલ્કોહૉલ અને પાણીના અણુઓ વચ્ચે બને છે પરંતુ આ H બંધની પ્રબળતા એક જ પ્રકારના અણુઓ વચ્ચેના H બંધ કરતાં ઓછી હોય છે, આથી આ દ્રાવણ રાઉલ્ટના નિયમથી ધનવિચલન દર્શાવે છે. જે દ્રાવણના બાષ્પદબાણમાં વધારો કરે છે અને ઉત્કલનબિંદુમાં ઘટાડો કરે છે.
![]()
પ્રશ્ન 11.
શા માટે વાયુઓ હંમેશાં જેમ તાપમાન વધારવામાં આવે છે તેમ પ્રવાહીમાં ઓછા દ્રાવ્ય થવાનું વલણ ધરાવે છે ?
ઉત્તર:
- વાયુ + પ્રવાહી
 ઓગળેલ વાયુ ΔH = -ve
ઓગળેલ વાયુ ΔH = -ve - વાયુનું ઓગળવું એ ઉષ્માક્ષેપક પ્રક્રિયા છે. જો તાપમાન વધારવામાં આવે તો સંતુલન પ્રતિગામી દિશામાં આગળ વધે છે. પરિણામે વાયુની પ્રવાહીમાં દ્રાવ્યતા ઘટે છે.
પ્રશ્ન 12.
હેન્રીના નિયમનું નિવેદન કરો અને તેના કેટલાક અગત્યના અનુપ્રયોગ (applications) જણાવો.
ઉત્તર:
- હેન્રી નામના વૈજ્ઞાનિકે નિયમ રજૂ કર્યો કે અચળ તાપમાને પ્રવાહીમાં વાયુની દ્રાવ્યતા દ્રાવણની સપાટી પર રહેલા વાયુના આંશિક દબાણના સમપ્રમાણમાં હોય છે.
- સમકાલીન ડાલ્ટને તારવ્યું કે જો આપણે દ્રાવણમાંના વાયુના મોલ અંશનો ઉપયોગ માપન તરીકે કરીએ તો કહી શકાય કે દ્રાવણમાંના વાયુના મોલ અંશ દ્રાવણ ઉપરના વાયુના આંશિક દબાણને સમપ્રમાણમાં હોય છે.
- સામાન્ય રીતે “બાષ્પકલામાં વાયુનું આંશિક દબાણ (p) દ્રાવણમાંના વાયુના મોલ અંશ (x) ને સમપ્રમાણમાં છે.”
P = KH · x જ્યાં, KH = હેન્રી નિયમનો અચળાંક - જો વાયુના આંશિક દબાણ વિરુદ્ધ મોલ અંશનો આલેખ દોરીએ તો સીધી રેખા મળશે.
- સમાન તાપમાને જુદા જુદા વાયુઓને KH ના મૂલ્યો જુદા જુદા હોય છે. આથી કહી શકાય કે KH એ વાયુના સ્વભાવ પર આધારિત છે.
- આપેલ દબાણે KH નું મૂલ્ય વધે તો દ્રાવ્યતા ઘટે છે. આથી કહી શકાય કે તાપમાન વધે તેમ KH વધે છે અને દ્રાવ્યતા ઘટે છે.
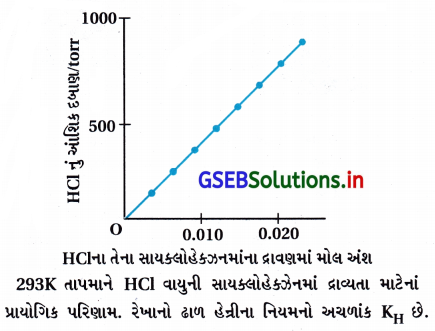
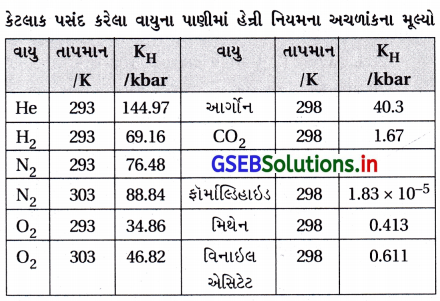
- જળચર સ્પિસીઝ ગરમ પાણી કરતાં ઠંડા પાણીમાં વધુ સગવડપૂર્વક રહે છે.
- ઉપયોગિતા : હળવા પીણાં અને સોડાવૉટરમાં CO2 ની સાંદ્રતા વધારવા માટે બૉટલને ઊંચા દબાણ હેઠળ બંધ કરવામાં આવે છે.
- સ્કુબા (scuba) ડાઈવર અંતર્જલ (underwater)માં ઊંચા દબાણે શ્વસન કરે ત્યારે દબાણનો વધારો લોહીમાં વાતાવરણીય વાયુઓની દ્રાવ્યતા વધારે છે. જ્યારે મરજીવા સપાટી પર આવે છે ત્યારે દબાણ ધીમે ધીમે ઘટે છે. આ ઓગળેલા વાયુને મુક્ત કરે છે અને લોહીમાં N2ના પરપોટા પેદા કરે છે. જે કેશનળીને બંધ (block) કરે છે. આ સ્થિતિને બૅન્ડ્સ (bends) કહે છે જે પીડાકારી અને જીવનને ભયરૂપ હોય છે.
- આવા બૅન્ડ્સને દૂર કરવા સ્કૂબા મરજીવા હિલિયમ વડે મંદ કરેલી હવા (11.7 % હિલિયમ, 56.2 % N2 અને 32.1 % O2) ભરેલી ટાંકીઓનો ઉપયોગ કરે છે.
- વધુ ઊંચાઈએ O2નું આંશિક દબાણ ઓછું હોય છે. તેથી પર્વતારોહકોના લોહી અને ઉત્તક(પેશીઓમાં) O2ની ઓછી સાંદ્રતાને લીધે નબળા બનવા, સ્પષ્ટ રીતે વિચારી નહિ શકવાના કારણરૂપ બને છે જે એનોક્સિયા બીમારી તરીકે ઓળખાય છે.
પ્રશ્ન 13.
6.56 × 10-3 g ઇથેન ધરાવતા દ્રાવણનું આંશિક બાષ્પદબાણ દ્રાવણની ઉપર 1 bar છે. જો દ્રાવણ 5.00 × 10-2 g ઇથેન ધરાવતું હોય, તો વાયુનું આંશિક દબાણ કેટલું થશે ?
ઉત્તર:
હેન્રીના નિયમ મુજબ,
દ્રાવણમાં ઓગળેલ વાયુનું દળ ∝ આંશિક દબાણ
6.56 × 10-3 ગ્રામ × 1 બાર
∴ 6.56 × 10-3 ગ્રામ = KH × 1 બાર
5.00 × 10-2 ગ્રામ = KH × p
6.56 × 10-3
∴ KH = \(\frac{6.56 \times 10^{-3}}{1}\)
∴ KH = \(\frac{5.00 \times 10^{-2}}{p}\)
∴ \(\frac{6.56 \times 10^{-3}}{1}=\frac{5.00 \times 10^{-2}}{p}\)
∴ p = 7.621 બાર
પ્રશ્ન 14.
રાઉલ્ટના નિયમથી ધન અને ઋણ વિચલનનો અર્થ શું થાય છે અને રાઉલ્ટના નિયમથી થતાં ધન અને ઋણ વિચલન Amix H ની સંજ્ઞા સાથે કેવી રીતે સંબંધિત છે ?
ઉત્તર:
- જયારે દ્રાવણો સાંદ્રતાના સમગ્ર ગાળા દરમિયાન રાઉલ્ટના નિયમનું પાલન કરતા નથી ત્યારે તેને બિનઆદર્શ દ્રાવણ કહે છે.
- આવા દ્રાવણના બાષ્પદબાણ રાઉલ્ટના નિયમ પ્રમાણે અનુમાનિત કરેલા બાષ્પદબાણ કરતાં વધારે અથવા ઓછું હોય છે. જો તે વધારે હોય તો દ્રાવણ ધન વિચલન દર્શાવે છે અને જો ઓછું હોય તો, રાઉલ્ટના નિયમથી ઋણ વિચલન દર્શાવે છે.
- ધન વિચલન :
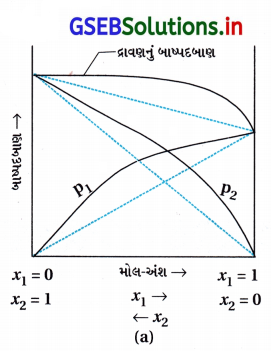
- રાઉલ્ટના નિયમથી ધન વિચલનની બાબતમાં A-B પારસ્પરિક ક્રિયાઓ A-A અથવા B-B કરતાં નબળી હોય છે. આ કિસ્સામાં આવા દ્રાવણોમાં A અથવા B ના અણુઓ શુદ્ધ અવસ્થા કરતાં વધુ સરળતાથી છટકી શકશે. આ બાષ્પદબાણમાં વધારો કરશે અને ધન વિચલનમાં પરિણમશે.
ઉદાહરણ : ઇથેનોલ અને એસિટોન - શુદ્ધ ઇથેનોલમાં અણુઓ હાઇડ્રોજન બંધિત હોય છે તેમાં એસિટોન ઉમેરવાથી તેના અણુઓ યજમાનની વચ્ચે ગોઠવાય છે અને તેમની વચ્ચેના H બંધ તોડી નાખે છે. પારસ્પરિક ક્રિયા નબળી થવાના લીધે દ્રાવણ ધન વિચલન દર્શાવે છે. અન્ય ઉદાહરણમાં CS2 અને એસિટોન
- ઋણ વિચલન :
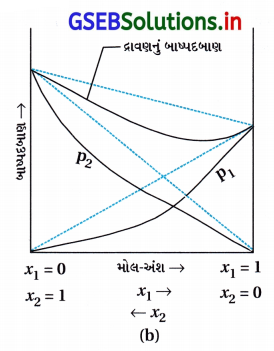
- રાઉલ્ટના નિયમથી ઋણ વિચલનની બાબતમાં A-A અને B-B વચ્ચેના આંતરઆણ્વીય આકર્ષણ બળો A-B વચ્ચેના આંતર આણ્વીય આકર્ષણ બળો કરતાં વધુ નિર્બળ હોય છે જેને લીધે બાષ્પદબાણમાં ઘટાડો થાય છે અને ઋણ વિચલન થાય છે.
ઉદા. (i) ફિનૉલ અને એનિલિન, આ કિસ્સામાં ફિનોલિક પ્રોટૉન અને એનિલિનના નાઇટ્રોજનના અયુમ્મિત હૈં યુગ્મ વચ્ચેના આંતરઆણ્વીય હાઇડ્રોજન બંધ, એક જ પ્રકારના અણુઓ વચ્ચેના આંતરઆણ્વીય H બંધ કરતાં વધુ પ્રબળ હોય છે.
ઉદા. (ii) ક્લોરોફૉર્મ અને એસિટોન. આ સ્સિામાં ક્લોરોફૉર્મ એસિટોન અણુ સાથે H બંધ રચી શકે છે જે નીચે દર્શાવેલ છે :

- આ દરેક ઘટકના અણુઓનું છટકી જવાનું વલણ ઘટાડે છે જેથી બાષ્પદબાણ ઘટે છે અને રાઉલ્ટના નિયમથી ઋણ વિચલન દર્શાવે છે.
પ્રશ્ન 15.
2% અબાષ્પશીલ દ્રાવ્ય ધરાવતું જલીય દ્રાવણ સામાન્ય ઉત્કલનબિંદુએ 1.004 bar દબાણ કરે છે. દ્રાવ્યનું મોલર દળ કેટલું હશે ?
ઉત્તર:
- પાણીનું બાષ્પદબાણ (p0) = 1.013 બાર
દ્રાવણનું બાષ્પદબાણ (pS) = 1.004 બાર
દ્રાવ્યનું દળ (W2) = 2 ગ્રામ
દ્રાવકનું અણુભાર (M1) = 18 ગ્રામ
દ્રાવકનું દળ (W1) = 98 ગ્રામ
દ્રાવણનું દળ = 100 ગ્રામ - રાઉલ્ટના નિયમ મુજબ,

![]()
પ્રશ્ન 16.
હેપ્ટન અને ઓન આદર્શ દ્રાવણ બનાવે છે. 373 K તાપમાને બંને પ્રવાહી ઘટકોના બાષ્પદબાણ અનુક્રમે 105.2 kPa અને 46.8 kPa છે. 26.0g હેપ્ટન અને 358 ઓક્ટેન ધરાવતા મિશ્રણનું બાષ્પદબાણ કેટલું થશે ?
ઉત્તર:
- હેપ્ટનનો અણુભાર = 100 ગ્રામ/મોલ
ઓક્લેનનો અણુભાર = 114 ગ્રામ/મોલ
હેપ્ટનના મોલ = \(\frac{26}{100}\) = 0.26
ઓક્લેનના મોલ = \(\frac{35}{114}\) = 0.307
હેપ્ટનના મોલ અંશ = \(\frac{0.26}{0.26+0.307}\) = 0.458
ઓક્ટેનના મોલ અંશ = (1 – 0.458) = 0.542 - હેપ્ટનનું બાષ્પદબાણ p0 × મોલ અંશ (હેપ્ટન)
= 105.2 kPa × 0.458
= 48.18 kPa - ઓક્લેનનું બાષ્પદબાણ = p0 × મોલ અંશ (ઓક્ટેન)
= 46.8 kPa × 0.541
= 25.32 kPa
∴ મિશ્રણનું કુલ બાષ્પદબાણ = 48.18 + 25.32
= 73.54 kPa
પ્રશ્ન 17.
પાણીનું બાષ્પદબાણ 300 K તાપમાને 12.3 kPa છે. તેના અબાષ્પશીલ દ્રાવ્યના 1 મોલલ દ્રાવણ માટે બાષ્પદબાણ ગણો.
ઉત્તર:
- પાણીના મોલ = \(\frac{1000}{18}\) = 55.55
દ્રાવ્યના મોલ = 1 - દ્રાવ્યના મોલ અંશ = \(\frac{1}{1+55.55}\) = 0.0177
હવે \(\frac{p^0-p_{\mathrm{s}}}{p^0}\) = x2
∴ \(\frac{12.3-p_s}{12.3}\) = 0.0177
∴ Ps = 12.08 kPa
પ્રશ્ન 18.
અબાષ્પશીલ દ્રાવ્ય (મોલર દળ 40 g mol-1) નું દળ ગણો જેને 114 g ઓક્લેનમાં ઓગાળવામાં આવે, તો બાષ્પદબાણ 80% જેટલું ઘટી જાય.
ઉત્તર:

∴ 0.2w + 8 = W
∴ 8 = w (1 – 0.2)
∴ 8 = 0.8 w
∴ w = 10 ગ્રામ
પ્રશ્ન 19.
90 g પાણીમાં 30 g અબાષ્પશીલ દ્રાવ્ય ધરાવતા દ્રાવણનું 298 K તાપમાને બાષ્પદબાણ 2.8 kPa છે. આગળ જતાં 18 g પાણી દ્રાવણમાં ઉમેરવામાં આવ્યું અને નવું બાષ્પદબાણ 298 K તાપમાને 2.9 kPa થયું.
ગણતરી કરો :
(i) દ્રાવ્યનું મોલર દળ
(ii) 298 K તાપમાને પાણીનું બાષ્પદબાણ
ઉત્તર:
(i) દ્રાવ્યના મોલ n2 = \(\frac{30}{\mathrm{M}}\) mol
દ્રાવક (પાણી)ના મોલ n1 = \(\frac{90}{18}\) = 5 mol
P1 = 2.8 kPa
\(\frac{p_1^0-p_1}{p_1^0}=\frac{n_2}{n_1+n_2}\)

2.9 × 5 × (6M + 30) = 2.8 × 6 × (5M + 30)
87 M + 435 = 84 M + 504
3 M = 69
∴ M = 23
(ii) M = 23 ની કિંમત સમી. (i) માં મૂકતાં;
\(\frac{p_1^0}{2.8}=\frac{5 \times 23+30}{5 \times 23}\)
∴ \(\frac{p_1^0}{2.8}=\frac{145}{115}\) ∴ \(p_1^0\) = 3.53 kPa
પ્રશ્ન 20.
ખાંડના 5% દ્રાવણ (દળથી)નું ઠારબિંદુ 271 K છે. જો શુદ્ધ પાણીનું ઠારબિંદુ 273.15 K હોય, તો પાણીમાં 5% ગ્લુકોઝ ધરાવતા દ્રાવણનું ઠારબિંદુ ગણો.
ઉત્તર:
- ΔTf = (273.15 – 271) K = 2.15 K
ખાંડના મોલ = \(\frac{5}{342}\) = 0.0146
∴ m = \(\frac{0.0146}{0.095}\) = 0.1537 મોલ/kg
ΔTf = Kf m
Kf = \(\frac{\Delta \mathrm{T}_{\mathrm{f}}}{\mathrm{m}}=\frac{2.15}{0.1537}\) = 13.99 K kg/mol - ગ્લુકોઝના મોલ = \(\frac{5}{180}\) = 0.0278
∴ m = \(\frac{0.0278}{0.095}\) = 0.2926 મોલ/kg
ΔTf = Kf m
13.99 × 0.2926 = 4.09 K - તેથી, 5% ગ્લુકોઝના દ્રાવણનું ઠારબિંદુ = (273.15 – 4.09)
= 269.06 K
![]()
પ્રશ્ન 21.
બે તત્ત્વો A અને B, AB2 અને AB4 સૂત્ર ધરાવતા સંયોજનો બનાવે છે. તેમને 20g બેન્ઝિન (C6H6)માં ઓગાળતાં AB2નો 1g ઠારબિંદુમાં 2.3K નો ઘટાડો કરે છે જ્યારે AB4 નો 1g 1.3K નો ઘટાડો કરે છે. બેન્ઝિનનો મોલલ અવનયન અચળાંક 5.1Kkg mol-1 છે. A અને B ના પરમાણ્વીય દળ ગણો. [માર્ચ-2020]
ઉત્તર:
- AB2 સંયોજન માટે; MAB2 = \(\frac{1000 \times \mathrm{w}_2 \times \mathrm{K}_{\mathrm{f}}}{\Delta \mathrm{T}_{\mathrm{f}} \times \mathrm{w}_1}\)
= \(\frac{1000 \times 1 \times 5.1}{2.3 \times 20}\)
= 110.87 ગ્રામ/મોલ - AB4 સંયોજન માટે; MAB4 = \(\frac{1000 \times 1 \times 5.1}{1.3 \times 20}\)
= 196.15 ગ્રામ/મોલ - હવે A અને B ના પરમાણુભારની ગણતરી માટે,
A તત્ત્વનો પરમાણુભાર = x
B તત્ત્વનો પરમાણુભાર = y
∴ AB2 નો અણુભાર = x + 2y = 110.87 ………….. (i)
AB4 નો અણુભાર = x + 4y = 196.15 ……………. (ii)
સમી. (ii) માંથી (i) બાદ કરતાં,
x + 4y – x – 2y = 196.15 = 110.87
2y = 85.28
∴ y = 42.64 ગ્રામ / મોલ
y ની કિંમત સમી. (i) માં મૂકતાં,
x + 2y = 110.87
x + 2(42.64) = 110.87
x = +25.59 ગ્રામ / મોલ
પ્રશ્ન 22.
300 K તાપમાને 36g ગ્લુકોઝ ધરાવતા તેના દ્રાવણનું અભિસરણ દબાણ 4.98 bar છે. જો તે જ તાપમાને કોઈ દ્રાવણનું અભિસરણ દબાણ 1.52 bar હોય તો તેની સાંદ્રતા કેટલી હશે ?
ઉત્તર:
- T = 300 K
π = 1.52 બાર
R =0.08314 બાર લિટર/મોલ કૅલ્વિન - π = CRT
∴ C = \(\frac{1.52}{0.08314 \times 300}\) = 0.061
પ્રશ્ન 23.
નીચેની જોડમાં સૌથી અગત્યના પ્રકારની આંતરઆણ્વીય આકર્ષણીય પારસ્પરિકતા (આંતરક્રિયા) સૂચવો :
(i) n-હેક્ઝેન અને n-ઓફ્ટેન
(ii) I2 અને CCl4
(iii) NaClO4 અને પાણી
(iv) મિથેનોલ અને એસિટોન
(v) એસિટોનાઇટ્રાઇલ (CH3CN) અને એસિટોન (C3H6O)
ઉત્તર:
(i) લંડન બળ
(ii) લંડન બળ
(iii) આયન દ્વિધ્રુવીય આંતરક્રિયા
(iv) આંતરઆણ્વિય H બંધ
(v) ધ્રુિવ-દ્વિધ્રુવ આંતરક્રિયા
પ્રશ્ન 24.
દ્રાવ્ય-દ્રાવક પારસ્પરિક ક્રિયાના આધારે નીચેનાને તેમની n-ઓક્લેનમાં દ્રાવ્યતાના ચઢતા ક્રમમાં ગોઠવો અને સમજાવો. સાયક્લોહેક્ઝેન, KCl, CH‚OH, CH3CN
ઉત્તર:
(i) સાયક્લોહેક્ઝેન અને n-ઓક્લેન બંને અધ્રુવીય છે. તેથી તે બંને કોઈ પણ પ્રમાણમાં સંપૂર્ણપણે મિશ્ર થઈ જાય છે.
(ii) KCl એ આયોનિક સંયોજન છે પરંતુ n-ઓક્લેન એ અધ્રુવીય છે. તેથી KCl એ n-ઓક્લેનમાં દ્રાવ્ય થાય નહિ.
(iii) CH3OH અને CH3CN બંને ધ્રુવીય છે પરંતુ CH3OH કરતાં CH3CN એ ઓછું ધ્રુવીય છે. n-ઓક્લેન એ અવીય હોવાથી CH3CN એ CH3OH કરતાં વધુ ધ્રુવીય છે.
દ્રાવ્યતાનો ક્રમ : KCI < CH3OH < CH3CN < સાયક્લોહેક્ઝેન
પ્રશ્ન 25.
નીચેના સંયોજનોમાંથી પાણીમાં અદ્રાવ્ય, અંશતઃ દ્રાવ્ય અને અતિદ્રાવ્યને ઓળખી બતાવો :
(i) ફિનોલ
(ii) ટોલ્યુઇન
(iii) ફોર્મિક એસિડ
(iv) ઇથીલીન ગ્લાયકોલ
(v) ક્લોરોફોર્મ
(vi) પેન્ટેનોલ
ઉત્તર:
(i) ફિનોલ : આંશિક દ્રાવ્ય
કારણ : ફિનોલમાં ધ્રુવીય -OH સમૂહ છે. અને
-C6H5 અધવીય સમૂહ છે.
(ii) ટોલ્યુઇન : અદ્રાવ્ય
કારણ : ટોલ્યુઇન એ અધ્રુવીય છે.
(iii) ફૉર્મિક ઍસિડ : સુદ્રાવ્ય
કારણ : હાઇડ્રોજન બંધ
(iv) ઇથીલીન ગ્લાયકોલ : સુદ્રાવ્ય
કારણ : હાઇડ્રોજન બંધ
(v) ક્લોરોફૉર્મ : અદ્રાવ્ય
(vi) પેન્ટેનોલ : આંશિક દ્રાવ્ય
કારણ : -OH સમૂહ ધ્રુવીય પરંતુ હાઇડ્રોકાર્બન ભાગ અધ્રુવીય છે.
![]()
પ્રશ્ન 26.
જો કોઈ સરોવરના પાણીની ઘનતા 1.25g mL-1 હોય અને તે 92g Na+ પ્રતિ કિલોગ્રામ પાણી ધરાવતું હોય, તો સરોવરના પાણીમાં Na+ આયનની મોલાલિટી ગણો.
ઉત્તર:

= 4 મોલ/kg
= 4m
પ્રશ્ન 27.
જો CuS નો દ્રાવ્યતા ગુણાકાર 6 × 10-16 હોય, તો CuS ની જલીય દ્રાવણમાં મહત્તમ મોલારિટી ગણો.
ઉત્તર:

KSP = [Cu+2] [S-2]
= S. S
= S2
∴ 6 × 10-16 = S2
S = \(\sqrt{6 \times 10^{-16}}\)
S = 2.45 × 10-8 M
પ્રશ્ન 28.
6.5 g એસ્પિરિન (C6H8O4), 450 g CH3CN માં ઓગાળવામાં આવે, તો એસ્પિરિનની એસિટોનાઇટ્રાઇલમાં દળથી ટકાવારી ગણો.
ઉત્તર:
ઍસ્પિરિનનું દળ= 6.5 ગ્રામ
એસિટોનાઇટ્રાઇલનું દળ = 450 ગ્રામ
દ્રાવણનું વજન = (6.5 + 450) = 456.5 ગ્રામ
દળથી % = \(\frac{6.5}{456.5}\) × 100 = 1.424 %
પ્રશ્ન 29.
નેલોરફીન(C19H21 NO3) મોર્ફિનને સમાન છે જે નિદ્રાપ્રેરકનો ઉપયોગ કરનારમાંથી તેનાં લક્ષણો (symptoms) દૂર કરવા માટે વપરાય છે. સામાન્ય રીતે અપાતા નેલોરફીનનો ડોઝ (માત્રા) 1.5 mg છે. ઉપરના ડોઝ માટે જરૂરી 1.5 × 10-3 m જલીય દ્રાવણ માટેનું દળ ગણો.
ઉત્તર:
m = 1.5 × 10-3
દ્રાવ્યનું વજન = 1.5 × 10-3 ગ્રામ અથવા 1.5 mg
દ્રાવકનું વજન = (?)
નેલોરફીન (C19H21 NO3) નો અણુભાર = 311 ગ્રામ/મોલ

= 0.0032 kg
= 3.2 ગ્રામ
પ્રશ્ન 30.
250 mL 0.15M બેન્ઝોઇક એસિડ (CH6H5COOH)નું મિથેનોલમાં દ્રાવણ બનાવવા માટેનો જથ્થો (વજન) ગણો.
ઉત્તર:
મોલારિટી = 0.15 M
દ્રાવણનું કદ = 250 ml = 0.25 લિટર
દ્રાવ્યનો અણુભાર = 122 ગ્રામ/મોલ

W = 0.15 × 122 × 0.25
= 4.575 ગ્રામ
![]()
પ્રશ્ન 31.
એસિટિક ઍસિડ, ટ્રાયક્લોરો એસિટિક ઍસિડ અને ટ્રાયફ્લોરો એસિટિક એસિડના સમાન જથ્થા (વજન)ના ઉપયોગથી પાણીમાં ઠારબિંદુ અવનયન (ઘટાડો) ઉપર જણાવેલા ક્રમમાં અવલોકિત થયો છે ટૂંકમાં સમજાવો.
ઉત્તર:

- F, Cl, અને H પૈકી H એ સૌથી ઓછી વિદ્યુતઋણતા અને Fએ સૌથી વધુ વિદ્યુતઋણતા ધરાવે છે. તેથી ટ્રાયફ્લોરો એસિટિક ઍસિડ એ સરળતાથી H+ આયન મુક્ત કરે છે અને વધુ આયન ઉત્પન્ન કરે છે.
- પાણીમાં આપેલ દ્રાવ્યને ઓગાળતા ઠારબિંદુમાં થતો ઘટાડો એ અણુ/આયનોની સંખ્યા ઉપર આધારિત છે તેથી આપેલ ઍસિડની ઍસિડિક પ્રબળતાનો વધતો ક્રમ નીચે મુજબ છે :
CH3COOH < CCl3COOH < CF3COOH
પ્રશ્ન 32.
જો 10 g CH3CH2CHClCOOH ને 250 g પાણીમાં ઉમેરવામાં આવે તો પાણીનું ઠારબિંદુ અવનયન ગણો. Ka = 1.4 × 10-3, Kf = 1.86K kg mol-1 [ઑગસ્ટ-2020]
ઉત્તર:
દ્રાવ્યનું વજન = 10 ગ્રામ
દ્રવ્યનો અણુભાર = 122.5 ગ્રામ/મોલ

વિયોજન પછી સંતુલને કુલ મોલ = 1 − α + α + α = 1 + α

= \(\frac{1+\alpha}{1}\) 1 + α
વિયોજન પછી કુલ મોલ શરૂઆતના મોલ
i = 1 + 0.065 = 1.065
ΔTf = i . Kf . m
= (1.065) × 1.86K . kg મોલ-1 × 0.3264 મોલ/kg
= 0.65 K
પ્રશ્ન 33.
19.5 g CH2FCOOH 500g wellin છે. પાણીના ઠારબિંદુનું અવનયન 1.0°C નોંધાયું છે. ફ્લોરોએસિટિક ઍસિડનો વિયોજન અચળાંક અને વૉન્ટહૉફ અવયવ ગણો.
ઉત્તર:

∴ Ka = 3.07 × 10-3
પ્રશ્ન 34.
293 K તાપમાને પાણીનું બાષ્પદબાણ 17.535 mm Hg છે. 293 K તાપમાને જ્યારે 450 g પાણીમાં 25 g ગ્લુકોઝ ઓગાળવામાં આવ્યો ત્યારે બાષ્પદબાણ ગણો.
ઉત્તર:
જ્યાં, દ્રાવ્યનું વજન (WB) = 25 ગ્રામ
દ્રાવકનું વજન (WA) = 450 ગ્રામ
દ્રાવ્યનો અણુભાર (MB) = 180 ગ્રામ/મોલ
દ્રાવકનો અણુભાર (MA) = 18 ગ્રામ/મોલ
\(p_{\mathrm{A}}^0\) = 17.535 mm
PS = (?)

PS = 17.535 – 0.097
= 17.438 mm
પ્રશ્ન 35.
298 K તાપમાને બેઝિનમાં મિથેનની મોલાલિટી માટે હેન્રી અચળાંકનું મૂલ્ય 4.27 × 105 mm Hg છે. 760 mm દબાણ હેઠળ 298 K તાપમાને મિથેનની બેન્ઝિનમાં દ્રાવ્યતા ગણો.
ઉત્તર:
p = KH . x
∴ x = \(\frac{p}{\mathrm{~K}_{\mathrm{H}}}\)
જ્યાં, KH = 4.27 × 105mm Hg
p = 760 mm
= \(\frac{760}{\left(4.27 \times 10^5\right)}\) = 1.78 × 10-3
![]()
પ્રશ્ન 36.
100g પ્રવાહી A (મોલર દળ 140 g mol-1)ને 1000g પ્રવાહી B (મોલર દળ 180g mol-1)માં ઓગાળવામાં આવ્યો. શુદ્ધ પ્રવાહી Bનું બાષ્પદબાણ 500 torr જણાયું. શુદ્ધ પ્રવાહી Aનું બાષ્પદબાણ ગણો અને જો દ્રાવણનું કુલ દબાણ 475 torr હોય, તો તેનું દ્રાવણમાં બાષ્પદબાણ ગણો.
ઉત્તર:
(i) શુદ્ધ પ્રવાહી Aના બાષ્પદબાણની ગણતરી :
nA = \(\frac{\mathrm{w}_{\mathrm{A}}}{\mathrm{M}_{\mathrm{A}}}=\frac{100}{140}\) = 0.7143 મોલ
nB = \(\frac{\mathrm{w}_{\mathrm{B}}}{\mathrm{M}_{\mathrm{B}}}=\frac{1000}{180}\) = 5.55 મોલ
∴ A ના મોલ અંશ = XA = \(\frac{n_A}{n_A+n_B}\)
= \(\frac{0.7143}{0.7143+5.55}\) = 0.1139
∴ B ના મોલ અંશ = XB = 1 – XA
= 1 – 0.1139 = 0.8861
શુદ્ધ પ્રવાહી B નું બાષ્પદબાણ = \(p_{\mathrm{B}}^0\) = 500 torr
દ્રાવણનું કુલ બાષ્પદબાણ (p) = 475 torr
p = \(p_{\mathrm{A}}^0\) · xA + \(p_{\mathrm{B}}^0\) . xB
475 = \(p_{\mathrm{A}}^0\) × (0.1139) + 500 × (0.8861)
475 = \(p_{\mathrm{A}}^0\) × 0.1139 + 443.05
\(p_{\mathrm{A}}^0=\frac{475-443.05}{0.1139}=\frac{31.95}{0.1139}\)
= 280.5 ટૉર
(ii) દ્રાવણમાં A ના બાષ્પદબાણની ગણતરી :
PA = \(p_{\mathrm{A}}^0\) · xA
= 280.5 × 0.1139 = 32.0 ટૉર
પ્રશ્ન 37.
શુદ્ધ એસિટોન અને ક્લોરોફોર્મના બાષ્પદબાણ 328 K તાપમાને અનુક્રમે 741.8 mm Hg અને 632.8 mm Hg છે. તેઓ સંઘટનના સંપૂર્ણ ગાળા દરમિયાન આદર્શ દ્રાવણ બનાવે છે તેમ ધારીને અને Pકુલ Pક્લોરોફોર્મ નો xએસિટોન (function) તરીકે આલેખ દોરો. મિશ્રણના જુદા-જુદા સંઘટન માટે અવલોકિત કરેલી પ્રાયોગિક માહિતી નીચે પ્રમાણે છે :
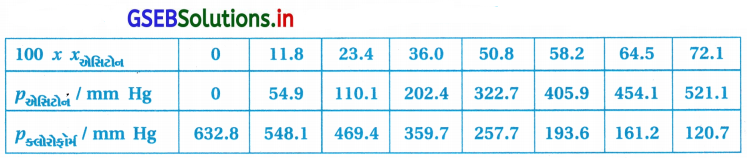
આ માહિતીને તે જ આલેખ પત્ર પર દોરો. તેને આદર્શ વાયુથી ધન વિચલન કે ઋણ વિચલન છે તેનું સૂચન કરો.
ઉત્તર:
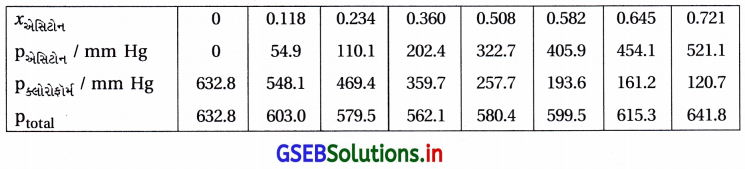
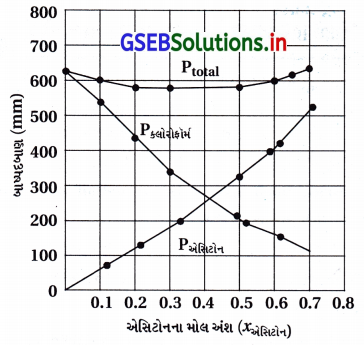
આલેખ પરથી Ptotal નો ગ્રાફ નીચેની તરફ આવે છે જે દર્શાવે છે કે તે રાઉલ્ટના નિયમથી ઋણવિચલન દર્શાવે છે.
પ્રશ્ન 38.
બેઝિન અને ટોલ્યુઇન સંઘટનના સંપૂર્ણ ગાળા દરમિયાન આદર્શ દ્રાવણ બનાવે છે. 300 K તાપમાને શુદ્ધ બેન્ઝિન અને ટોલ્યુઇનના બાષ્પદબાણ અનુક્રમે 50.71 mm Hg અને 32.06 mm Hg છે. જો 80 g બેઝિન અને 100 g ટોલ્યુઇન મિશ્રણ કરવામાં આવ્યા હોય, તો બેન્ઝિનનો બાષ્પ અવસ્થામાં મોલ અંશ ગણો.
ઉત્તર:
- બેન્ઝિનનો અણુભાર = 78 ગ્રામ/મોલ
ટોલ્યુઇનનો અણુભાર = 92 ગ્રામ/મોલ
બેન્ઝિનનો મોલ = \(\frac{80}{78}\) = 1.026 મોલ
ટોલ્યુઇનનો મોલ = \(\frac{100}{92}\) = 0.087 મોલ
બેન્ઝિનનો મોલ અંશ = \(\frac{1.026}{1.026+1.087}\) = 0.486
નેપ્થેલીનના મોલ અંશ = 1 – 0.486
= 0.514 - દ્રાવણમાં બેઝિનનું બાષ્પદબાણ (PC6H6 ) = \(p_{\mathrm{C}_6 \mathrm{H}_6}^0\) × xC6H6 = (50.71) × 0.486
= 24.645 mm - દ્રાવણમાં ટોલ્યુઇનનું બાષ્પદબાણ p = p0 × xટોલ્યુઇન
= 32.06 × 0.514
= 16.479 mm - બાષ્પ અવસ્થામાં બેન્ઝિનના મોલ અંશ = im34
= \(\frac{24.645}{24.645+16.479}\)
= 0.599 ≈ 0.6
પ્રશ્ન 39.
હવા ઘણા વાયુઓનું મિશ્રણ છે. 298 K તાપમાને મુખ્ય ઘટકો ઑક્સિજન અને નાઇટ્રોજનનું લગભગ પ્રમાણ કદથી અનુક્રમે 20% અને 79% છે. 10 atm દબાણે પાણી હવા સાથે સંતુલનમાં છે. હેન્રી નિયમ અચળાંક ઑક્સિજન અને નાઇટ્રોજન માટે 298 K તાપમાને અનુક્રમે 3.30 × 107 mm અને 6.51 × 107 mm હોય, તો પાણીમાં આ વાયુઓનું સંઘટન (પ્રમાણ) ગણો.
ઉત્તર:
- ઑક્સિજન અને નાઇટ્રોજનનું આંશિક દબાણ :
PO2 = 10 × \(\frac{20}{100}\) = 2 વાતા = 2 × 760 mm
PN2 = 10 × \(\frac{79}{100}\) = 79 વાતા = 79 × 760 mm - ઑક્સિજન અને નાઇટ્રોજન વાયુઓનું સંઘટન :
xO2 = \(\frac{p_{\mathrm{O}_2}}{\mathrm{~K}_{\mathrm{H}}}=\frac{2 \times 760 \mathrm{~mm}}{3.30 \times 10^7 \mathrm{~mm}}\) = 4.6 × 10-5
xN2 = \(\frac{p_{\mathrm{N}_2}}{\mathrm{~K}_{\mathrm{H}}}=\frac{7.9 \times 760 \mathrm{~mm}}{6.51 \times 10^7 \mathrm{~mm}}\) = 9.22 × 10-5
પ્રશ્ન 40.
27°C તાપમાને 0.75 atm અભિસરણ દબાણ દર્શાવે તેવા કેલ્શિયમ ક્લોરાઇડના દ્રાવણ માટે 2.5 લિટર પાણીમાં દ્રાવણ બનાવવા માટે CaCl2 (i = 2.47)નો જથ્થો(વજન) નક્કી કરો.
ઉત્તર:
π = \(\frac{i \mathrm{wRT}}{\mathrm{MV}}\)
W = \(\frac{\pi \times \mathrm{M} \times \mathrm{V}}{i \times \mathrm{R} \times \mathrm{T}}\)
જ્યાં, i = 2.47, T = 300K
π = 0.75 વાતા., V = 2.5 લિટર
R = 0.0821 લિટર વાતા./મો.કૅલ્વિન
M = 111 ગ્રામ/મોલ
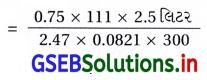
= 3.42 ગ્રામ
![]()
પ્રશ્ન 41.
25°C તાપમાને 2 લિટર પાણીમાં 25mg K2SO4 ઓગાળીને બનાવેલા દ્રાવણનું અભિસરણ દબાણ નક્કી કરો. અહીં K2SO4 નું સંપૂર્ણ વિયોજન થાય છે તેમ ધારી લો.
ઉત્તર:
- જ્યાં, પાણીમાં દ્રાવ્ય K2SO4 = 25 mg = 0.025 ગ્રામ
દ્રાવણનું કદ = 2 લિટર, T = 298K
K2SO4 નું અણુભાર = 174 ગ્રામ/મોલ - K2SO4 → 2K+ + SO4-2
વિયોજનથી મળતા કુલ આયન 3 હોવાથી i = 3
π = \(\frac{i \mathrm{wRT}}{\mathrm{MV}}\)
= \(\frac{3 \times 0.025 \times 0.0821 \times 298}{174 \times 2}\)
= 5.27 × 10-3 વાતાવરણ
GSEB Class 12 Chemistry દ્રાવણો NCERT Exemplar Questions and Answers
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-I)
નીચેના પ્રશ્નોમાં એક જ વિકલ્પ સાચો છે.
પ્રશ્ન 1.
નીચેના એકમોમાંથી કયો દ્રાવણની સાંદ્રતાને તેના બાષ્પ- દબાણ સાથે સાંકળવા માટે ઉપયોગી છે ?
(A) મોલ અંશ
(B) પાર્ટ્સ પર મિલિયન
(C) દળ ટકાવારી
(D) મોલાલિટી
જવાબ
(A) મોલ અંશ
હેન્રીના નિયમ મુજબ, p = KH · x
જ્યાં, KH = હેન્રી અચળાંક
પ્રશ્ન 2.
ઓરડાના તાપમાને ખાંડને પાણીમાં ઓગાળતા દ્રાવણને સ્પર્શ કરવાથી ઠંડું લાગે છે. નીચેના કયા કિસ્સાઓ પૈકી ખાંડ ઓગળવાની ક્રિયા સૌથી ઝડપી હશે ?
(A) ઠંડા પાણીમાં ખાંડના સ્ફટિકો
(B) ગરમ પાણીમાં ખાંડના સ્ફટિકો
(C) ઠંડા પાણીમાં ખાંડનો ભૂકો
(D) ગરમ પાણીમાં ખાંડનો ભૂકો
જવાબ
(D) ગરમ પાણીમાં ખાંડનો ભૂકો
- ભૂકા સ્વરૂપમાં ખાંડ ગરમ પાણીમાં ઝડપથી ઓગળે છે. કારણ કે ભૂકા સ્વરૂપના ખાંડના કણો સરળતાથી પાણીના અણુઓ વચ્ચેની ખાલી જગ્યામાં દાખલ થાય છે.
- ખાંડનું પાણીમાં ઓગળવું એ ઉષ્માશોષક પ્રક્રિયા છે. તેથી ઊંચા તાપમાને સરળતાથી ખાંડ ઓગળે છે.
પ્રશ્ન 3.
સંતુલને ઘન દ્રાવ્યનો બાષ્પશીલ પ્રવાહી દ્રાવકમાં ઓગળવાનો દર ……………………… .
(A) સ્ફટિકીકરણના દર કરતાં ઓછો હોય છે.
(B) સ્ફટિકીકરણના દર કરતાં વધારે હોય છે.
(C) સ્ફટિકીકરણના દર જેટલો હોય છે.
(D) શૂન્ય હોય છે.
જવાબ
(C) સ્ફટિકીકરણના દર જેટલો હોય છે.
સંતુલને ઘન દ્રાવ્યનો બાષ્પશીલ પ્રવાહી દ્રાવકમાં ઓગળવાનો દર સ્ફટિકીકરણના દર જેટલો હોય છે.
પ્રશ્ન 4.
એક બીકરમાં પદાર્થ ‘A’ નું દ્રાવણ છે જ્યારે દ્રાવણમાં થોડાક પ્રમાણમાં ‘A’ ઉમેરવામાં આવે ત્યારે પદાર્થ ‘A’ નું અવક્ષેપન થાય છે. આ દ્રાવણ ………………….. છે.
(A) સંતૃપ્ત
(B) અતિસંતૃપ્ત
(C) અસંતૃપ્ત
(D) સાંદ્ર
જવાબ
(B) અતિસંતૃપ્ત
જ્યારે દ્રાવ્યને દ્રાવણમાં ઉમેરવામાં આવે ત્યારે… (i) જો દ્રાવ્યમાં દ્રાવ્ય થાય તો તે અસંતૃપ્ત દ્રાવણ છે. (ii) જો તે દ્રાવ્ય ન થાય તો સંતૃપ્ત દ્રાવણ છે, પરંતુ આપેલ સંતૃપ્ત દ્રાવણમાં વધુ દ્રાવ્ય ઉમેરતાં તે જ દ્રાવ્ય ઘટકનું અવક્ષેપન થાય તો તે દ્રાવણ અતિસંતૃપ્ત છે.
પ્રશ્ન 5.
આપેલા પ્રવાહી દ્રાવકના નિશ્ચિત જથ્થામાં દ્રાવ્ય થતાં ઘન દ્રાવ્યના મહત્તમ જથ્થાનો આધાર ……………………… પર નથી.
(A) તાપમાન
(B) દ્રાવ્યના સ્વભાવ
(C) દબાણ
(D) દ્રાવકના સ્વભાવ
જવાબ
(C) દબાણ
કારણ કે પ્રવાહી અને ઘન પદાર્થ એ અસંકોચનીય છે. તેના પર દબાણની અસર થતી નથી.
![]()
પ્રશ્ન 6.
ઊંચાઈએ વસતાં લોકોનાં લોહી તથા પેશીઓમાં ઑક્સિજનની નીચી સાંદ્રતાનું કારણ છે ……………………. .
(A) નીચું તાપમાન
(B) નીચું વાતાવરણનું દબાણ
(C) ઊંચું વાતાવરણનું દબાણ
(D) નીચું તાપમાન અને ઊંચું વાતાવરણનું દબાણ બંને
જવાબ
(B) નીચું વાતાવરણનું દબાણ
હેન્રીના નિયમ પરથી, P = KH · x
વધુ ઊંચાઈ પર ઑક્સિજનનું આંશિક દબાણ એ નીચેની સપાટી કરતાં ઓછું હોય છે. તેથી લોહીમાં ઑક્સિજનની સાંદ્રતા ઘટે છે (p ∝ x) અને માનવશરીરનું તાપમાન અચળ રહે છે.
પ્રશ્ન 7.
હાઇડ્રોજન-બંધ બનવાની, તૂટવાની અને તેની પ્રબળતાને ધ્યાનમાં રાખી નીચેનાં મિશ્રણો પૈકી કયું રાઉલ્ટના નિયમથી ધન વિચલન દર્શાવશે તેની આગાહી કરો :
(A) મિથેનોલ અને એસિટોન
(B) ક્લોરોફૉર્મ અને એસિટોન
(C) નાઇટ્રિક ઍસિડ અને પાણી
(D) ફિનોલ અને એનિલિન
જવાબ
(A) મિથેનોલ અને એસિટોન
- મિથેનોલ/ઇથેનોલ અણુ H-બંધ ધરાવે છે. જ્યારે એસિટોન ઉમેરવામાં આવે ત્યારે H-બંધ તોડે છે અને વચ્ચે ગોઠવાય છે.
- તેથી દ્રાવ્ય-દ્રાવક વચ્ચે આંતરઆણ્વિય આકર્ષણ બળ દ્રાવ્ય-દ્રાવ્ય અને દ્રાવક-દ્રાવક કરતાં ઓછું હોય છે.
- બાકીના ત્રણ વિકલ્પમાં ઋણવિચલન ધરાવે છે. એટલે કે દ્રાવ્ય- દ્રાવક વચ્ચે આંતરઆણ્વિય આકર્ષણ બળ દ્રાવ્ય-દ્રાવ્ય અને દ્રાવક-દ્રાવક કરતાં વધુ હોય છે.
પ્રશ્ન 8.
સંખ્યાત્મક ગુણધર્મોનો આધાર છે ………………………
(A) દ્રાવણમાં ઓગળેલા દ્રાવ્યના કણોના સ્વભાવ પર
(B) દ્રાવણમાં રહેલા દ્રાવ્યના કણોની સંખ્યા પર
(C) દ્રાવણમાં ઓગળેલા દ્રાવ્યના કણોના ભૌતિક ગુણધર્મો ૫૨
(D) દ્રાવકના કણોના સ્વભાવ પર
જવાબ
(B) દ્રાવણમાં રહેલા દ્રાવ્યના કણોની સંખ્યા પર
પ્રશ્ન 9.
નીચેનાં જલીય દ્રાવણો પૈકી કયાનું ઉત્કલનબિંદુ સૌથી ઊંચું હોવું જોઈએ ?
(A) 1.0 M NaOH
(B) 1.0 M Na2SO4
(C) 1.0 M NH4NO3
(D) 1.0 M KNO3
જવાબ
(B) 1.0 M Na2SO4
જેના વૉન્ટહૉફ ફૅક્ટર (અવયવ)નું મૂલ્ય વધુ તેનું ઉત્કલનબિંદુ વધારે.
| દ્રાવણ | વૉન્ટહૉફ ફૅક્ટર (i) |
| 1.0 M NaOH | 2 |
| 1.0 M Na2SO4 | 3 |
| 1.0 M NH4NO3 | 2 |
| 1.0 M KNO3 | 2 |
પ્રશ્ન 10.
મોલલ ઉન્નયન અચળાંકનો એકમ છે …………………
(A) K kg mol-1 અથવા K (મોલાલિટી)-1
(B) mol kg K-1 અથવા K-1 (મોલાલિટી)
(C) kg mol-1 K-1અથવા K-1 (મોલાલિટી)-1
(D) K mol kg-1 અથવા K (મોલાલિટી)
જવાબ
(A) K kg mol-1 અથવા K (મોલાલિટી)-1
ΔTb = Kb · m

![]()
પ્રશ્ન 11.
0.01 M ગ્લુકોઝના દ્રાવણની તુલનામાં, 0.01 M MgCl2 ના દ્રાવણનું ઠારબિંદુ અવનયન ……………………… છે.
(A) સરખું
(B) લગભગ બમણું
(C) લગભગ ત્રણ ગણું
(D) લગભગ છ ગણું
જવાબ
(C) લગભગ ત્રણ ગણું
ઠારબિંદુમાં થતો ઘટાડો વૉન્ટહૉફ ફૅક્ટર (i) ઉપર આધારિત છે.
0.01 m ગ્લુકોઝ → = 1
0.01 m MgCl2 → i = 3
પ્રશ્ન 12.
કાચી કેરીનું અથાણું બનાવવા તેને મીઠાના સાંદ્ર દ્રાવણમાં રાખતા ચીમળાઈ જાય છે. કારણ કે ………………..
(A) તે અભિસરણ દ્વારા પાણી મેળવે છે.
(B) તે પ્રતિઅભિસરણ દ્વારા પાણી ગુમાવે છે.
(C) તે પ્રતિઅભિસરણ દ્વારા પાણી પ્રાપ્ત કરે છે.
(D) તે અભિસરણ દ્વારા પાણી ગુમાવે છે.
જવાબ
(D) તે અભિસરણ દ્વારા પાણી ગુમાવે છે.
અભિસરણના લીધે કાચી કેરી પાણી ગુમાવીને ચીમળાઈ જાય છે.
પ્રશ્ન 13.
આપેલા તાપમાને, પદાર્થના સાંદ્ર દ્રાવણનું અભિસરણ દબાણ ……………….
(A) મંદ દ્રાવણના કરતાં ઊંચું હોય છે.
(B) મંદ દ્રાવણના કરતાં નીચું હોય છે.
(C) મંદ દ્રાવણના જેટલું જ હોય છે.
(D) મંદ દ્રાવણના અભિસરણ દબાણ સાથે સરખાવી શકાય નહિ.
જવાબ
(A) મંદ દ્રાવણના કરતાં ઊંચું હોય છે.
π = CRT અનુસાર સાંદ્રતા વધે તો અભિસરણ વધુ.
પ્રશ્ન 14.
નીચેનાં વિધાનોમાંથી કયું ખોટું છે ?
(A) જુદાં-જુદાં દ્રાવકોમાં બનાવેલા સુક્રોઝનાં બે જુદાં-જુદાં પરંતુ સમાન મોલાલિટીવાળાં દ્રાવણોનાં ઠારબિંદુ અવનયન સરખાં જ હશે.
(B) દ્રાવણનું અભિસરણ-દબાણ π = CRT સમીકરણ વડે દર્શાવાય છે. (જ્યાં C દ્રાવણની મોલારિટી છે.)
(C) બેરિયમ ક્લોરાઇડ, પોટૅશિયમ ક્લોરાઇડ, એસિટિક ઍસિડ અને સુક્રોઝના 0.01 Mજલીય દ્રાવણોના અભિસરણ દબાણનો ઘટતો ક્રમ છે.
BaCl2 > KCl > CHCOOH > સુક્રોઝ
(D) રાઉલ્ટના નિયમ પ્રમાણે, દ્રાવણના બાષ્પશીલ ઘટક વડે લાગતું બાષ્પદબાણ દ્રાવણમાં તેના મોલ અંશના સમપ્રમાણમાં હોય છે.
જવાબ
(A) જુદાં-જુદાં દ્રાવકોમાં બનાવેલા સુક્રોઝનાં બે જુદાં-જુદાં પરંતુ સમાન મોલાલિટીવાળાં દ્રાવણોનાં ઠારબિંદુ અવનયન સરખાં જ હશે.
- ΔTf = Kf · m
- Kf = મોલલ અવનયન અચળાંક છે. જે દ્રાવકના સ્વભાવ પર આધારિત છે. આથી જુદા જુદા દ્રાવક માટે ઠારબિંદુમાં થતો ઘટાડો પણ જુદો જુદો હોય છે.
પ્રશ્ન 15.
KC, NaCl અને K2SO4 ના વૉહૉફ અવયવનાં મૂલ્યો અનુક્રમે …………………. છે.
(A) 2, 2 અને 2
(B) 2, 2 અને 3
(C) 1, 1 અને 2
(D) 1, 1 અને 1
જવાબ
(B) 2, 2 અને 3
KCl માટે → i = 2
NaCl માટે → = 2
K2SO4 માટે → i = 3
![]()
પ્રશ્ન 16.
નીચેના વિધાનોમાંથી કયું ખોટું છે ?
(A) વાતાવરણનું દબાણ તથા અભિસરણ-દબાણના એકમો સમાન છે.
(B) પ્રતિ-અભિસરણમાં દ્રાવકના અણુઓ અર્ધપારગમ્ય પડદા મારફતે દ્રાવ્યની નીચી સાંદ્રતાવાળા પ્રદેશ તરફથી ઊંચી સાંદ્રતાવાળા પ્રદેશ તરફ વહે છે.
(C) મોલલ અવનયન અચળાંકના મૂલ્યનો આધાર દ્રાવકના સ્વભાવ પર હોય છે.
(D) બાષ્પદબાણમાં થતો સાપેક્ષ ઘટાડો પરિમાણવિહીન રાશિ છે.
જવાબ
(B) પ્રતિ-અભિસરણમાં દ્રાવકના અણુઓ અર્ધપારગમ્ય પડદા મારફતે દ્રાવ્યની નીચી સાંદ્રતાવાળા પ્રદેશ તરફથી ઊંચી સાંદ્રતાવાળા પ્રદેશ તરફ વહે છે.
પ્રતિઅભિસરણ દબાણમાં, દ્રાવકના અણુઓ અર્ધપારગમ્ય પડદા મારફતે વધુ સાંદ્રતા ધરાવતા દ્રાવણથી ઓછી સાંદ્રતા ધરાવતા દ્રાવણ તરફ જાય છે.
પ્રશ્ન 17.
હેન્રી અચળાંક KH નું મૂલ્ય ……………………. .
(A) તાપમાન વધતા વધે છે.
(B) તાપમાન વધતા ઘટે છે.
(C) અચળ રહે છે.
(D) પહેલા વધે છે પછી ઘટે છે.
જવાબ
(A) તાપમાન વધતા વધે છે.
T ના વધારા સાથે KH વધે છે અને દ્રાવ્યતા ઘટે છે.
પ્રશ્ન 18.
હેન્રી અચળાંક KH નું મૂલ્ય …………………….. .
(A) ઊંચી દ્રાવ્યતાવાળા વાયુઓ માટે વધારે હોય છે.
(B) નીચી દ્રાવ્યતાવાળા વાયુઓ માટે વધારે હોય છે.
(C) બધા જ વાયુઓ માટે અચળ હોય છે.
(D) વાયુઓની દ્રાવ્યતા સાથે સંબંધિત નથી.
જવાબ
(B) નીચી દ્રાવ્યતાવાળા વાયુઓ માટે વધારે હોય છે.
- p ∝ x
P = KH· x - KH નું મૂલ્ય નીચી દ્રાવ્યતા ધરાવતા વાયુઓ માટે વધારે હોય છે.
પ્રશ્ન 19.
આકૃતિ 2.1 ધ્યાનમાં લો અને સાચો વિકલ્પ ચિહ્નિત કરો.
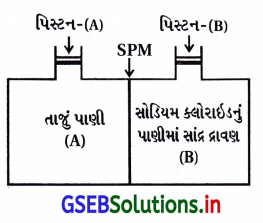
(A) જો પિસ્ટન (B) ઉપર અભિસરણ દબાણ કરતાં ઓછું દબાણ લગાડવામાં આવે તો પાણી (A) બાજુથી (B) બાજુ તરફ જશે.
(B) જો પિસ્ટન (B) ઉ૫૨ અભિસરણ-દબાણ કરતાં વધુ દબાણ લગાડવામાં આવે તો પાણી (B) બાજુથી (A) બાજુ તરફ જશે.
(C) જો પિસ્ટન (B) ઉપ૨ અભિસરણ દબાણ જેટલું દબાણ લગાડવામાં આવે તો પાણી (B) બાજુથી (A) બાજુ તરફ જશે.
(D) જો પિસ્ટન (A) ઉપ૨ અભિસરણ દબાણ જેટલું દબાણ લગાડવામાં આવે તો પાણી (A) બાજુથી (B) બાજુ તરફ જશે.
જવાબ
(B) જો પિસ્ટન (B) ઉપર અભિસરણ દબાણ કરતાં વધુ દબાણ લગાડવામાં આવે તો પાણી (B) બાજુથી (A) બાજુ તરફ જશે.
જો દ્રાવણ ઉપર અભિસરણ દબાણ કરતાં વધુ દબાણ આપવામાં આવે તો દ્રાવકનો પ્રવાહ દ્રાવણથી શુદ્ધ દ્રાવક તરફ થાય છે. જેને પ્રતિઅભિસરણ કહે છે.
પ્રશ્ન 20.
આપણી પાસે NaCl ના અનુક્રમે 0.1 M, 0.01 M, 0.001 M સાંદ્રતા ધરાવતા ‘A’, ‘B’ અને ‘C’ નામનિર્દેશ કરેલાં ત્રણ જલીય દ્રાવણો છે. આ દ્રાવણોના વૉન્ટ હૉફ અવયવનાં મૂલ્યોનો ક્રમ છે ………………….. .
(A) iA < iB < iC
(B) iA > iB > iC
(C) iA = iB = iC
(D) iA < iB > iC
જવાબ
(A) iA < iB < iC
જેમ સાંદ્રતા વધુ હોય વૉન્ટહૉફ અવયવ (i) વધુ હોય છે.
A → 0.1 M
B → 0.01 M
C → 0.001 M
ઉપરથી નીચે તરફ
→ સાંદ્રતા ઘટતી જાય છે
→ આથી માં ની કિંમત પણ ઘટે
આથી iA < iB < iC
![]()
પ્રશ્ન 21.
નીચે આપેલી માહિતીને આધારે સાચો વિકલ્પ ચિહ્નિત કરો.
(i) બ્રોમોઇથેન અને ક્લોરોઇથેનના મિશ્રણમાં A-A તથા B-B પ્રકારની આંતરઆણ્વિય આંતરક્રિયાઓ લગભગ A-B પ્રકારની આંતરક્રિયા જેવી છે.
(ii) ઇથેનોલ અને એસિટોનના મિશ્રણમાં A-A અથવા B-B પ્રકારની આંતરઆણ્વિય આંતરક્રિયાઓ A-B પ્રકારની આંતરક્રિયા કરતાં પ્રબળ હોય છે.
(iii) ક્લોરોફોર્મ અને એસિટોનના મિશ્રણમાં A-A અથવા B-B પ્રકારની આંતરઆણ્વિય આંતરક્રિયાઓ A-B પ્રકારની આંતરક્રિયા કરતાં નિર્બળ હોય છે.
(A) દ્રાવણ (ii) અને (iii) રાઉલ્ટના નિયમનું પાલન કરશે.
(B) દ્રાવણ (i) રાઉલ્ટના નિયમનું પાલન કરશે.
(C) દ્રાવણ (ii) રાઉલ્ટના નિયમથી ઋણ વિચલન દર્શાવશે.
(D) દ્રાવણ (iii) રાઉલ્ટના નિયમથી ધન વિચલન દર્શાવશે.
જવાબ
(B) દ્રાવણ (i) રાઉલ્ટના નિયમનું પાલન કરશે.
આદર્શ દ્રાવણમાં A-A, B-B પ્રકારના આંતરઆણ્વિય આકર્ષણ બળ એ A-B પ્રકારના આકર્ષણ બળથી સમાન હોય છે. આથી બ્રોમોઇથેન અને ક્લોરોઇથેન એ આદર્શદ્રાવણનું ઉદાહરણ છે.
પ્રશ્ન 22.
500 ml ક્ષમતાવાળાં બે બીકરો લેવામાં આવ્યાં. તેમાંના એકને ‘A’ નામ આપી 400 mL પાણી ભરવામાં આવ્યું તથા બીજાને ‘B’ નામ આપી તેમાં 400 mL NaClનું 2 M દ્રાવણ ભરવામાં આવ્યું. બંને બીકરોને એકસરખાં તાપમાને એક જ સરખાં દ્રવ્યમાંથી બનેલા સમાન ક્ષમતાવાળાં બંધ પાત્રોમાં દર્શાવ્યા મુજબ મૂકવામાં આવ્યાં.
આપેલ તાપમાને, શુદ્ધ પાણી તથા NaClના દ્રાવણનાં બાષ્પદબાણ માટે નીચેના પૈકી કયું વિધાન સાચું છે ?
(A) પાત્ર (A)માં બાષ્પદબાણ પાત્ર (B)ના કરતાં વધારે છે.
(B) પાત્ર (A)માં બાષ્પદબાણ પાત્ર (B)ના કરતાં ઓછું છે.
(C) બંને પાત્રમાં બાષ્પદબાણ સરખું છે.
(D) પાત્ર (B)માં બાષ્પદબાણ પાત્ર (A)ના કરતાં બમણું છે.
જવાબ
(A) પાત્ર (A)માં બાષ્પદબાણ પાત્ર (B)ના કરતાં વધારે છે.
પાત્ર (A)માં શુદ્ધ પાણી (દ્રાવક) છે. જ્યારે પાત્ર (B)માં NaCl નું દ્રાવણ છે. જેથી દ્રાવણ કરતાં દ્રાવકનું બાષ્પદબાણ વધારે હોય છે.
પ્રશ્ન 23.
જો બે પ્રવાહીઓ A અને B કોઈક વિશિષ્ટ સંઘટને નિમ્નતમ ઉત્કલન એઝિયોટ્રોપ બનાવે તો …………………….
(A) A-B આંતરક્રિયાઓ A-A તથા B-Bના કરતાં પ્રબળ છે
(B) દ્રાવણનું બાષ્પદબાણ વધે છે કારણ કે પ્રવાહીઓ A તથા Bના વધારે સંખ્યામાં અણુઓ દ્રાવણમાંથી છટકી જઈ શકે છે.
(C) દ્રાવણનું બાષ્પદબાણ ઘટે છે કારણે કે બે પ્રવાહીઓમાંથી એકના જ અણુઓ ઓછી સંખ્યામાં દ્રાવણમાંથી છટકી જઈ શકે છે.
(D) A-B આંતરક્રિયાઓ A-A અથવા B-Bના કરતાં નિર્બળ છે.
જવાબ
(D) A-B આંતરક્રિયાઓ A-A અથવા B-Bના કરતાં નિર્બળ છે.
જો બે પ્રવાહી A અને B એ ન્યૂનતમ ઉત્કલન એઝિયોટ્રોપ ધરાવે તો A-B ની આંતરક્રિયા એ A-A અને A-B કરતા ઓછી છે કારણે દ્રાવણમાં સપાટી છોડી જનારા અણુની સંખ્યા શુદ્ધ પદાર્થ કરતાં વધુ છે અને ધન વિચલન દર્શાવે છે.
પ્રશ્ન 24.
4 L NaClનું 0.02 M જલીય દ્રાવણ એક લિટર પાણી વડે મંદ કરવામાં આવ્યું. પરિણામી દ્રાવણની મોલારિટી ……………………. છે.
(A) 0.004
(B) 0.008
(C) 0.012
(D) 0.016
જવાબ
(D) 0.016
M1V1 = M2V2
∴ 0.02 × 4 = M2 × 5
∴ M2 = 0.016 M
પ્રશ્ન 25.
નીચે આપેલી માહિતીને આધારે સાચો વિકલ્પ ચિહ્નિત કરો : મિથેનોલમાં એસિટોન ઉમેરતાં મિથેનોલના અણુઓ વચ્ચે રહેલા કેટલાક હાઇડ્રોજન બંધ તૂટે છે.
(A) કોઈક વિશિષ્ટ સંઘટને મિથેનોલ-એસિટોન મિશ્રણ નિમ્નતમ ઉત્કલન એઝિયોટ્રોપ બનાવશે અને રાઉલ્ટના નિયમથી ધન વિચલન દર્શાવશે.
(B) કોઈક વિશિષ્ટ સંઘટને મિથેનોલ-એસિટોન મિશ્રણ મહત્તમ ઉત્કલન એઝિયોટ્રોપ બનાવશે અને રાઉલ્ટના નિયમથી ધન વિચલન દર્શાવશે.
(C) કોઈક વિશિષ્ટ સંઘટને મિથેનોલ-એસિટોન મિશ્રણ નિમ્નતમ ઉત્કલન એઝિયોટ્રોપ બનાવશે અને રાઉલ્ટના નિયમથી ઋણ વિચલન દર્શાવશે.
(D) કોઈક વિશિષ્ટ સંઘટને મિથેનોલ-એસિટોન મિશ્રણ મહત્તમ ઉત્કલન એઝિયોટ્રોપ બનાવશે અને રાઉલ્ટના નિયમથી ઋણ વિચલન દર્શાવશે.
જવાબ
(A) કોઈક વિશિષ્ટ સંઘટને મિથેનોલ-એસિટોન મિશ્રણ નિમ્નતમ ઉત્કલન એઝિયોટ્રોપ બનાવશે અને રાઉલ્ટના નિયમથી ધન વિચલન દર્શાવશે.
કારણ કે A-B ની આંતરક્રિયા એ A-A અને B-B કરતાં ઓછી છે A-B < A-A અને B-B.
![]()
પ્રશ્ન 26.
Ar(g), CO2(g), HCHO(g) અને CH4(g) નાં KH મૂલ્યો
અનુક્રમે 40.39, 1.67, 1.83 × 10-5 અને 0.413 છે. આ વાયુઓને તેમની દ્રાવ્યતાના વધતા ક્રમમાં ગોઠવો.
(A) HCHO < CH4 < CO2 < Ar
(B) HCHO < CO2 < CH4 < Ar
(C) Ar < CO2 < CH4 < HCHO
(D) Ar < CH4 < CO2 < HCHO
જવાબ (C) Ar < CO2 < CH < HCHO
ΚH ∝ 
આથી Ar < CO2 < CH4 < HCHO
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-II)
નીચેના પ્રશ્નોમાં બે કે વધારે વિકલ્પો સાચાં હોઈ શકે છે.
પ્રશ્ન 1.
નીચેના પૈકી કયાં પરિબળો વાયુમય દ્રાવ્યની નિશ્ચિત કદના પ્રવાહી દ્રાવકમાં દ્રાવ્યતાને અસર કરે છે ?
(i) દ્રાવ્યનો સ્વભાવ
(ii) તાપમાન
(iii) દબાણ
(A) નિયત તાપમાને (i) અને (iii)
(B) નિયત દબાણે (i) અને (ii)
(C) ફક્ત (ii) અને (iii)
(D) ફક્ત (iii)
જવાબ
(A, B)
વાયુમય દ્રાવ્યની નિશ્ચિત કદના પ્રવાહી દ્રાવકમાં દ્રાવ્યતા એ દ્રાવ્યના સ્વભાવ અને અચળ દબાણે તાપમાન પર તથા અચળ તાપમાને દબાણ પર આધારિત છે.
પ્રશ્ન 2.
બેન્ઝિનના બે અણુઓ વચ્ચેના આંતરઆણ્વિય બળોની પ્રબળતા લગભગ ટોલ્યુઇનના બે અણુઓ વચ્ચેના જેવી હોય છે. બેઝિન અને ટોલ્યુઇનના મિશ્રણ માટે નીચેનામાંથી કયાં સાચાં નથી ?
(A) ΔmixH = શૂન્ય
(B) ΔmixV = શૂન્ય
(C) આ નિમ્નતમ ઉત્કલન એઝિયોટ્રોપ બનાવશે.
(D) આ આદર્શ દ્રાવણ બનાવશે નહિ.
જવાબ
(C, D)
- જે દ્રાવણ રાઉલ્ટના નિયમનું પાલન કરે તેને આદર્શ દ્રાવણ કહે છે. ઉપરોક્ત દ્રાવણ પણ આદર્શ દ્રાવણ બને છે.
- આદર્શ દ્રાવણ માટે ΔmixH = શૂન્ય
ΔmixV = શૂન્ય હોય છે. - બિનઆદર્શ દ્રાવણ માટે ન્યૂનતમ ઉત્કલન એઝિયોટ્રોપિક હોય છે.
પ્રશ્ન 3.
બાષ્પદબાણમાં થતો સાપેક્ષ ઘટાડો સંખ્યાત્મક ગુણધર્મ છે, કારણ કે …………………….
(A) તેનો આધાર દ્રાવણમાં રહેલાં અવિદ્યુતવિભાજ્ય દ્રાવ્યની સાંદ્રતા પર રહેલો છે નહિ કે દ્રાવ્યના અણુઓના સ્વભાવ પર.
(B) તેનો આધાર દ્રાવણમાં રહેલાં વિદ્યુતવિભાજ્ય દ્રાવ્યની કણ-સંખ્યા ૫૨ છે નહિ કે દ્રાવ્યના કણોના સ્વભાવ ૫૨.
(C) તેનો આધાર દ્રાવણમાં રહેલા અવિદ્યુતવિભાજ્ય દ્રાવ્યની સાંદ્રતા પર તેમ જ દ્રાવ્યના અણુના સ્વભાવ પર રહેલો છે.
(D) તેનો આધા૨ દ્રાવણમાં રહેલા વિદ્યુતઅવિભાજ્ય અથવા વિદ્યુતઅવિભાજય દ્રાવ્યની સાંદ્રતા તેમ જ દ્રાવ્યના અણુઓના સ્વભાવ ૫૨ રહેલો છે.
જવાબ
(A, B)
કારણ કે…
(i) તે દ્રાવ્યના સ્વભાવ પર આધારિત નથી.
(ii) તે દ્રાવ્યના કણોની સંખ્યા પર આધારિત છે.
(iii) તે વિદ્યુતઅવિભાજ્ય દ્રાવણની સાંદ્રતા પર આધારિત છે.
તેથી (A) અને (B) સાચાં છે.
પ્રશ્ન 4.
વૉન્ટ હૉફ અવયવ (i)ની અભિવ્યક્તિ …………………….. દ્વારા કરવામાં આવે છે.

જવાબ
(A, C)
પ્રશ્ન 5.
સમઅભિસારી દ્રાવણોમાં …………………. સમાન હોવું જોઈએ.
(A) દ્રાવ્ય
(B) ઘનતા
(C) ઉત્કલનબિંદુ ઉન્નયન
(D) ઠારબિંદુ અવનયન
જવાબ
(C, D)
- આઇસોટોનિક (સમઅભિસારી) દ્રાવણ એ સમાન અભિસરણ દબાણ અને સમાન સાંદ્રતા ધરાવે છે અને ઉત્કલનબિંદુમાં વધારો અને ઠારબિંદુમાં થતો ઘટાડો સંખ્યાત્મક ગુણધર્મ છે.
- આ સંખ્યાત્મક ગુણધર્મ એ સાંદ્રતા પર આધારિત છે.
પ્રશ્ન 6.
નીચેનાં દ્વિઅંગી મિશ્રણમાંથી કયામાં પ્રવાહી અને બાષ્પ ફેઝમાં સમાન સંઘટન હશે ?
(A) બેન્ઝિન-ટોલ્યુઇન
(B) પાણી-નાઇટ્રિક ઍસિડ
(C) પાણી-ઇથેનોલ
(D) n-હેક્ઝેન-n-હેપ્ટેન
જવાબ
(B, C)
- સમાન રચના ધરાવતા મિશ્રણને એઝિયોટ્રોપ કહેવામાં આવે છે તે સમાન તાપમાને ઉકળે છે.
- અહીં, પાણી-HNO3 અને પાણી-ઇથેનોલનું મિશ્રણ એ બિનઆદર્શ દ્રાવણ છે. તેથી તે એઝિયોટ્રોપિકના ઉદાહરણ છે.
![]()
પ્રશ્ન 7.
સમઅભિસારી દ્રાવણમાં …………………………
(A) દ્રાવ્ય અને દ્રાવક બંને સમાન હોય છે.
(B) અભિસરણ દબાણ સમાન હોય છે.
(C) દ્રાવ્ય અને દ્રાવક સમાન હોઈ પણ શકે અથવા ના પણ હોઈ શકે.
(D) દ્રાવ્ય હંમેશાં સમાન હોય છે પરંતુ દ્રાવક જુદું હોઈ શકે.
જવાબ
(B, C)
સમાન અભિસરણ દબાણ ધરાવતા બે દ્રાવણોને આઇસોટોનિક દ્રાવણ કહે છે. દ્રાવ્ય અને દ્રાવકના કણો સમાન અથવા અસમાન હોઈ શકે પરંતુ અભિસરણ દબાણ સમાન જ હોય.
પ્રશ્ન 8.
દ્વિઅંગી આદર્શ પ્રવાહી દ્રાવણ માટે, કુલ બાષ્પદબાણ વિરુદ્ધ દ્રાવણના સંઘનનો ફેરફાર કયા વક્ર દ્વારા આપવામાં આવે છે ?
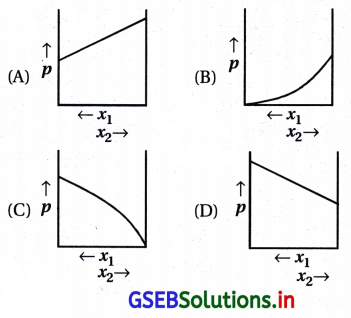
જવાબ
(A, D)
કોઈ એક પદાર્થ મોલ અંશમાં વધારો કરવામાં આવે તો કુલ બાષ્પદબાણમાં વધારો અથવા ઘટાડો થાય છે.
પ્રશ્ન 9.
સંખ્યાત્મક ગુણધર્મો જોવા મળે છે જ્યારે ……………….
(A) અબાષ્પશીલ ઘનને બાષ્પશીલ પ્રવાહીમાં ઓગાળવામાં આવે છે ત્યારે.
(B) અબાષ્પશીલ પ્રવાહીને અન્ય બાષ્પશીલ પ્રવાહીમાં ઓગાળવામાં આવે છે ત્યારે.
(C) વાયુને અબાષ્પશીલ પ્રવાહીમાં ઓગાળવામાં આવે છે ત્યારે.
(D) બાષ્પશીલ પ્રવાહીને અન્ય બાષ્પશીલ પ્રવાહીમાં ઓગાળવામાં આવે છે ત્યારે.
જવાબ
(A, B)
દ્રાવ્ય અથવા દ્રાવક બંનેમાંથી એક સંયોજન બાષ્પશીલ હોવું જોઈએ તેથી આદર્શ વર્તણૂકમાં થતું વિચલન અને દ્રાવણનું બાષ્પદબાણ એ સંખ્યાત્મક ગુણધર્મો માપી શકે છે.
ટૂંક જવાબી પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
બે પ્રવાહીઓ A અને B ના દ્વિઅંગી મિશ્રણનાં ઘટકોને નિસ્યંદન દ્વારા અલગ પાડવામાં આવી રહ્યાં હતાં. થોડીક વાર પછી ઘટકોનું અલગીકરણ બંધ પડી ગયું અને બાષ્પ ફેઇઝમાં સંઘટન પ્રવાહી ફેઇઝ જેટલું થઈ ગયું. બંને ઘટકો નિસ્યંદિત થવા લાગ્યા. આવું શા માટે થયું તે સમજાવો.
ઉત્તર:
નિસ્યંદનમાં બંને સંયોજનો દેખાય છે અને પ્રવાહી અને વાયુની રચના એકસમાન થાય છે. જે દર્શાવે છે કે પ્રવાહી એઝિયોટ્રોપિક મિશ્રણ બનાવે છે અને અચળ તાપમાને ઉકળે છે. તેથી નિસ્યંદનથી અલગ થઈ શકતા નથી.
પ્રશ્ન 2.
સમજાવો કે શા માટે 1 મોલ NaCl ને 1 લિટર પાણીમાં ઉમેરવામાં આવે ત્યારે પાણીનું ઉત્કલનબિંદુ વધે છે, જ્યારે 1 મોલ મિથાઇલ આલ્કોહોલને 1 લિટર પાણીમાં ઉમેરવામાં આવે ત્યારે પાણીનું ઉત્કલનબિંદુ ઘટે છે.
ઉત્તર:
NaCl એ અબાષ્પશીલ છે તેથી પાણીમાં ઉમેરતાં પાણીનું બાષ્પદબાણ ઘટે છે. તેથી પાણીનું ઉત્કલનબિંદુ વધે છે. જ્યારે મિથેનોલ એ વધુ બાષ્પશીલ છે તેથી તેને પાણીમાં ઉમેરતાં દ્રાવણનું કુલ બાષ્પદબાણ વધે છે તેથી પાણીનું ઉત્કલનબિંદુ ઘટે છે.
પ્રશ્ન 3.
દ્રાવ્યતા નિયમ “સરખા, સરખામાં ઓગળે છે”ને દ્રાવણમાં અસ્તિત્વ ધરાવતાં આંતરઆણ્વિય બળોના સંદર્ભમાં સમજાવો.
ઉત્તર:
- ધ્રુવીય / આયોનિક દ્રાવ્ય પદાર્થો એ ધ્રુવીય દ્રાવકમાં ઓગળે છે. તે જ રીતે અધ્રુવીય દ્રાવ્ય પદાર્થ અધ્રુવીય દ્રાવકમાં ઓગળે છે.
- જો આંતરઆણ્વિય પારસ્પરિક ક્રિયાઓ બંનેમાં સરખી હશે તો કહી શકાય કે સરખા, સરખામાં ઓગળે છે.
![]()
પ્રશ્ન 4.
સાંદ્રતા દર્શાવતાં પદો જેવાં કે દળ ટકાવારી ppm, મોલ અંશ તથા મોલાલિટી તાપમાનથી સ્વતંત્ર છે, જોકે મોલારિટી એ તાપમાનનું વિધેય છે. સમજાવો.
ઉત્તર:
- 1 લિટર દ્રાવણમાં દ્રાવ્ય થયેલા મોલની સંખ્યાને મોલારિટી કહે છે. તેથી કદ એ તાપમાન ઉપર આધારિત છે અને તાપમાન બદલાતાં કદ બદલાય છે. તેથી મોલારિટી પણ T બદલાતાં બદલાય છે.
- જ્યારે T બદલાતાં વજન બદલાતું નથી તેથી બીજી અન્ય આપેલ સાંદ્રતાઓ વજન ૫ર આધારિત હોવાથી T થી સ્વતંત્ર છે.
પ્રશ્ન 5.
હેન્રીના નિયમના અચળાંક KH નું મહત્ત્વ શું છે ?
ઉત્તર:
- હેન્રીના નિયમ મુજબ; p ∝ x ∴ P = KH · x
- જો KH નું મૂલ્ય વધે તો વાયુની પ્રવાહીમાં દ્રાવ્યતા ઘટે છે. તેથી વાયુની પ્રવાહીમાં દ્રાવ્યતા દબાણ વધવાની સાથે વધે છે.
પ્રશ્ન 6.
શા માટે ગરમ પાણીની તુલનામાં ઠંડું પાણી જલજ સ્પિસીઝ માટે વધુ અનુકૂળ રહે છે ?
ઉત્તર:
- જલીય ઘટકો ઠંડા પાણીમાં વધુ અનુકૂળ છે. કારણ કે તેમાં વધુ O2 હાજર હોય છે.
- પાણીમાં ઑક્સિજનની દ્રાવ્યતા તાપમાનમાં ઘટાડાની સાથે સાથે વધે છે. સાથે આપેલ વાયુની પ્રવાહીમાં દ્રાવ્યતા તાપમાનના વધારાની સાથે ઘટે છે.
પ્રશ્ન 7.
(a) નીચેની ઘટનાઓ હેન્રીના નિયમની મદદથી સમજાવો.
(i) બેન્ડ્સ(bends) તરીકે ઓળખાતી પીડાકારક પરિસ્થિતિ
(ii) ઊંચાઈએ શ્વાસ લેવામાં તકલીફ અને નિર્બળતા અનુભવવી.
(b) ઓરડાના તાપમાને રાખેલી સોડાવૉટરની બાટલી ખોલતાં શા માટે ઊભરા આવે છે ?
ઉત્તર:
(a)
(i) સ્કુબા ડાઇવર અંતર્જલમાં ઊંચા દબાણે જ્યારે શ્વસન કરે છે ત્યારે ઓગળેલા વાયુઓની ઊંચી સાંદ્રતા સાથે મેળ પાડવો પડે છે. દબાણનો વધા૨ો લોહીમાં વાયુઓની દ્રાવ્યતા વધારે છે જ્યારે મરજીવા સપાટી પર આવે છે ત્યારે દબાણ ધીમે ધીમે ઘટે છે. આ ઓગળેલા વાયુને મુક્ત કરે છે અને લોહીમાં N2 ના પરપોટા પેદા કરે છે જે કેશનળીઓને બંધ કરે છે અને તે પરિસ્થિતિ બેન્ડ્સ રચે છે જે પીડાકારી હોય છે.
(ii) વધુ ઊંચાઈએ O2 નું આંશિક દબાણ ઓછું હોય છે જે વધુ ઊંચાઈએ રહેતા લોકો લોહી અને પેશીમાં ઑક્સિજનની ઓછી સાંદ્રતા તરફ દોરી જાય છે જેથી શ્વસનમાં તકલીફ અને નબળાઈ અનુભવાય છે.
(b) ઓરડાના તાપમાને સોડાની બૉટલ ખોલતાં તેમાં અંદરના અને બહારના આંશિક દબાણના લીધે પરપોટા જોવા મળે છે. બૉટલ ખોલવામાં આવે ત્યારે દ્રાવણમાં CO2નું આંશિક દબાણ ઘટે છે તેથી દ્રાવ્યતા ઘટે છે અને પરપોટા બહાર નીકળે છે.
પ્રશ્ન 8.
ગ્લુકોઝના જલીય દ્રાવણનું બાષ્પદબાણ પાણીના બાષ્પદબાણ કરતાં ઓછું શા માટે હોય છે ?
ઉત્તર:
શુદ્ધ પ્રવાહીની સંપૂર્ણ સપાટી પાણીના અણુઓ દ્વારા ઘેરાયેલી છે. અબાષ્પશીલ દ્રાવ્ય ગ્લુકોઝને પાણીમાં ઓગાળતા પાણીના અણુ દ્વારા રોકાયેલ સપાટી ઘટે છે તેથી સપાટી છોડી જતા અણુઓની સંખ્યા ઘટે છે અને ગ્લુકોઝના જલીય દ્રાવણનું બાષ્પદબાણ ઘટે છે.
પ્રશ્ન 9.
પર્વતીય વિસ્તારોમાં બરફથી ઢંકાયેલા રસ્તા પર મીઠું છાંટવાથી કેવી રીતે રસ્તા ખુલ્લા થાય છે ? આ ક્રિયામાં સંકળાયેલી ઘટના સમજાવો.
ઉત્તર:
પર્વતીય વિસ્તારોમાં બરફથી ઢંકાયેલા રસ્તા ખુલ્લા કરવા તેમની પર મીઠાનો છંટકાવ કરવામાં આવે છે કારણ કે આમ કરવાથી ઠારબિંદુમાં ઘટાડો થતાં બરફ ઝડપથી પીગળે છે અને રસ્તાઓ ખુલ્લા થાય છે.
![]()
પ્રશ્ન 10.
અર્ધપારગમ્ય પડદો એટલે શું ?
ઉત્તર:
જાળીદાર રચના ધરાવતા ફિલ્મ અથવા શીટ જેવા દેખાતા સાંશ્લેષિત પડદા કે જે ઉપસૂક્ષ્મીય કાણાં અથવા છિદ્રો ધરાવે છે. પાણી જેવા દ્રાવકના નાના અણુઓમાંથી પસાર થાય છે. પણ દ્રવ્યના અણુઓ અટકી જાય છે. આ રચના ધરાવતા પડદાને અર્ધપારગમ્ય પડદો કહે છે.
પ્રશ્ન 11.
પ્રતિઅભિસરણ કરવા વપરાતા અર્ધપારગમ્ય પડદા બનાવવામાં ઉપયોગમાં લેવાતા પદાર્થનું ઉદાહરણ આપો.
ઉત્તર:
પ્રતિઅભિસરણ માટે ઘણું ઊંચું દબાણ જરૂરી હોય છે. તેથી સામાન્ય રીતે વપરાતો છિદ્રાળુ પડદો યોગ્ય આધાર પર ગોઠવેલ સેલ્યુલોઝ એસિટેટની ફિલ્મ હોય છે. સેલ્યુલોઝ પાણી માટે પારગમ્ય છે અને બીજી અશુદ્ધિઓ માટે બિનપારગમ્ય છે. તેથી દરિયાઈ પાણીમાંથી ક્ષાર/અશુદ્ધિઓ દૂર કરવા માટે ઉપયોગી છે.
જોડકાં પ્રકારના પ્રશ્નો
નીચેના કેટલાંક પ્રશ્નોમાં ડાબી બાજુની કૉલમનો એક વિકલ્પ જમણી બાજુની કૉલમના એક અથવા એકથી વધુ વિકલ્પો સાથે સંલગ્ન હોઈ શકે છે.
પ્રશ્ન 1.
કૉલમ – I અને કૉલમ – II માં આપેલી વિગતો જોડો.
| કોલમ – I | કૉલમ – II |
| (A) સંતૃપ્ત દ્રાવણ | (1) આપેલા તાપમાને આપેલા દ્રાવણ જેટલુ અભિસરણ દબાણ ધરાવતું દ્રાવણ |
| (B) દ્વિઅંગી દ્રાવણ | (2) એવું દ્રાવણ કે જેનું અભિસરણ દબાણ અન્યના કરતાં ઓછું હોય. |
| (C) સમઅભિસારી દ્રાવણ | (3) બે ઘટકોવાળું દ્રાવણ |
| (D) હાઈપોટોનિક દ્રાવણ | (4) આપેલા તાપમાને આપેલા જથ્થાના દ્રાવકમાં મહત્તમ પ્રમાણમાં દ્રાવ્ય ઓગળેલો હોય તેવું દ્રાવણ |
| (E) ઘન દ્રાવણ | (5) એવું દ્રાવણ કે જેનું અભિસરણ દબાણ અન્યના કરતાં વધારે હોય. |
| (F) અતિઅભિસારી દ્રાવણ | (6) ઘન ફેઇઝમાં રહેલું દ્રાવણ |
ઉત્તર:
| કોલમ – I | કૉલમ – II |
| (A) સંતૃપ્ત દ્રાવણ | (4) આપેલા તાપમાને આપેલા જથ્થાના દ્રાવકમાં મહત્તમ પ્રમાણમાં દ્રાવ્ય ઓગળેલો હોય તેવું દ્રાવણ |
| (B) દ્વિઅંગી દ્રાવણ | (3) બે ઘટકોવાળું દ્રાવણ |
| (C) સમઅભિસારી દ્રાવણ | (1) આપેલા તાપમાને આપેલા દ્રાવણ જેટલુ અભિસરણ દબાણ ધરાવતું દ્રાવણ |
| (D) હાઈપોટોનિક દ્રાવણ | (2) એવું દ્રાવણ કે જેનું અભિસરણ દબાણ અન્યના કરતાં ઓછું હોય. |
| (E) ઘન દ્રાવણ | (6) ઘન ફેઇઝમાં રહેલું દ્રાવણ |
| (F) અતિઅભિસારી દ્રાવણ | (5) એવું દ્રાવણ કે જેનું અભિસરણ દબાણ અન્યના કરતાં વધારે હોય. |
પ્રશ્ન 2.
કૉલમ – I માં આપેલી વિગતોને કોલમ – II માં આપેલાં દ્રાવણોના પ્રકાર સાથે જોડો.
| કોલમ – I | કોલમ – II |
| (A) સોડાવૉટર | (1) વાયુનું ઘનમાં દ્રાવણ |
| (B) ખાંડનું દ્રાવણ | (2) વાયુનું વાયુમાં દ્રાવણ |
| (C) જર્મનસિલ્વર | (૩) ઘનનું પ્રવાહીમાં દ્રાવણ |
| (D) હવા | (4) ઘનનું ઘનમાં દ્રાવણ |
| (E) પેલિડિયમમાં હાઇડ્રોજન વાયુ | (5) વાયુનું પ્રવાહીમાં દ્રાવણ |
| (6) પ્રવાહીનું ઘનમાં દ્રાવણ |
ઉત્તર:
| કોલમ – I | કોલમ – II |
| (A) સોડાવૉટર | (5) વાયુનું પ્રવાહીમાં દ્રાવણ |
| (B) ખાંડનું દ્રાવણ | (૩) ઘનનું પ્રવાહીમાં દ્રાવણ |
| (C) જર્મનસિલ્વર | (4) ઘનનું ઘનમાં દ્રાવણ |
| (D) હવા | (2) વાયુનું વાયુમાં દ્રાવણ |
| (E) પેલિડિયમમાં હાઇડ્રોજન વાયુ | (1) વાયુનું ઘનમાં દ્રાવણ |
પ્રશ્ન 3.
કૉલમ – Iમાં આપેલા નિયમોને કૉલમ – IIમાં આપેલી અભિવ્યક્તિઓ સાથે જોડો.
| કોલમ – I | કોલમ – II |
| (A) રાઉલ્ટનો નિયમ | (1) ΔTf = Kfm |
| (B) હેન્રીનો નિયમ | (2) π = CRT |
| (C) ઉત્કલનબિંદુ ઉન્નયન | (3) p = x1\(p_1^0\) + x2\(p_2^0\) |
| (D) ઠારબિંદુમાં અવનયન | (4) ΔTb = Kbm |
| (E) અભિસરણ દબાણ | (5) p = KH · X |
ઉત્તર:
| કોલમ – I | કોલમ – II |
| (A) રાઉલ્ટનો નિયમ | (3) p = x1\(p_1^0\) + x2\(p_2^0\) |
| (B) હેન્રીનો નિયમ | (5) p = KH · X |
| (C) ઉત્કલનબિંદુ ઉન્નયન | (4) ΔTb = Kbm |
| (D) ઠારબિંદુમાં અવનયન | (1) ΔTf = Kfm |
| (E) અભિસરણ દબાણ | (2) π = CRT |
![]()
પ્રશ્ન 4.
કોલમ – Iમાં આપેલાં પદોને કૉલમ – IIમાં આપેલી અભિવ્યક્તિઓ સાથે જોડો.

ઉત્તર:
(A – 4), (B – 3), (C – 2), (D – 5), (E – 1)
વિધાન અને કારણ પ્રકારના પ્રશ્નો
નીચેના પ્રશ્નોમાં વિધાન (A) અને ત્યાર પછી કારણ (R) આપેલું છે. પ્રશ્નોની નીચે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરો.
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
(B) વિધાન (A) અને કારણ (B) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે. (D) વિધાન (A) અને કારણ (R) બંને ખોટાં છે.
(E) વિધાન (A) ખોટું પરંતુ કારણ (R) સાચું છે.
પ્રશ્ન 1.
વિધાન (A) : પ્રવાહી-અવસ્થામાં દ્રાવણની મોલારિટી તાપમાન સાથે બદલાય છે.
કારણ (R) : તાપમાન બદલાતા દ્રાવણનું કદ બદલાય છે.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
તાપમાન બદલાતા દ્રાવણનું કદ બદલાય છે. તેથી દ્રાવણની મોલારિટી એ તાપમાન સાથે બદલાય છે.

પ્રશ્ન 2.
વિધાન : જ્યારે પાણીમાં મિથાઇલ આલ્કોહોલ ઉમેરવામાં આવે ત્યારે પાણીનું ઉત્કલનબિંદુ વધે છે.
કારણ : જ્યારે બાષ્પશીલ દ્રાવકમાં બાષ્પશીલ દ્રાવ્ય ઉમેરવામાં આવે ત્યારે ઉત્કલનબિંદુમાં વધારો જોવા મળે છે.
જવાબ
(D) વિધાન (A) અને કારણ (B) બંને ખોટાં છે.
જ્યારે મિથેનોલને પાણીમાં ઉમેરવામાં આવે ત્યારે પાણીનું ઉત્કલનબિંદુ ઘટે છે કારણ કે જયારે બાષ્પશીલ દ્રાવ્યને બાષ્પશીલ દ્રાવકમાં ઉમેરવામાં આવે ત્યારે ઉત્કલનબિંદુ વધે છે.
પ્રશ્ન 3.
વિધાન (A) : જ્યારે પાણીમાં NaCl ઉમેરવામાં આવે ત્યારે ઠારબિંદુમાં ઘટાડો થતો જોવા મળે છે.
કારણ (R) : દ્રાવણના બાષ્પદબાણમાં થતાં ઘટાડાને કારણે ઠારબિંદુ ઘટે છે.
જવાબ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
જ્યારે NaCl ને પાણીમાં ઉમેરવામાં આવે ત્યારે ઠારબિંદુ ઘટે છે. કારણ કે દ્રાવણના બાષ્પદબાણમાં ઘટાડો થાય છે. દ્રાવ્ય અને દ્રાવકના ઘટક કણો વચ્ચે લાગતા આંતરઆણ્વિય આકર્ષણ બળને લીધે બાષ્પદબાણમાં ઘટાડો થાય છે.
પ્રશ્ન 4.
વિધાન (A) : જ્યારે અર્ધપારગમ્ય પડદા વડે દ્રાવણ અને શુદ્ધ દ્રાવકને અલગ પાડવામાં આવે ત્યારે, દ્રાવકના અણુઓ તેની મારફતે શુદ્ધ દ્રાવકવાળી બાજુથી દ્રાવણવાળી બાજુ તરફ પસાર થાય છે.
કારણ (R) : દ્રાવકનું પ્રસરણ ઊંચી સાંદ્રતાવાળા દ્રાવણના પ્રદેશ તરફથી નીચી સાંદ્રતાવાળા દ્રાવણના પ્રદેશ તરફ થાય છે.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ, કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
દ્રાવકના અણુઓ હંમેશાં ઓછી સાંદ્રતાથી વધુ સાંદ્રતા ધરાવતા દ્રાવણ તરફ વહે છે.
![]()
સવિસ્તર પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
દ્રાવણની સાંદ્રતા વ્યક્ત કરવાની નીચેની રીતો વ્યાખ્યાયિત કરો. તેમાંની કઈ રીતો તાપમાનથી સ્વતંત્ર છે અને શા માટે ?
(i) w/w (દળ ટકાવારી)
(ii) V/V (કદ ટકાવારી)
(iii) w/V (દળ-કદ ટકાવારી)
(iv) ppm (પાર્ટ્સ પર મિલિયન)
(v) X (મોલ અંશ)
(vi) M (મોલારિટી)
(vii) m (મોલાલિટી)
ઉત્તર:
(i) w/w (દળ ટકાવારી)
w/w%, ppm (વજનથી), m અને ૪ એ તાપમાનથી સ્વતંત્ર છે, કારણ કે તે વજન ઉપર આધારિત છે. જ્યારે M, w/V%, V/V% એ તાપમાન સાથે બદલાય છે, કારણ કે તે કદ ઉપર આધારિત છે.
(ii) V/V (કદ ટકાવારી)
- 100 mL દ્રાવણમાં દ્રાવ્ય થયેલા પદાર્થના કદને કદથી ટકાવારી (%V/V) કહે છે.
% V/V = × 100
× 100 - દા.ત., 10% V/V ઇથેનોલ દ્રાવણનો અર્થ થાય છે કે 10 મિલી ઇથેનોલને પાણીમાં ઓગાળવાથી મળેલું 100 મિલી દ્રાવણ.
- જો દ્રાવ્ય અને દ્રાવક બંને પ્રવાહી અવસ્થામાં હોય તો, તેમના મિશ્રણથી બનતા પ્રવાહી દ્રાવણની સાંદ્રતાને % V/V ના એકમમાં દર્શાવાય છે.
- 35% V/V ઇથીલીન ગ્લાયકોલનું દ્રાવણ જે એક પ્રતિહિમ (હિમનિરોધી) છે. તે કારમાં (મોટરો) એન્જિનના શીતન માટે વપરાય છે. આ સાંદ્રતા એ પ્રતિહિમ પાણીનું ઠારણબિંદુ ઘટાડીને 255.4 K (-17.6°C) લાવે છે.
(iii) w/V (દળ-કદ ટકાવારી)
- દળ/કદ ટકાવારી (% w/V) : 100 મિલી દ્રાવણમાં ઓગાળેલા દ્રાવ્ય પદાર્થના વજન (ગ્રામ)ને વજન-કદથી ટકાવારી કહે છે.
% w/V = × 100
× 100 - આ એકમ સામાન્ય રીતે ઔષધિ અને ઔષધિનિર્માણ વિજ્ઞાન (ફાર્મસી)માં વપરાય છે.
- દળ ટકાવારી (% w/w) : 100 ગ્રામ દ્રાવણમાં દ્રાવ્ય થયેલા પદાર્થના વજનને વજનથી ટકાવારી (% w/w) કહે છે.
% w/w = × 100
× 100 - દળ ટકાવારી વડે દર્શાવેલ સાંદ્રતા સામાન્ય રીતે ઔદ્યોગિક રાસાયણિક અનુપ્રયોગમાં ઉપયોગી છે. ઉદાહરણ તરીકે, બજારુ બ્લીચિંગ દ્રાવણ 3.62 દળ ટકા સોડિયમ હાઇપોક્લોરાઇટ પાણીમાં ધરાવે છે.
(iv) ppm (પાર્ટ્સ પર મિલિયન)
- જ્યારે દ્રાવણમાં દ્રાવ્ય અતિઅલ્પ જથ્થામાં હોય ત્યારે તેની સાંદ્રતા પાર્ટ્સ પર મિલિયન વડે દર્શાવાય છે.
પાર્ટ્સ પર મિલિયન = × 106s
× 106s - સાંદ્રતા ppmને દળથી દળ, કદથી કદ અને દળથી કદમાં પણ દર્શાવી શકાય છે.
- પાણીમાં અથવા વાતાવરણમાં પ્રદૂષકોની સાંદ્રતા સામાન્ય રીતે μg mL-1 અથવા ppm પર્યાયમાં દર્શાવાય છે. જેમ કે, 1 લિટર દરિયાનું પાણી (જેનું વજન 1030 g છે) 6 × 10<-3/sup>g દ્રાવ્ય O2, ધરાવે છે. આટલી ઓછી સાંદ્રતાને 5.8 g પ્રતિ 1066g (એટલે કે g g 5.8 ppm) દરિયાના પાણી તરીકે દર્શાવી શકાય છે.
(v) X (મોલ અંશ)
- વ્યાખ્યા : દ્રાવણના કોઈ એક ઘટકના મોલ અને કુલ મોલના ગુણોત્તરને તે ઘટકના મોલ અંશ કહે છે.
- મોલ અંશ માટે સામાન્ય રીતે વપરાતી સંજ્ઞા x છે અને x ની જોડે જમણી બાજુ ઘટક દર્શાવવામાં આવે છે.
ઘટકનો મોલ અંશ =
- એક દ્વિઅંગી મિશ્રણમાં જો Aની મોલ સંખ્યા અને Bની મોલ
સંખ્યા અનુક્રમે nA અને nB હોય તો Aનો મોલ અંશ થશે,
xA = \(\frac{n_{\mathrm{A}}}{n_{\mathrm{A}}+n_{\mathrm{B}}}\)
‘i’ સંખ્યાના ઘટકો ધરાવતા દ્રાવણ માટે,
xi = \(\frac{n_i}{n_1+n_2+\ldots \ldots+n_i}=\frac{n_i}{\Sigma n_i}\) - આપેલા દ્રાવણમાં બધા જ મોલ અંશનો સરવાળો હંમેશાં એક થાય છે એટલે કે x1 + x2 + …… + xi = 1
- મોલ અંશ એ દ્રાવણની સાંદ્રતા અને બાષ્પદબાણ અને વાયુ મિશ્રણો સમાવિષ્ટ દ્રાવણની સાંદ્રતાનું વર્ણન કરવામાં ઘણો જ ઉપયોગી કે તાપમાનથી સ્વતંત્ર છે.
(vi) M (મોલારિટી)
મોલારિટી : એક લિટર (એક ક્યુબિક ડેસિમીટર) દ્રાવણમાં ઓગાળેલા દ્રાવ્યના મોલની સંખ્યાને મોલારિટી (M) કહે છે.
મોલારિટી (M) = 
દા.ત., 0.25 M NaOHનું દ્રાવણ એટલે 0.25 mol NaOH 1 લિટર દ્રાવણમાં દ્રાવ્ય છે.
(vii) m (મોલાલિટી)
મોલાલિટી (m) : એક કિલોગ્રામ દ્રાવકમાં ઓગાળેલ દ્રાવ્યના મોલની સંખ્યાને મોલાલિટી કહે છે.
મોલાલિટી (m) = 
દા.ત., 1 m KClનું દ્રાવણ એટલે 1 મોલ KCl 1 kg પાણીમાં ઓગાળેલ છે.
પ્રશ્ન 2.
નીચેનાં દ્રાવણોમાં દ્રાવણનું બાષ્પદબાણે તેનાં ઘટકોના મોલ અંશ સાથે કેવી રીતે સંકળાયેલું છે તે રાઉલ્ટના નિયમનો ઉપયોગ કરીને સમજાવો :
(i) CHCl3(l) અને CH2Cl3(l)
(ii) NaCl(s) અને H2O(l)
ઉત્તર:
રાઉલ્ટના નિયમ મુજબ p1 = \(p_1^0\) · x1
(i) CHC3(l) અને CH2Cl2(l) બંને બાષ્પશીલ સંયોજનો છે. તેથી દ્વિઅંગી દ્રાવણમાં બંને સંયોજનો બાષ્પશીલ પ્રવાહી છે.
જ્યાં, p = કુલ બાષ્પદબાણ
P1 = સંયોજન 1 નું આંશિક બાષ્પદબાણ
P2 સંયોજન 2 નું આંશિક બાષ્પદબાણ
∴ કુલ દબાણ p = p1 + P2
= x1 \(p_1^0\) + x2 \(p_2^0\)
= (\(p_1^0\) – \(p_2^0\)) x1 + \(p_2^0\)
(ii) NaCl(s) અને H2O(l) બંને અબાષ્પશીલ સંયોજનો છે. તેથી આ દ્રાવણ એ અબાષ્પશીલ દ્રાવ્ય ધરાવે છે અને રાઉલ્ટનો નિયમ એ ફક્ત બાષ્પશીલ સંયોજનો માટે જ ઉપયોગી છે.
∴ કુલ દબાણ p = p1 = x1 \(p_1^0\)
![]()
પ્રશ્ન 3.
પ્રવાહી દ્રાવણોના અણુઓ વચ્ચે પ્રવર્તતાં આંતરક્રિયાત્મક બળોના સંદર્ભમાં આદર્શ અને બિનઆદર્શ દ્રાવણો સમજાવો.
ઉત્તર:
- જે દ્રાવણ કોઈ પણ સાંદ્રતાએ રાઉલ્ટના નિયમનું પાલન કરે તેવા દ્રાવણને આદર્શ દ્રાવણ કહે છે.
- દ્રાવ્ય અને દ્રાવક મિશ્ર થઈ આદર્શ દ્રાવણ બને ત્યારે મિશ્રણની ઍન્થાલ્પી શૂન્ય (Δmix H = 0) હોય છે અને મિશ્રણનું કદ પણ શૂન્ય (Δmix V = 0) હોય છે.
- જ્યારે ઘટકોને મિશ્ર કરવામાં આવે ત્યારે ઉષ્મા શોષાતી પણ નથી અને ઉત્પન્ન પણ થતી નથી. દ્રાવણનું કદ બંને ઘટકોના કદના સરવાળા બરાબર થશે.
- આદર્શ દ્રાવણના ઘટકો A અને B છે. તો આ શુદ્ધ ઘટકોમાં આંતરઆણ્વીય આકર્ષણ પારસ્પરિક ક્રિયા A-A અને B-B પ્રકારની હશે. જ્યારે દ્વિઅંગી દ્રાવણમાં A-B પ્રકારની ક્રિયા પણ હાજર હશે.
- આદર્શ દ્રાવણમાં A-A અને B-B વચ્ચેના આંતરઆણ્વીય આકર્ષણ બળ અને A-B વચ્ચેના આંતરઆણ્વીય આકર્ષણ બળો લગભગ સમાન હોય છે. ઉદા. n-હેક્ઝેન અને n-હેપ્ટન, બ્રોમોઇથેન અને ક્લોરોઇથેન, બેન્ઝિન અને ટૉલ્યુઇન.
- જયારે દ્રાવણો સાંદ્રતાના સમગ્ર ગાળા દરમિયાન રાઉલ્ટના નિયમનું પાલન કરતા નથી ત્યારે તેને બિનઆદર્શ દ્રાવણ કહે છે.
- આવા દ્રાવણના બાષ્પદબાણ રાઉલ્ટના નિયમ પ્રમાણે અનુમાનિત કરેલા બાષ્પદબાણ કરતાં વધારે અથવા ઓછું હોય છે. જો તે વધારે હોય તો દ્રાવણ ધન વિચલન દર્શાવે છે અને જો ઓછું હોય તો, રાઉલ્ટના નિયમથી ઋણ વિચલન દર્શાવે છે.
- ધન વિચલન :

- રાઉલ્ટના નિયમથી ધન વિચલનની બાબતમાં A-B પારસ્પરિક ક્રિયાઓ A-A અથવા B-B કરતાં નબળી હોય છે. આ કિસ્સામાં આવા દ્રાવણોમાં A અથવા B ના અણુઓ શુદ્ધ અવસ્થા કરતાં વધુ સરળતાથી છટકી શકશે. આ બાષ્પદબાણમાં વધારો કરશે અને ધન વિચલનમાં પરિણમશે.
ઉદાહરણ : ઇથેનોલ અને એસિટોન - શુદ્ધ ઇથેનોલમાં અણુઓ હાઇડ્રોજન બંધિત હોય છે તેમાં એસિટોન ઉમેરવાથી તેના અણુઓ યજમાનની વચ્ચે ગોઠવાય છે અને તેમની વચ્ચેના H બંધ તોડી નાખે છે. પારસ્પરિક ક્રિયા નબળી થવાના લીધે દ્રાવણ ધન વિચલન દર્શાવે છે. અન્ય ઉદાહરણમાં CS2 અને એસિટોન
- ઋણ વિચલન :

- રાઉલ્ટના નિયમથી ઋણ વિચલનની બાબતમાં A-A અને B-B વચ્ચેના આંતરઆણ્વીય આકર્ષણ બળો A-B વચ્ચેના આંતર આણ્વીય આકર્ષણ બળો કરતાં વધુ નિર્બળ હોય છે જેને લીધે બાષ્પદબાણમાં ઘટાડો થાય છે અને ઋણ વિચલન થાય છે.
ઉદા. (i) ફિનૉલ અને એનિલિન, આ કિસ્સામાં ફિનોલિક પ્રોટૉન અને એનિલિનના નાઇટ્રોજનના અયુમ્મિત હૈં યુગ્મ વચ્ચેના આંતરઆણ્વીય હાઇડ્રોજન બંધ, એક જ પ્રકારના અણુઓ વચ્ચેના આંતરઆણ્વીય H બંધ કરતાં વધુ પ્રબળ હોય છે.
ઉદા. (ii) ક્લોરોફૉર્મ અને એસિટોન. આ સ્સિામાં ક્લોરોફૉર્મ એસિટોન અણુ સાથે H બંધ રચી શકે છે જે નીચે દર્શાવેલ છે :

- આ દરેક ઘટકના અણુઓનું છટકી જવાનું વલણ ઘટાડે છે જેથી બાષ્પદબાણ ઘટે છે અને રાઉલ્ટના નિયમથી ઋણ વિચલન દર્શાવે છે.
પ્રશ્ન 4.
વિભાગીય નિસ્યંદન દ્વારા શુદ્ધ ઇથેનોલ મેળવવું શા માટે શક્ય નથી ? રાઉલ્ટના નિયમથી વિચલન પામતા હોય તથા જેનાં ઘટકોને વિભાગીય નિસ્યંદન વડે અલગ ના પાડી શકાતા હોય તેવાં દ્વિઅંગી મિશ્રણોને શું સામાન્ય નામ આપવામાં આવે છે ? આવાં મિશ્રણોના પ્રકાર કેટલા છે ?
ઉત્તર:
કેટલાક પ્રવાહીઓને મિશ્ર કરતાં એઝિયોટ્રોપ રચે છે જે દ્વિઅંગી મિશ્રણ છે. પ્રવાહી અને બાષ્પ અવસ્થાના સંઘટન જેમાં સરખાં હોય છે અને અચળ તાપમાને ઉકળે છે ત્યારે તેમને અલગ કરવું શક્ય નથી. એઝિયોટ્રોપના બે પ્રકાર છે :
(i) નિમ્નતમ ઉત્કલન એઝિયોટ્રોપ : દ્રાવણો જે રાઉલ્ટના નિયમથી વધુ ધન વિચલન દર્શાવે છે તે વિશિષ્ટ સંઘટને નિમ્નતમ ઉત્કલન એઝિયોટ્રોપ રચે છે.
ઉદા., ઇથેનોલ-પાણીનું વિભાગીય નિસ્યંદન કદથી 95 % ઇથેનોલ ધરાવતું દ્રાવણ આપે છે. આ એઝિયોટ્રોપ સંઘટન પ્રાપ્ત થયા પછી પ્રવાહી અને બાષ્પના સંઘટન સરખાં હોય છે, જેનું અલગીકરણ થતું નથી.
(ii) મહત્તમ ઉત્કલન એઝિયોટ્રોપ : જે દ્રાવણો રાઉલ્ટના નિયમથી વધુ ઋણ વિચલન દર્શાવે છે તે વિશિષ્ટ સંઘટને મહત્તમ ઉત્કલન એઝિયોટ્રોપ રચે છે.
ઉદા., HNO3 (નાઇટ્રિક ઍસિડ) અને પાણી. આ એઝિયોટ્રોપને આશરે સંઘટન દળથી 68% HNO3 અને 32% પાણી હોય છે, જેનું ઉત્કલનબિંદુ 393.5 K છે.
પ્રશ્ન 5.
સૂકી દ્રાક્ષને પાણીમાં રાખવામાં આવે ત્યારે તેનું કદ ફૂલે છે. આકૃતિની મદદથી આમાં સંકળાયેલી ઘટના સમજાવો તથા તેનુ નામ આપો. આ ઘટનાના ત્રણ ઉપયોગો જણાવો.
ઉત્તર:
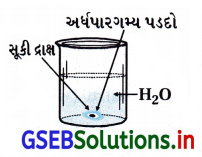
- આ ઘટના અભિસરણની છે. જેમાં આકૃતિમાં દર્શાવ્યા પ્રમાણે સૂકી દ્રાક્ષની અંદર પાણી પ્રવેશતા સૂકી દ્રાક્ષ ફૂલે છે.
- અભિસરણની આ ઘટના જૈવિક અને ઔદ્યોગિક મહત્ત્વ ધરાવે છે. તેમાં (i) અભિસરણના લીધે પાણી વનસ્પતિના મૂળમાંથી ઉપરના ભાગ સુધી પહોંચે છે. (ii) માંસને બૅક્ટેરિયાથી રક્ષણ મેળવવા માટે તેમાં ક્ષાર ઉમરેવામાં આવે છે. (iii) ફળ (ફૂટ)ને બૅક્ટેરિયાથી રક્ષણ મેળવવા માટે તેમાં ખાંડ ઉમેરવામાં આવે છે.
પ્રશ્ન 6.
અભિસરણની જૈવિક તથા ઔધોગિક અગત્ય ચર્ચો.
ઉત્તર:
- પ્રાણીઓના શરીરના જુદા-જુદા ભાગો સુધી પાણી પહોંચે છે જે અભિસરણની ક્રિયા છે.
- પાંદડા અને ફૂલોનું ખીલવું એ પણ અભિસરણ પર આધારિત છે.
- બીજના અંકુરણ અને છોડના ઝડપથી વિકાસ માટે અભિસરણ ઉપયોગી છે.
- વનસ્પતિમાં ફૂલનું ખીલવું અને બંધ થવું એ અભિસરણની ઘટના છે.
પ્રશ્ન 7.
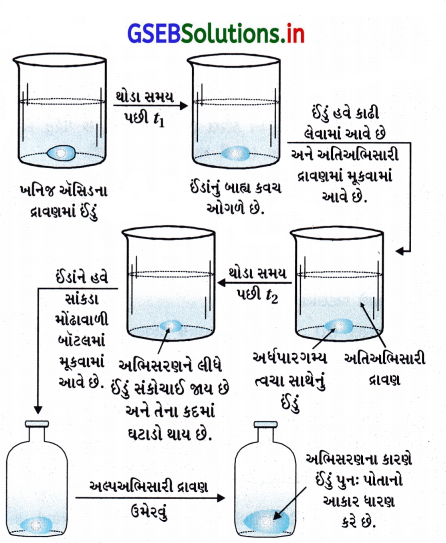
ઈંડાંની અર્ધપારગમ્ય ત્વચાને નુકસાન પહોંચાડ્યા વગર તમે તેના સખત કેલ્શિયમ કાર્બોનેટના સ્તરને કેવી રીતે દૂર કરી શકશો ? શું આ ઈંડાંને સાંકડા મોઢાવાળી બોટલમાં તેનો આકાર વિકૃત કર્યા વગર દાખલ કરી શકાય ? અહીં સંકળાયેલી ક્રિયા સમજાવો.
ઉત્તર:
- જ્યારે ઈંડાંને ઍસિડના દ્રાવણમાં મૂકવામાં આવે ત્યારે તેની બહારના કોષો ઓગળી જાય છે. ત્યારબાદ ઈંડાંને વધુ સાંદ્રતા ધરાવતા હાઇપરટોનિક દ્રાવણમાં મૂકતાં ઈંડાંનું કદ ઘટે છે અને અભિસરણના લીધે ઈંડાંનું સંકોચન થાય છે.
- ત્યારબાદ ઈંડાંને નાના ઢાંકણવાળી બૉટલમાં પસાર કરી શકાય છે. અંતમાં તેમાં હાઇપોટોનિક દ્રાવણ ઉમેરતાં ઈંડાં અભિસરણના લીધે મૂળ આકાર ધારણ કરે છે.
![]()
પ્રશ્ન 8.
કેટલાક દ્રાવ્ય પદાર્થોના કિસ્સામાં સંખ્યાત્મક ગુણધર્મોના માપનથી નક્કી કરેલા મોલર દળ શા માટે અસામાન્ય હોય છે ? વૉન્ટ હૉફ અવયવની મદદથી તેની ચર્ચા કરો.
ઉત્તર:
- વિયોજન : આયનીય સંયોજનોને પાણીમાં ઓગાળવામાં આવે ત્યારે તે ધનઆયન અને ઋણઆયનમાં વિયોજિત થાય છે અને દ્રાવણમાં દ્રાવ્ય કણોની સંખ્યા વધે તો તેને વિયોજન કહે છે.
- ઉદા. KCl ને પાણીમાં ઓગાળતા K+ અને Cl– આયનો એમ બે દ્રાવ્યકણો રચે છે.
- જો એક મોલ KCl એક kg પાણીના ઉત્કલનબિંદુનો વધારો 2 × 0.52 K = 1.04 K કરશે. એટલે કે 2 મોલ કણનું વજન 74.5 ગ્રામ છે અને 1 મોલ KCl નું વજન 37.35 ગ્રામ છે. એટલે, કહી શકાય કે જ્યારે દ્રાવ્યનું આયનમાં વિયોજન થાય ત્યારે પ્રાયોગિક રીતે નક્કી કરેલ મોલરદળ હંમેશાં તેના સાચા મૂલ્ય કરતાં ઓછું હોય છે.
![]()
- સુયોજન :
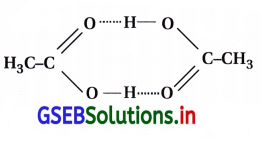
- એસિટિક ઍસિડના બે અણુઓ બેન્ઝિનમાં H બંધને કારણે દ્વિ-અણુ તરીકે હોય છે. આ ઘટના સામાન્ય રીતે નીચા પરાવૈદ્યુત અચળાંક (dielectric constant) (દ્વિ-ધ્રુવી અચળાંક) ધરાવતા દ્રાવકમાં બને છે. આ દ્વિતીયકરણને (dimerisation) કા૨ણે કણોની સંખ્યા ઘટે તો તેને સુયોજન (association) કહે છે.
- આથી કહી શકાય કે જો એસિટિક ઍસિડના બે અણુઓ બેન્ઝિનમાં સુયોજિત થાય તો એસિટિક ઍસિડ માટે ΔTb અથવા ΔTf સામાન્ય મૂલ્યથી અડધું થશે. આ ΔTb અથવા ΔTf ના આધારે ગણેલા મોલ૨ દળ અપેક્ષિત મૂલ્ય કરતાં બમણા થશે.
- આવા મોલર દળ એટલે કે અપેક્ષિત અથવા સામાન્ય મોલર દળ કરતાં ઓછું અથવા વધારે મૂલ્યને અસામાન્ય મોલર દળ કહે છે.
- સાચો અણુભાર મેળવવા માટે વૉન્ટહૉફે અણુભારની ગણતરીના સમીકરણમાં એક વધુ અવયવ દાખલ કર્યો જેને વૉન્ટહૉફ અવયવ ‘i’ કહે છે.

- અહીં, અસામાન્ય મોલરદળ પ્રાયોગિક રીતે નક્કી કરેલું મોલ૨દળ હોય છે.
- જ્યારે સુયોજન થાય ત્યારે i < 1 જ્યારે વિયોજન થાય ત્યારે i > 1
જ્યારે સુયોજન/વિયોજન ન થાય ત્યારે i = 1
ઉદા. KCl માટે i = 2
બેન્ઝિનમાં ઇથેનોઇક ઍસિડ માટે i = 0.5
વૉન્ટહોફ અવયવનો સંખ્યાત્મક ગુણધર્મ માટે \(\frac{p_1^0-p_1}{p_1^0}\) = i\(\frac{n_2}{n_1}\)
ઉત્કલનબિંદુ ઉન્નયન ΔTb = i Kbm
ઠારબિંદુ અવનયન ΔTf = i Kfm
અભિસરણ દબાણ π = i\(\frac{n_2 \mathrm{RT}}{\mathrm{V}}\)