Gujarat Board GSEB Textbook Solutions Class 12 Chemistry Chapter 8 d અને f-વિભાગનાં તત્ત્વો Textbook Questions and Answers.
Gujarat Board Textbook Solutions Class 12 Chemistry Chapter 8 d અને f-વિભાગનાં તત્ત્વો
GSEB Class 12 Chemistry d અને f-વિભાગનાં તત્ત્વો Text Book Questions and Answers
પ્રશ્ન 1.
નીચે દર્શાવેલા આયનોની ઇલેક્ટ્રોનીય રચના લખો :
(i) Cr3+
(ii) Pm3+
(iii) Cu+
(iv) Ce4+
(v) CO2+
(vi) Lu2+
(vii) Mn2+
(viii) Th4+
ઉત્તર:
| ક્રમ | આયન | ઇલેક્ટ્રૉનીય રચના |
| (i) | Cr3+ | [Ar]18 3d3 4s0 |
| (ii) | Pm3+ | [Xe]54 4f4 6s0 |
| (iii) | Cu+ | [Ar]18 3410 4s0 |
| (iv) | Ce4+ | [Xe]54 4f0 6s0 |
| (v) | CO2+ | [Ar]18 3d7 4s0 |
| (vi) | Lu2+ | [Xe]54 4f4 5d1 6s0 |
| (vii) | Mn2+ | [Ar]18 3d5 4s0 |
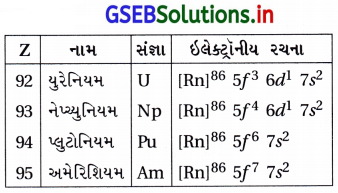
| (viii) | Th4+ | [Rn]86 |
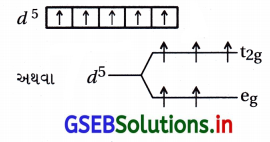
![]()
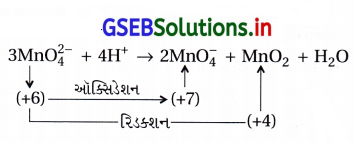
પ્રશ્ન 2.
+3 અવસ્થામાં ઑક્સિડેશન પામવા સંદર્ભે Mn2+ સંયોજનો Fe2+ કરતાં શા માટે વધારે સ્થાયી હોય છે ?
ઉત્તર:
ઉદા.-II : Fe2+ આયનીકરણ ઍન્થાલ્પી Mn2+ ના કરતાં નીચી છે.

Mn2+ ની ઇલેક્ટ્રૉનીય રચના 3d5 ની સ્થાયિતા Fe2+ (3d6) કરતાં વધારે હોવાથી આયનીકરણ ઍન્થાલ્પી Fe2+ < Mn2+ છે. આમ Fe ની તૃતીય આયનીકરણ ઍન્થાલ્પી (ઊર્જા) Mn કરતાં ઓછી છે. Fe (2962) < Mn (3260) kJ mol-1
પ્રશ્ન 3.
ટૂંકમાં સમજાવો કે પ્રથમ સંક્રાંતિ શ્રેણીના પ્રથમ અડધા તત્ત્વોમાં પરમાણ્વીય ક્રમાંક વધવાની સાથે +2 અવસ્થા કેવી રીતે વધુને વધુ સ્થાયી બને છે ?
ઉત્તર:
- પ્રથમ સંક્રાંતિ શ્રેણીનાં તત્ત્વોમાં પરમાણુક્રમાંક વધે છે તેમ પ્રથમ તથા દ્વિતીય આયનીયકરણ ઍન્થાલ્પીનો સરવાળો વધતો જાય છે. આના પરિણામે પ્રથમ અડધા ભાગ સુધીનાં તત્ત્વોના માટેનો \(\mathrm{E}_{\mathrm{M}^{2+} / \mathrm{M}}^{\ominus}\) પોટેન્શિયલ ક્રમશઃ ઓછો ઋણ થતો જાય છે.

- જેમ E⊖ ઓછો તેમ સ્થાયિતા વધારે હોય, આથી M2+ આયનોની સ્થાયિતા પ્રથમ અડધા ભાગ સુધી વધે છે.
પ્રશ્ન 4.
પ્રથમ સંક્રાંતિ તત્ત્વોની ઇલેક્ટ્રૉનીય રચના કયા ગાળા સુધી ઑક્સિડેશન અવસ્થાઓને નક્કી કરે છે ? તમારા ઉત્તરને ઉદાહરણ સહિત સમજાવો.
ઉત્તર:
- પ્રથમ સંક્રાંતિ શ્રેણીના તત્ત્વોની ઑક્સિડેશન અવસ્થાઓની સ્થાયિતા ઇલેક્ટ્રૉનીય રચના ઉપર આધાર રાખે છે.
- 3d0, 3d5 અને 3d10 રચના ધરાવતા આયનો વધારે સ્થાયી છે. ઉદા., 3d0 રચના ધરાવતા Se3+, Ti4+ અને V5+ વધુ સ્થાયી છે પણ Sc2+ શક્ય નથી.
- Ti2+ તથા Ti3+ ની સ્થાયિતા Ti4+ કરતાં ઓછી છે. V2O5 ઘણો સ્થાયી છે. જ્યારે VO અને V2O3 ઓછા સ્થાયી છે.
- d5 રચના ધરાવતા Mn2+, Fe3+ વધુ સ્થાયી છે. જ્યારે Mn3+, Fe2+ ઓછા સ્થાયી છે.
- d10 રચના ધરાવતા આયનો સ્થાયી છે. ઉદા., Cu+ તથા Zn2+ આયનો સ્થાયી છે.
પ્રશ્ન 5.
નીચે દર્શાવલી સંક્રાંતિ તત્ત્વોના પરમાણુઓની ધરાઅવસ્થામાં d ઇલેક્ટ્રૉનીય રચનામાં કઈ ઑક્સિડેશન અવસ્થા સ્થાયી હશે ? 3d3, 3d5, 3d8 અને 3d4 ?
ઉત્તર:
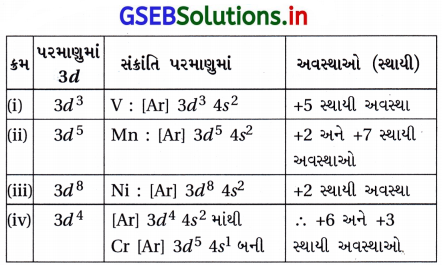
પ્રશ્ન 6.
સંક્રાંતિ ધાતુઓની પ્રથમ શ્રેણીના ઑક્સોધાતુ ઋણાયનોના નામ જણાવો કે જે ધાતુ તેના સમૂહક્રમાંકની સમાન ઑક્સિડેશન અવસ્થા દર્શાવ છે.
ઉત્તર:

પ્રશ્ન 7.
લેન્થેનોઇડ સંકોચન એટલે શું ? લેન્થેનોઇડ સંકોચનનું પરિણામ શું હોય છે ?
ઉત્તર:
- ત્રીજી સંક્રાંતિ શ્રેણીની ધાતુઓમાં ઇલેક્ટ્રૉનથી 50 કક્ષકોના પહેલાં 4f કક્ષકો ભરવાના કારણે પરમાણ્વીય ત્રિજ્યામાં નિયમિત ઘટાડો થાય છે, જેને લેન્થેનોઇડ સંકોચન કહે છે. આ ઘટના પરમાણ્વીય ક્રમાંક વધે તેમ પરમાણ્વીય કદમાં અપેક્ષિત વધારો થવામાં ક્ષતિપૂર્તિ કરે છે.
- સંક્રાંતિ તત્ત્વોની પરમાણ્વીય ત્રિજ્યાઓનાં વલણ નીચેની આકૃતિ પ્રમાણે છે :
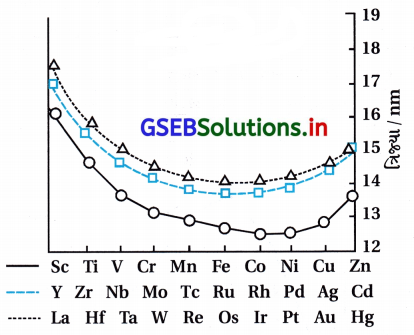
- લેન્થેનોઇડ સંકોચનનું ચોખ્ખું પરિણામ : લેન્થેનોઇડ સંકોચન થવાથી દ્વિતીય અને તૃતીય શ્રેણીનાં તત્ત્વો લગભગ સમાન ત્રિજ્યા દર્શાવે છે. ઉદા., દ્વિતીય શ્રેણીનું Zr 160 pm અને તૃતીય શ્રેણીનું HF 159 pm. આથી ત્રીજી અને ચોથી શ્રેણીનાં તત્ત્વો ભૌતિક અને રાસાયણિક ગુણધર્મોમાં વધારે સામ્યતા ધરાવે છે.
- લેન્થેનોઇડ સંકોચનનું કારણ : એક સામાન્ય સંક્રાંતિ શ્રેણીમાં કક્ષકોનાં સમાન જૂથ (3d/4d/5d)માં ‘એક ઇલેક્ટ્રૉન વડે બીજા અન્ય ઇલેક્ટ્રૉનની ઉપર અપૂર્ણ શીલ્ડિંગ અસર છે.’ જોકે અન્ય ઇલેક્ટ્રૉનથી એક 4f ઇલેક્ટ્રૉનનું થતું શીલ્ડિંગ અન્ય ઇલેક્ટ્રૉન વડે એક 3d ઇલેક્ટ્રૉનના શીલ્ડિંગ કરતાં ઓછું હોય છે.
3d થી શીલ્ડિંગ > 4f થી શીલ્ડિંગ
એક જ શ્રેણીમાં જેમ જેમ કેન્દ્રિય વીજભાર (Z) વધતો જાય છે. તેમ તેમ બધી જ 4fn કક્ષકોના કદમાં ઘટાડો થતો જાય છે.
![]()
પ્રશ્ન 8.
સંક્રાંતિ તત્ત્વોની લાક્ષણિકતાઓ શું હોય છે અને તેઓ શા માટે સંક્રાંતિ તત્ત્વો કહેવાય છે ? d- વિભાગના કયા તત્ત્વોને સંક્રાંતિ તત્ત્વો તરીકે ગણી શકાતા નથી ?
ઉત્તર:
(i) સંક્રાંતિ તત્ત્વો : સંક્રાંતિ ધાતુઓ નામ તે હકીકત પરથી તારવવામાં આવ્યું હતું કે, તે ધાતુઓના રાસાયણિક ગુણધર્મો s અને p વિભાગનાં તત્ત્વોનાં ગુણધર્મોની વચ્ચે સંક્રાંતિ પામતા હતા.
હાલમાં IUPAC મુજબ, જે ધાતુઓના તટસ્થ પરમાણુ અથવા આયનોમાં d- પેટાકક્ષકો અપૂર્ણ ભરાયેલી હોય તેમને સંક્રાંતિ ધાતુઓ તરીકે વ્યાખ્યાયિત કરવામાં આવી છે.
(ii) d-વિભાગનાં સંક્રાંતિ તત્ત્વો : સમૂહ 12ના ઝિંક (2n), કેડમિયમ (Cd) અને મરક્યુરી તેમની ધરાઅવસ્થામાં અને તેમની સામાન્ય ઑક્સિડેશન અવસ્થામાં સંપૂર્ણ d10 ઇલેક્ટ્રૉનીય રચના ધરાવતા હોવાથી તેમને સંક્રાંતિ ધાતુઓ તરીકે ગણવામાં આવતી નથી.
(iii) સંક્રાંતિ તત્ત્વોની લાક્ષણિકતાઓ : તેઓ અપૂર્ણ (n – 1)d કક્ષકો ધરાવે છે, જેથી નીચેની લાક્ષણિકતાઓ ધરાવે છે.
(i) તેઓ રંગીન આયનોનું નિર્માણ કરે છે.
(ii) તેઓ સમાન ચુંબકીય ગુણધર્મો અને અનુચુંબકીય વર્તણૂક દર્શાવે છે.
(iii) તેઓ વિવિધ ઑક્સિડેશન અવસ્થા ધરાવે છે.
(iv) તેઓ વિવિધ લિગેન્ડની સાથે સંકીર્ણ સંયોજનોનું નિર્માણ કરે છે.
(V) તેઓ આંતરાલીય સંયોજનો રચે છે.
(vi) તેઓ ઉદ્દીપકીય ગુણધર્મ ધરાવે છે.
(vii)તેઓ મિશ્રધાતુઓ રચે છે.
પ્રશ્ન 9.
સંક્રાંતિ તત્ત્વોની ઇલેક્ટ્રૉનીય રચના કેવી રીતે અસંક્રાંતિ તત્ત્વોની ઇલેક્ટ્રોનીય રચનાથી ભિન્ન છે ?
ઉત્તર:
- સંક્રાંતિ તત્ત્વોની સામાન્ય ઇલેક્ટ્રૉનીય રચના (n – 1)d1 – 10 ns1 – 2 હોય છે. તેમાં (n – 1)d કક્ષકોમાં ઇલેક્ટ્રૉન ભરાય છે પણ અસંક્રાંતિ તત્ત્વોમાં તેમની s અને p કક્ષકોમાં ઇલેક્ટ્રૉન ભરાય છે.
- અસંક્રાંતિ તત્ત્વોની સામાન્ય ઇલેક્ટ્રૉનીય રચના ns1 – 2 અથવા ns2np1 – 6 હોય છે.
- અસંક્રાંતિ તત્ત્વોમાં બાહ્યતમ કોષ અપૂર્ણ ભરાયેલ હોય છે. જ્યારે સંક્રાંતિ તત્ત્વોમાં બાહ્યકોષ (n)ની અંદરનો (n – 1)d કોષ અપૂર્ણ ભરાયેલો હોય છે.
પ્રશ્ન 10.
લેન્થેનોઇડ્સ કઈ જુદી જુદી ઑક્સિડેશન અવસ્થાઓ દર્શાવે છે ?
ઉત્તર:
લેન્થેનોઇડ્સની સામાન્ય ઑક્સિડેશન અવસ્થા +3 છે, આ ઉપરાંત તેઓ +4 અવસ્થા પણ દર્શાવે છે.
પ્રશ્ન 11.
કારણો આપીને સમજાવો :
(i) સંક્રાંતિ તત્ત્વો અને તેમના ઘણા સંયોજનો અનુચુંબકીય વર્તણૂક દર્શાવે છે.
(ii) સંક્રાંતિ ધાતુઓની પરમાણ્વીકરણ એન્થાલ્પી ઊંચી હોય છે.
(iii) સામાન્ય રીતે સંક્રાંતિ ધાતુઓ રંગીન સંયોજનો બનાવે છે.
(iv) સંક્રાંતિ ધાતુઓ અને તેમના ઘણા સંયોજનો સારા -ઉદ્દીપક તરીકે વર્તે છે.
ઉત્તર:
(i) સંક્રાંતિ તત્ત્વો અને તેમના ઘણા સંયોજનો અનુચુંબકીય વર્તણૂક દર્શાવે છે.
- અનુચુંબકત્વ અયુગ્મિત ઇલેક્ટ્રૉનની હાજરીના કારણે ઉત્પન્ન થાય છે.
- દરેક અયુગ્મિત ઇલેક્ટ્રૉન બે પ્રકારની ગતિ સતત કરે છે. (i) ભ્રમણ કોણીય વેગમાન અને (ii) કક્ષકીય કોણીય વેગમાન. આમાંથી સંક્રાંતિ ધાતુઓની પ્રથમ શ્રેણીનાં સંયોજનો માટે કક્ષકીય કોણીય વેગમાનનો ફાળો અસરકારક રીતે હિંમત થાય છે અને તેથી તેનો ફાળો ચુંબકીય ચાકમાત્રાના મૂલ્યમાં અર્થસૂચક નથી. જેથી ચુંબકીય ચાકમાત્રાનું મૂલ્ય હાજર અયુગ્મ ઇલેક્ટ્રૉનની સંખ્યા વડે નક્કી કરવામાં આવે છે.
- ચુંબકીય ચાકમાત્રાની ગણતરી ‘ભ્રમણ માત્ર’ સૂત્રથી ગણાય છે, જે નીચે મુજબ થાય છે.
µ = \(\sqrt{n(n+2)}\) BM જ્યાં, n = અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યા
µ = ચુંબકીય ચાકમાત્રા (જેનો એકમ બૉર મૅગ્નેટોન (BM) છે) - જેથી અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યા વધે તેમ ચુંબકીય ચાકમાત્રાનું મૂલ્ય વધે છે.
- નીચેના કોઠામાં ગણતરી કરેલા અને પ્રાયોગિક અવલોકિત ચુંબકીય ચાકમાત્રાના મૂલ્યો આપ્યા છે :
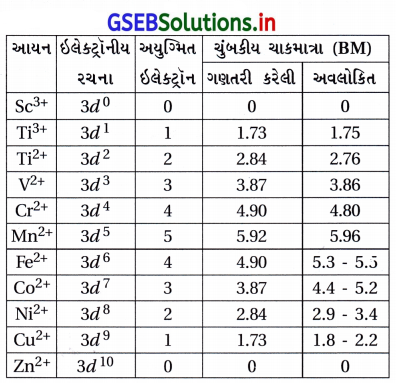
- આ કોષ્ટકમાં આપેલાં પ્રાયોગિક મૂલ્યો મુખ્યત્વે પાણીના દ્રાવણમાં જળયુક્ત આયનો અથવા ધન અવસ્થા માટે છે.
(ii) સંક્રાંતિ ધાતુઓની પરમાણ્વીકરણ એન્થાલ્પી ઊંચી હોય છે.
(a) ધાત્વીય ગુણધર્મો : બધાં જ સંક્રાંતિ તત્ત્વો વિશિષ્ટ ધાત્વીય ગુણધર્મો ધરાવે છે. ઉદા., (i) ઉચ્ચ તનન પ્રબળતા (ii) તણાવપણું (iii) ટિપાઉપણું (iv) ઉચ્ચ-ઉષ્મીય અને વિદ્યુતવાહકતા અને ધાત્વીય ચમક ધરાવે છે.
(iii) સામાન્ય રીતે સંક્રાંતિ ધાતુઓ રંગીન સંયોજનો બનાવે છે.
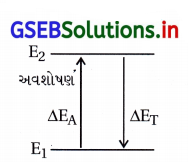
ΔEA = અવશોષિત ઊર્જા (λ)
ΔET = ઉત્સર્જિત ઊર્જા
ΔE = hv = hc / λ
v = \(A\) = દૃશ્યમાન તરંગ
રંગ ઉત્પન્ન થવાનું કારણ : જ્યારે નીચી ઊર્જાવાળી d કક્ષકમાંથી ઇલેક્ટ્રૉન ઊંચી ઊર્જાવાળી d-કક્ષકમાં ઉત્તેજિત થાય છે, ત્યારે ઉત્તેજિતની ઊર્જા અવશોષિત દશ્યમાન પ્રકાશની આવૃત્તિને અનુરૂપ હોય છે. સામાન્ય રીતે આ અવશોષિત આવૃત્તિ દશ્ય ક્ષેત્રમાં હોય છે.

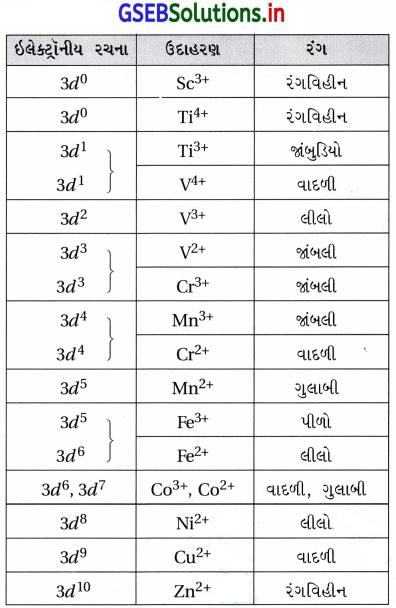
(i) અવલોકિત રંગ અવશોષિત પ્રકાશના પૂરક રંગને અનુરૂપ હોય છે. (ii) અવશોષિત પ્રકાશની આવૃત્તિ લિગેન્ડના સ્વભાવ ઉપર આધાર રાખે છે. (iii) જલીય દ્રાવણોમાં પાણીના અણુઓ લિગેન્ડ તરીકે હોય છે. (iv) કેટલાક સંક્રાંતિ આયનો (જલીય દ્રાવણમાં) નીચેના કોષ્ટક પ્રમાણે રંગ ધરાવે છે.
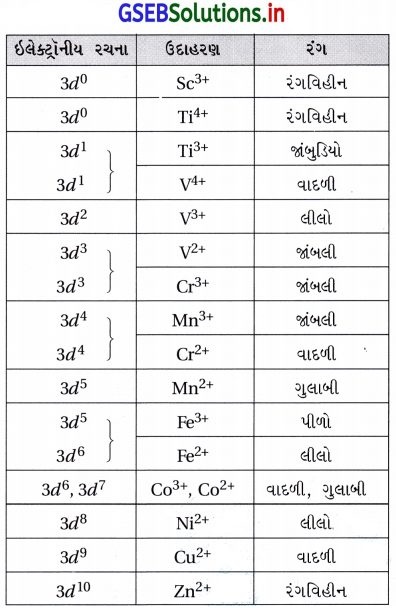
નોંધ : (i) 3d0 અને 3d10 આયનો રંગીન નથી. (ii) અયુગ્મ 3d ઇલેક્ટ્રૉન હોય તેજ આયનો રંગીન છે. (iii) લિગેન્ડ બધામાં એકસમાન H2O છે. તેમ છતાં બધાના રંગ સમાન નથી. (iv) રંગ તે આયનમાંના ઇલેક્ટ્રૉનની સંખ્યા ઉપરાંત ધાતુ સાથે બદલાઈ શકે છે. (v) V3+(3d2) તથા Fe2+(3d6) અને Ni2+(3d8) ત્રણેય લગભગ લીલા રંગના છે. (vi) કોઈ પણ બે ભિન્ન આયનોના રંગો સંપૂર્ણ સમાન (સમાન v ના) હોતા નથી.
![]()
પ્રશ્ન 12.
આંતરાલીય સંયોજનો એટલે શું ? સંક્રાંતિ ધાતુ માટે આવા સંયોજનો શા માટે સુપ્રસિદ્ધ હોય છે ?
ઉત્તર:
- જ્યારે સંક્રાંતિ ધાતુઓના સ્ફટિક લેટિસમાં અંદરના ભાગમાં નાના પરમાણુઓ જેવા કે H, C કે N ગોઠવાય છે, ત્યારે બનતાં સંયોજનોને આંતરાલીય સંયોજનો કહે છે. ઉદા., TiC, Mn4N, Fe3H, VH0.56, TiH1.7 વગેરે.
- સામાન્ય રીતે આંતરાલીય સંયોજનો બિનતત્ત્વયોગમિતિય હોય છે અને તેઓ આયનીય કે સહસંયોજક હોતાં નથી. આંતરાલીય સંયોજનોનાં સૂત્રો ધાતુની સામાન્ય ઑક્સિડેશન અવસ્થા દર્શાવતા નથી. તેમના સંઘટનના સ્વભાવને કારણે આ સંયોજનોને આંતરાલીય સંયોજનો કહેવાય છે.
- આંતરાલીય સંયોજનોની ભૌતિક અને રાસાયણિક લાક્ષણિકતાઓ :
(i) તેમનાં ગલનબિંદુ ઊંચાં હોય છે, જે તેમની શુદ્ધ ધાતુનાં ગલનબિંદુના કરતાં પણ વધારે ઊંચાં હોય છે.
(ii) આંતરાલીય સંયોજનો વધુ સખત હોય છે. કેટલાક બોરાઇડ સંયોજનો કઠિનતામાં હીરા જેવા હોય છે.
(iii) આંતરાલીય સંયોજનો ધાત્વીય વાહકતા જાળવી રાખે છે.
(iv) આંતરાલીય સંયોજનો રાસાયણિક રીતે નિષ્ક્રિય હોય છે.
પ્રશ્ન 13.
સંક્રાંતિ ધાતુઓની ઑક્સિડેશન અવસ્થાઓમાં પરિવર્તનશીલતા, અસંક્રાંતિ ધાતુઓની ઑક્સિડેશન અવસ્થાઓમાં પરિવર્તનશીલતા કરતાં કેવી રીતે જુદી છે ? ઉદાહરણો સહિત સમજાવો.
ઉત્તર:
- સંક્રાંતિ તત્ત્વોની એક લાક્ષણિકતા એ છે કે, તેઓ ઑક્સિડેશન અવસ્થાઓની પરિવર્ત પીલતા દર્શાવે છે, કારણ , તેઓમાં અપૂર્ણ ભરાતી d-કક્ષકો એવી રીતે ભરાય છે કે, તેમની ઑક્સિડેશન અવસ્થાઓમાં ફેરફાર એકબીજાથી 1 એકમ જેટલો હોય છે.
ઉદા., VII, VIII, VIV, VV FeII FeIII; CuI, CuII; CrII, CrIII, CrIV, CrV, CrVI વગેરે.
નોંધ : આ બાબત બિનસંક્રાંતિ તત્ત્વોની ઑક્સિડેશન અવસ્થાઓની પરિવર્તનશીલતાથી વિપરિત છે, અસંક્રાંતિ તત્ત્વોની ઑક્સિડેશન અવસ્થામાં ફેરફાર 2 એકમ જેટલો હોય છે. - d-વિભાગનાં તત્ત્વોનાં સમૂહ (4 થી 10)માં ઑક્સિડેશન અવસ્થાઓની પરિવર્તનશીલતામાં એક રસપ્રદ લક્ષણ જોવા મળે છે. જોકે p-વિભાગમાં ભારે તત્ત્વો નીચી ઑક્સિડેશન અવસ્થાઓમાં સાનુકૂળતા દર્શાવે છે. કારણ કે તેમાં નિષ્ક્રિય યુગ્મની અસર થાય છે.
- d-વિભાગનાં તત્ત્વોમાં નિષ્ક્રિય યુગ્મ અસર નથી અને તેઓ ઊંચી અવસ્થા દર્શાવે છે. ઉદાહરણ તરીકે સમૂહ 6 માં Mo(VI) અને W(VI) ની સ્થાયિતા Cr(VI)ના કરતાં વધારે છે.
- ઍસિડિક માધ્યમમાં Cr(VI) ડાયક્રોમેટ (Cr2O2-7) સ્વરૂપમાં પ્રબળ ઑક્સિડેશનકર્તા છે પણ MoO3 અને WO3 પ્રબળ ઑક્સિડેશનકર્તા નથી.
પ્રશ્ન 14.
આયર્ન ક્રોમાઇટ અયસ્કમાંથી પોટેશિયમ ડાયક્રોમેટની બનાવટ વર્ણવો. પોટેશિયમ ડાયક્રોમેટના દ્રાવણ પર pH ના વધારાની શું અસર થાય છે ?
ઉત્તર:
આયર્ન ક્રોમાઇટમાંથી પોટૅશિયમ ડાયક્રોમેટની બનાવટના :
- પોટૅશિયમ ડાયક્રોમેટ (K2Cr2O7)ની બનાવટ : સામાન્ય રીતે ક્રોમેટમાંથી ડાયક્રોમેટ સંયોજનો બનાવાય છે. ક્રોમાઇટ અયસ્ક (FeCr2O4)ની વધારે પડતી હવાની હાજરીમાં સોડિયમ અથવા પોટૅશિયમ કાર્બોનેટ સાથેની સંગલન પ્રક્રિયા વડે ક્રોમેટ મેળવાય છે.

- સોડિયમ ક્રોમેટ (Na2CrO4)ના પીળા દ્રાવણને ગાળ્યા પછી તેને સલ્ફ્યુરિક ઍસિડ ઉમેરીને ઍસિડિક બનાવવાથી નારંગી રંગનો સોડિયમ ડાયક્રોમેટ બને Na2Cr2O7 · 2H2O છે, જેનું સ્ફટિકીકરણ છે.
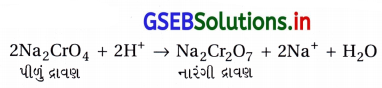
- સોડિયમ ડાયક્રોમેટ (Na2CrO4) કરતાં પોટૅશિયમ ડાયક્રોમેટ (K2Cr2O7) ઓછો દ્રાવ્ય છે. જેથી સોડિયમ ડાયક્રોમેટના દ્રાવણની પોટૅશિયમ ક્લોરાઇડ સાથેની પ્રક્રિયાથી પોટૅશિયમ ડાયક્રોમેટ બનાવવામાં આવે છે.

- દ્રાવણમાંથી પોટેશિયમ ડાયક્રોમેટના નારંગી રંગના સ્ફટિકનું સ્ફટિકીકરણથી અવક્ષેપન કરાય છે.
પોટૅશિયમ ડાયક્રોમેટના ગુણધર્મો (પ્રક્રિયાઓ) અને pH ના ફેરફારોની અસર :
જલીય દ્રાવણમાં ક્રોમેટ આયનો અને ડાયક્રોમેટ આયનો આંતરપરિવર્તનશીલ હોય છે. જેનો આધાર દ્રાવણની pH ઉપર હોય છે. ઍસિડિક દ્રાવણમાં ડાયક્રોમેટ અને બેઝિક દ્રાવણમાં ક્રોમેટ હોય છે. વળી, ક્રોમેટ તેમજ ડાયક્રોમેટ તે બંનેમાં ક્રોમિયમની ઑક્સિડેશન અવસ્થા સમાન (+6) હોય છે.

પ્રશ્ન 15.
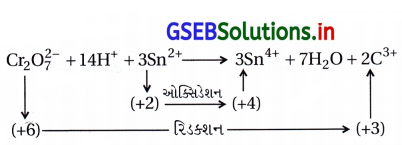
પોટેશિયમ ડાયક્રોમેટની ઑક્સિડેશનકર્તા તરીકેની પ્રક્રિયા વર્ણવો અને તેની નીચે દર્શાવેલા સાથેની પ્રક્રિયાના આયનીય સમીકરણો લખો.
(i) આયોડાઇડ (ii) આયર્ન(II) દ્રાવણ અને (iii) H2S
ઉત્તર:
ઑક્સિડેશનકર્તા તરીકેની પ્રક્રિયા :


પ્રશ્ન 16.
પોટેશિયમ પરમેંગેનેટની બનાવટ વર્ણવો. ઍસિડમય પરમેંગેનેટ દ્રાવણ કેવી રીતે (i) આયર્ન(II) આયનો (ii) SO2 અને (iii) ઓક્ઝેલિક એસિડ સાથે પ્રક્રિયા કરે છે? આ પ્રક્રિયાઓ માટે આયનીય સમીકરણો લખો.
ઉત્તર:
પોટૅશિયમ પરમેંગેનેટની બનાવટ : KMnO4 ના બનાવવાની રીતો નીચે પ્રમાણે છે :
(i) MnO2 ને આલ્કલી ધાતુ હાઇડ્રૉક્સાઇડ અને KNO3 જેવા ઑક્સિડેશનકર્તાની સાથે સંગલિત કરીને પોટૅશિયમ પરમેંગેનેટ બનાવાય છે. આથી ઘેરા લીલા રંગનો K2MnO4 બને છે, જેનું તટસ્થ અથવા ઍસિડિક દ્રાવણમાં વિષમીકરણ થઈને પરમેંગેનેટ (MnO-14) બને છે.
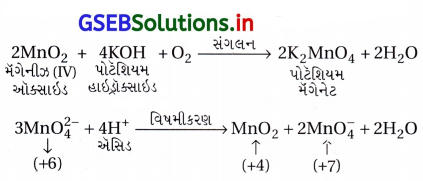
(ii) વ્યાપારિક સ્તરે KMnO4 ને MnO2 નું આલ્કલાઇન માધ્યમમાં ઑક્સિડેશન કરનારી સંગલન પ્રક્રિયા કર્યા પછીથી મેંગેનેટ(VI) નું વિદ્યુતવિભાજનીય ઑક્સિડેશનથી બનાવવામાં આવે છે.

(iii) પ્રયોગશાળામાં KMnO4 ની બનાવટ પ્રયોગશાળામાં મેંગેનીઝ(II) આયનના ક્ષારનું પરઑક્સોડાયસલ્ફેટ (S2O2-8) વડે પરમેંગેનેટમાં ઑક્સિડેશન થાય છે.

KMnO4 ની પ્રક્રિયા :
પરમેંગેનેટ (MnO–4) ના રિડક્શનની પ્રક્રિયાના પ્રકાર : MnO–4 નાં નીચેના ત્રણ પકારે રિડક્શન શક્ય છે. જેમાં મેંગેનેટ (MnO2-4), મેંગેનીઝ ડાયૉક્સાઇડ (MnO2) અને મેંગેનીઝ (II) ક્ષારમાં પરિવર્તન થાય છે.
તટસ્થ રિડક્શન :

KMnO4 સાથેની રેડોક્ષ પ્રક્રિયાને અસર કરતાં પરિબળો :
- આ રિડક્શન પ્રક્રિયાઓમાં હાઇડ્રોજન આયનોની સાંદ્રતા ઉપર આધાર રાખે છે.
- જોકે ઘણી પ્રક્રિયાઓને રેડોક્ષ પોટેન્શિયલથી સમજાવી શકાય છે.
- આ પ્રક્રિયાઓ તેમની રાસાયણિક ગતિકી ઉપર પણ આધારિત છે.
- પરમેંગેનેટ વડે pH = 1 હોય તો પાણીનું ઑક્સિડેશન થવું જોઈએ પણ પ્રાયોગિક રીતે આ પ્રક્રિયા અત્યંત ધીમી છે. જ્યાં સુધી મેંગેનીઝ(II) આયનો હાજર ન હોય અથવા તાપમાન વધારવામાં ન આવે ત્યાં સુધી આ પ્રક્રિયાઓ અત્યંત ધીમી હોય છે.
- KMnO4 પ્રબળ ઑક્સિડેશનકર્તા તરીકે વર્તે છે.
અનુમાપનોમાં KMnO4 માંના MnO–4 નું Mn(II) માં રિડક્શન અને C2O2-4, Fe2+, NO–2, I– નાં ઑક્સિડેશનની પ્રક્રિયાઓ ઍસિડિક દ્રાવણમાં થાય છે, જે બધી નીચે છે.
નોંધ : HCl ની હાજરીમાં MnO–4 સાથેનાં અનુમાપનો (i) થી (iv) અસંતોષકારક છે, કારણ કે HCl નું Cl2માં ઑક્સિડેશન થાય છે.
(i) આયર્ન(II) આયનો સાથે :
જવાબ માટે જુઓ વિભાગ-A નો પ્રશ્ન નં. 26(e)(i)

અથવા
MnO–4 + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
(ii) SO2 સાથે :
નાઇટ્રાઇટ (NO–2) નું નાઇટ્રેટ (NO–3) આયનમાં ઑક્સિડેશન :
5NO–2 + 5H2O → 5NO–3 + 10H+ + 10\(\bar{e}\) ……..(ઑક્સિડેશન અર્ધપ્રક્રિયા)
અથવા
2MnO–4 + 5SO2 + 2H2O → 5SO2-4 + 2Mn2+4H+
(iii) ઑક્ઝેલિક ઍસિડ સાથે :
ઑક્ઝેલેટ આયનનું કાર્બન ડાયૉક્સાઇડમાં પરિવર્તનની ઑક્સિડેશન :

અથવા
2MnO–4 + 5C2O2-4 + 16H+ → 2Mn2+ + 8H2O + 10CO2
![]()
પ્રશ્ન 17.
M2+/M અને M3+/M+ પ્રણાલીઓ માટે કેટલીક ધાતુઓના H⊖ મૂલ્યો નીચે દર્શાવેલા છે.

આ મૂલ્યોનો ઉપયોગ કરી નીચે દર્શાવલાની આલોચના કરોઃ
(i) ઍસિડિક દ્રાવણમાં Cr3+ અથવા Mn+3 ની સરખામણીમાં Fe3+ ની સ્થાયિતા અને
(ii) સમાન પ્રક્રમ માટે ક્રોમિયમ અથવા મેગેનીઝ ધાતુઓની સરખામણીમાં આયર્નના ઑક્સિડેશનમાં સરળતા.
ઉત્તર:
(i) ઍસિડિક દ્રાવણમાં Cr3+ અથવા Mn3+ ની સરખામણીમાં Fe3+ ની સ્થાયિતા :
 = -0.4V નો પોટેન્શિયલ ઋણ છે.
= -0.4V નો પોટેન્શિયલ ઋણ છે.
∴ Cr3+ મહત્તમ સ્થાયી છે.
\(\mathrm{E}_{\mathrm{Mn}^{3+} / \mathrm{Mn}^{2+}}\) = +1.5V નો પોટેન્શિયલ મહત્તમ ધન છે.
∴ Mn3+ ઓછો સ્થાયી છે.
\(\mathrm{E}_{\mathrm{Fe}^{3+} / \mathrm{Fe}^{2+}}^{\ominus}\) = 0.8V નો પોટૅન્શિયલ મધ્યમ ધન છે.
∴ Fe3+ ની સ્થાયિતા Mn3+ ની સ્થાયિતા કરતાં વધારે છે
અને Cr3+ ની સ્થાયિતા કરતાં ઓછી છે.
સ્થાયિતા : Cr3+ > Fe3+|Mn3+
(ii) સમાન પ્રક્રમ માટે Cr અથવા Mn ની સરખામણીમાં Fe ના ઑક્સિડેશન :  = -1.2V આ પોર્ટેન્શિયલ આપેલા બધામાં મહત્તમ ઋણ છે. જેથી Mn સૌથી સરળતાથી ઑક્સિડેશન પામશે. આ ઉપરથી તારવી શકાય છે કે ઑક્સિડેશન પામવાની સરળતા Mn > Cr > Fe છે.
= -1.2V આ પોર્ટેન્શિયલ આપેલા બધામાં મહત્તમ ઋણ છે. જેથી Mn સૌથી સરળતાથી ઑક્સિડેશન પામશે. આ ઉપરથી તારવી શકાય છે કે ઑક્સિડેશન પામવાની સરળતા Mn > Cr > Fe છે.
પ્રશ્ન 18.
અનુમાન કરો કે નીચેના પૈકી કયા આયન જલીય દ્રાવણમાં રંગ આપશે ?
Ti3+, V3+, Cu+, Sc3+, Mn2+, Fe3+ અને CO2+ દરેક માટે કારણ આપો.
ઉત્તર:
- Sc3+ અને Cu+ રંગવિહીન હશે, અને તેના સિવાયના બધા જ આયનો Ti3+, V3+, Mn2+, Fe3+ તથા CO2+ આયનોનાં જલીય દ્રાવણો રંગીન હશે.
- Sc3+ તે 3d0 અને Cu+ તે 3d10 રચના ધરાવે છે. તેઓમાં અનુક્રમે 3d પૂર્ણ ખાલી છે અને પૂર્ણ ભરાયેલી છે. જેથી રંગવિહીન છે.
- બાકીના Ti3+, V3+, Mn2+, Fe3+ અને CO2+ માં અપૂર્ણ 3d હોવાથી રંગીન હોય છે.
પ્રશ્ન 19.
પ્રથમ સંક્રાંતિ શ્રેણીનાં તત્ત્વો માટે +2 ઑક્સિડેશન અવસ્થાની સ્થાયિતાની સરખામણી કરો.
ઉત્તર:
- 3d શ્રેણીમાં +2 અવસ્થાની સ્થાયિતાની સરખામણી :
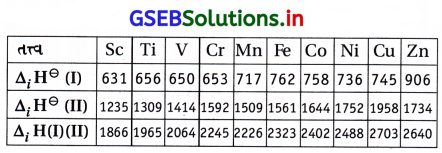
- 3d શ્રેણીનાં તત્ત્વોની આયનોની સ્થાયિતાનો આધાર
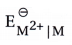 ઉપર એટલે કે (i) પરમાણ્વીયકરણ ઍન્થાલ્પી (ii) પ્રથમ આયનીકરણ ઍન્થાલ્પી અને દ્વિતીય આયનીકરણના ઍન્થાલ્પીના સરવાળાનાં મૂલ્ય ઉપર છે.
ઉપર એટલે કે (i) પરમાણ્વીયકરણ ઍન્થાલ્પી (ii) પ્રથમ આયનીકરણ ઍન્થાલ્પી અને દ્વિતીય આયનીકરણના ઍન્થાલ્પીના સરવાળાનાં મૂલ્ય ઉપર છે. - આથી M2+ આયનોની સ્થાયિતામાં ધીમો ઘટાડો થાય છે, જોકે આ ઘટાડો સંપૂર્ણ નિયમિત નથી. Mn2+ અને Zn2+ ની સ્થાયિતામાં ઘટાડાના સ્થાને વધારો થાય છે. Mn2+ સ્થાયી d5 અને Zn2+ સ્થાયી 3d10 રચના ધરાવતા હોવાથી વિશિષ્ટ સ્થાયિતા પ્રાપ્ત કરે છે.
પ્રશ્ન 20.
ઍક્ટિનોઇડ્સના રસાયણવિજ્ઞાનની લેન્થેનોઇડ્સના રસાયણવિજ્ઞાન સાથે નીચે દર્શાવેલા વિશિષ્ટ સંદર્ભ માટે સરખામણી કરો :
(i) ઇલેક્ટ્રોનીય રચના
(ii) પરમાણ્વીય અને આયનીય કદ
(iii) ઑક્સિડેશન અવસ્થા
(iv) રાસાયણિક પ્રતિક્રિયાત્મકતા
ઉત્તર:
(i) ઍક્ટિનોઇડ અને લેન્થેનોઇડની ઇલેક્ટ્રૉનીય રચનાની સરખામણી : લેન્થેનોઇડ્સની સામાન્ય ઇલેક્ટ્રૉનીય રચના [Xe] 4f1 – 145d0 – 16s2 છે અને તેઓમાં 4f માં ઇલેક્ટ્રૉન ક્રમશઃ ભરાય છે. તેઓમાં બાહ્યકક્ષા 4f, 5d અને 6s છે.
ઍક્ટિનોઇડ્સની સામાન્ય ઇલેક્ટ્રૉનીય રચના [Rn] 5f1 – 14 6d0 – 1 7s2 છે અને તેઓમાં 5f માં ઇલેક્ટ્રૉન ઉમેરાય છે. તેઓમાં બાહ્યકક્ષા 5f, 6d અને 7s છે.
આ બંનેમાં f0, f7 અને f14 રચના સ્થાયી છે અને 4f કરતાં 5f બંધ રચનામાં વધારે ભાગ લઈ શકે છે.
(ii) પરમાણ્વીય અને આયનીય કદ : ઍક્ટિનોઇડ્સ તેમજ લેન્થેનોઇડ્સ તે બંનેનાં પરમાણ્વીય અને આયનીય કદ ક્રમશઃ ઘટે છે. તેઓ અનુક્રમે ઍક્ટિનોઇડ સંકોચન અને લેન્થેનોઇડ્સ સંકોચન દર્શાવે છે. તેમનાં પરમાણ્વીય કદના ઘટાડામાં અપવાદો છે.
(iii) ઑક્સિડેશન અવસ્થા : લેન્થેનોઇડ્સની સામાન્ય ઑક્સિડેશન અવસ્થા +3 છે. તે ઉપરાંત કેટલાક તત્ત્વો +2(Ce2+, Sm2+, Eu2+, Yb2+,…) તથા +4(Ce4+, Pr4+, Nd4+, Tb4+,….) વગેરે દર્શાવે છે. તેઓની 4f0, 4f7 અને 4f14 અવસ્થાઓ વિશિષ્ટ સ્થાયિતા દર્શાવે છે.
ઍક્ટિનોઇડ્સની સામાન્ય અવસ્થા, લેન્થેનોઇડ્સની જેમ +3 છે. 4f અને 5d ના સાપેક્ષ 5f અને 6d વચ્ચે ઊર્જા તફાવત ઓછો હોવાથી ઍક્ટિનોઇડ્સ ભિન્ન સ્થાયી અવસ્થા દર્શાવી શકે છે. પણ ઍક્ટિનોઇડ્સની રેડિયોસક્રિયતા ઘણી મર્યાદા લાવે છે.
(iv) રાસાયણિક પ્રતિક્રિયાત્મકતા : ઍક્ટિનોઇડ્સની રાસાયણિક પ્રતિક્રિયાત્મકતા લેન્થેનોઇડ્સના કરતાં વધારે હોય છે અને પાઉડર અવસ્થામાં વધારે પ્રતિક્રિયાત્મકતા છે.
લેન્થેનોઇડ્સના તથા ઍક્ટિનોઇડ્સ +4 ના સાપેક્ષ +3 અવસ્થામાં વધારે સંયોજનો બનાવે છે. 4f કરતાં 5f કક્ષકો બંધ બનાવવામાં વધારે પ્રમાણમાં ભાગ લઈ શકે છે.
પ્રશ્ન 21.
નીચે દર્શાવેલા વિધાનોને કેવી રીતે સ્પષ્ટ કરશો ?
(i) d4 સ્પિસીઝના Cr2+ પ્રબળ રિડક્શનકર્તા છે જ્યારે મેંગેનીઝ(III) પ્રબળ ઑક્સિડેશનકર્તા છે.
(ii) કોબાલ્ટ(II) જલીય દ્રાવણમાં સ્થાયી છે પરંતુ સંકીર્ણકર્તા પ્રક્રિયકોની હાજરીમાં તે સહેલાઈથી ઑક્સિડેશન પામે છે.
(iii) આયનોમાં d1 ઇલેક્ટ્રોનીય રચના અત્યંત અસ્થાયી છે.
ઉત્તર:
(i) Cr2+ પ્રબળ રિડક્શનકર્તા છે.
Cr2+ [Ar]18 3d4
Cr2+ પ્રબળ રિડક્શનકર્તા હોય ત્યારે તેનું Cr3+ માં ઑક્સિડેશન થાય છે અને Cr3+ (3d3) બને છે.
Cr2+ → Cr3+ + \(\bar{e}\) \(\mathrm{E}_{\mathrm{Cr}^{3+} / \mathrm{Cr}^{2+}}^{\ominus}\) = -0.41V
આ અર્ધપ્રક્રિયાના પોટેન્શિયલનું મૂલ્ય ઋણ છે. જેથી Cr2+ સરળતાથી ઑક્સિડેશન પામી પ્રબળ રિડક્શનકર્તા તરીકે કાર્ય કરે છે.
મેંગેનીઝ(III) પ્રબળ ઑક્સિડેશનકર્તા છે.
Mn3+ [Ar] 3d4 ના સાપેક્ષમાં Mn2+ [Ar] 3d5 વધારે સ્થાયી, અર્ધપૂર્ણ 3d ની રચના છે. આથી Mn3+નું રિડક્શન Mn2+ માં સરળતાથી થાય છે.
Mn3+ + \(\bar{e}\) → Mn2+ \(\mathrm{E}_{\mathrm{Mn}^{3+} / \mathrm{Mn}^{2+}}^{\ominus}\) = 1.57V
આ પ્રક્રિયાનો પોટેન્શિયલ ઊંચું ધન મૂલ્ય ધરાવે છે, આ કારણથી Mn3+ રિડક્શન પામી પ્રબળ ઑક્સિડેશનકર્તા તરીકે વર્તે છે.
(ii) કોબાલ્ટ (II) જલીય દ્રાવણમાં સ્થાયી છે પણ સંકીર્ણકર્તા પ્રક્રિયકોની હાજરીમાં તે સહેલાઈથી ઑક્સિડેશન પામે છે. કારણ કે કોબાલ્ટ(III) અવસ્થા વધારે સ્થાયી છે.
CO2+ : [Ar]18 3d7 ઓછો સ્થાયી છે અને
CO3+ : [Ar]18 3d6 વધારે સ્થાયી છે.
\(\mathrm{E}_{\mathrm{Co}^{3+} / \mathrm{Co}^{2+}}^{\ominus}\) = 1.97 V ઘણું વધારે મૂલ્ય છે.
ધન મૂલ્ય પ્રમાણે CO3+ ઑક્સિડેશનકર્તા પણ CO2+ રિડક્શનકર્તા છે અને ઑક્સિડેશન પામે છે.
(વળી સંકીર્ણમાં 3d7 (\(t_{2 \mathrm{~g}}^6\)1) કરતાં 3d6(teg9) વધુ સ્થાયી છે.)
(iii) આયનોમાં d1 ઇલેક્ટ્રૉનીય રચના અત્યંત અસ્થાયી છે.
કારણ કે ns2 માંના બે ઇલેક્ટ્રૉનને ગુમાવ્યા પછીથી d1 ઇલેક્ટ્રૉનીય રચના બને જેથી d1 અસ્થાયી હોય પણ d1 માંનો ઇલેક્ટ્રૉન ગુમાવીને ઘણી સ્થાયી ઉમદાવાયુની રચના સરળતાથી બની શકે છે. આ કારણથી d1 ઇલેક્ટ્રૉન ગુમાવીને ઑક્સિડેશન પામી રિડક્શનકર્તા અથવા વિષમીકરણ પ્રક્રિયાઓ આપે છે.
પ્રશ્ન 22.
‘વિષમીકરણ’નો અર્થ શું થાય ? જલીય દ્રાવણમાં વિષમીકરણ પ્રક્રિયા માટેના બે ઉદાહરણો જણાવો.
ઉત્તર:
Cu+ નું જલીય દ્રાવણમાં વિષમીકરણ થઈને વધુ સ્થાયી Cu2+(aq) અને Cu(s) બને છે. જે E⊖ ના મૂલ્યને અનુકૂળ છે.
2Cu+(aq) →Cu2+(aq) + Cu(s)
વિષમીકરણ પ્રક્રિયાનું ઉદાહરણ :

પ્રશ્ન 23.
સંક્રાંતિ ધાતુઓની પ્રથમ શ્રેણીની કઈ ધાતુ સૌથી વધુ વખત +1 ઑક્સિડેશન અવસ્થા દર્શાવે છે ?
ઉત્તર:
- સંક્રાંતિ ધાતુઓની પ્રથમ શ્રેણીની કૉપર ધાતુ સૌથી વધુ વખત +1 ઑક્સિડેશન અવસ્થા દર્શાવે છે.
- કારણ કે Cu+ તે [Ar]18 3d10 4s0 નું ઇલેક્ટ્રૉનીય રચના ધરાવે છે. જેમાં પેટાકોશ 3d સંપૂર્ણ ભરાયેલ છે.
![]()
પ્રશ્ન 24.
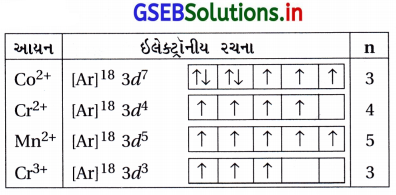
નીચે દર્શાવેલા વાયુમય આયનોમાં અયુગ્મિત ઇલેક્ટ્રોનોની સંખ્યા ગણો : Mn3+, Cr3+, V3+ અને Ti3+. આ પૈકીનું કયું ધનાયન જલીયદ્રાવણમાં સૌથી વધુ સ્થાયી છે ?
ઉત્તર:
V(Z = 23), Ti(Z = 22), Cr(Z = 24), Mn(Z = 25)
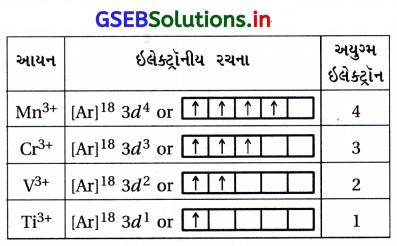
Cr3+ જલીય દ્રાવણમાં સૌથી વધુ સ્થાયી છે.
પ્રશ્ન 25.
સંક્રાંતિય રસાયણવિજ્ઞાનના નીચે દર્શાવેલા લક્ષણો માટે ઉદાહરણો આપો અને કારણો જણાવો :
(i) સંક્રાંતિ ધાતુના સૌથી નીચેનો ઓક્સાઇડ બેઝિક છે, જ્યારે સૌથી ઊંચો ઑક્સાઇડ ઊભયધર્મી/ઍસિડિક છે.
(ii) સંક્રાંતિ ધાતુ ઊંચી ઑક્સિડેશન અવસ્થા ઑક્સાઇડ સંયોજનો અને ફ્લોરાઇડ સંયોજનોમાં દર્શાવે છે.
(iii) ધાતુના ઓક્સોએનાયનો સૌથી ઊંચી ઑક્સિડેશન અવસ્થા દર્શાવ છે.
ઉત્તર:
(i) સંક્રાંતિ તત્ત્વોના ઑક્સાઇડ નીચી ઑક્સિડેશન અવસ્થામાં બેઝિક હોય છે પણ ઊંચી અવસ્થામાં ઉભયગુણી અથવા ઍસિડિક હોય છે.
ઉદા., CrO, Cr2O3 અને CrO3 માં Cr અનુક્રમે +2, +3 અને +6 છે. CrO બેઝિક, Cr2O3 ઉભયગુણી અને CrO3 ઍસિડિક છે.
ઉદા., MnO, Mn2O3 અને Mn2O7 માં Mn અનુક્રમે +2, +3 અને +7 છે. MnO બેઝિક, Mn2O3 ઉભયગુણી અને Mn2O7 ઍસિડિક છે.
ઉદા., FeO માં Fe2+ છે અને બેઝિક છે પણ Fe2O3 માં Fe3+ છે અને ઉભયગુણી છે.
કારણ કે નીચી સ્થિતિમાં ધાતુ અબંધકારક e– આપી બેઇઝ બને છે.
(ii) સંક્રાંતિ ધાતુ ઊંચી ઑક્સિડેશન અવસ્થા ઑક્સાઇડ સંયોજનો અને ફ્લોરાઇડ સંયોજનોમાં દર્શાવે છે. કારણ કે ઑક્સિજન અને ફ્લોરિનમાં કદ ઘણાં નાનાં તથા વિદ્યુતઋણતા ઘણી જ ઊંચી હોવાથી તેઓ ઇલેક્ટ્રૉન પ્રાપ્ત કરવાની પ્રબળ વૃત્તિ ધરાવે છે અને પ્રબળ ઑક્સિડેશનકર્તા તરીકે વર્તી મહત્તમ સંખ્યામાં ધાતુના ઇલેક્ટ્રૉન સ્વીકારે છે. પરિણામે ધાતુની ઊંચી ઑક્સિડેશન અવસ્થા ઑક્સાઇડ તથા ફ્લોરો સંયોજનોમાં છે.
ઉદા., V2O, CrO3, Mn2O7 ……ઑક્સાઇડ
TiF4, VF5, CrF6 ……ફ્લોરાઇડ
(iii) ધાતુના ઑક્સોએનાયનો સૌથી ઊંચી ઑક્સિડેશન અવસ્થા દર્શાવે છે. ઉદા., Cr2O2-7 અને CrO2-4 માં Cr6+ તે Cr ની સૌથી ઊંચી સ્થાયી અવસ્થા છે (CrO3 પૂરતો સ્થાયી નથી).
MnO–4 માં Mn7+ છે, જે Mnની સૌથી મહત્તમ સ્થાયી અવસ્થા છે.
CrO2-4, Cr2O2-7 અને MnO–4, ધાતુઓના ઑક્સો એનાયન છે. આ બધા સ્થાયી છે કારણ કે ઑક્સિજન નાના કદ અને ઊંચી વિદ્યુતઋણતા ધરાવતો હોવાથી, મજબૂત સવર્ગ બંધથી ધાતુની d-કક્ષકોમાં સવર્ગ બંધ રચે છે અને સ્થાયી સંકીર્ણો રચાય છે.
પ્રશ્ન 26.
નીચે દર્શાવલી બનાવટમાંના તબક્કાઓ સૂચવો :
(i) ક્રોમાઇટ અયસ્કમાંથી K2Cr2O7
(ii) પાયરોડ્યુસાઈટ અયસ્કમાંથી KMnO4
ઉત્તર:
(i) ક્રોમાઇટ અયસ્કમાંથી K2Cr2O7 ના તબક્કાઓ :
આયર્ન ક્રોમાઇટમાંથી પોટૅશિયમ ડાયક્રોમેટની બનાવટના :
- પોટૅશિયમ ડાયક્રોમેટ (K2Cr2O7)ની બનાવટ : સામાન્ય રીતે ક્રોમેટમાંથી ડાયક્રોમેટ સંયોજનો બનાવાય છે. ક્રોમાઇટ અયસ્ક (FeCr2O4)ની વધારે પડતી હવાની હાજરીમાં સોડિયમ અથવા પોટૅશિયમ કાર્બોનેટ સાથેની સંગલન પ્રક્રિયા વડે ક્રોમેટ મેળવાય છે.

- સોડિયમ ક્રોમેટ (Na2CrO4)ના પીળા દ્રાવણને ગાળ્યા પછી તેને સલ્ફ્યુરિક ઍસિડ ઉમેરીને ઍસિડિક બનાવવાથી નારંગી રંગનો સોડિયમ ડાયક્રોમેટ બને Na2Cr2O7 · 2H2O છે, જેનું સ્ફટિકીકરણ છે.
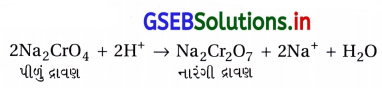
- સોડિયમ ડાયક્રોમેટ (Na2CrO4) કરતાં પોટૅશિયમ ડાયક્રોમેટ (K2Cr2O7) ઓછો દ્રાવ્ય છે. જેથી સોડિયમ ડાયક્રોમેટના દ્રાવણની પોટૅશિયમ ક્લોરાઇડ સાથેની પ્રક્રિયાથી પોટૅશિયમ ડાયક્રોમેટ બનાવવામાં આવે છે.

- દ્રાવણમાંથી પોટેશિયમ ડાયક્રોમેટના નારંગી રંગના સ્ફટિકનું સ્ફટિકીકરણથી અવક્ષેપન કરાય છે.
(ii) પાયરોલ્યુસાઇટ અયસ્કમાંથી KMnO4:
પોટૅશિયમ પરમેંગેનેટની બનાવટ : KMnO4 ના બનાવવાની રીતો નીચે પ્રમાણે છે :
(i) MnO2 ને આલ્કલી ધાતુ હાઇડ્રૉક્સાઇડ અને KNO3 જેવા ઑક્સિડેશનકર્તાની સાથે સંગલિત કરીને પોટૅશિયમ પરમેંગેનેટ બનાવાય છે. આથી ઘેરા લીલા રંગનો K2MnO4 બને છે, જેનું તટસ્થ અથવા ઍસિડિક દ્રાવણમાં વિષમીકરણ થઈને પરમેંગેનેટ (MnO-14) બને છે.
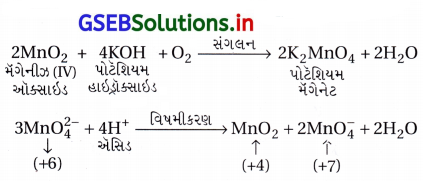
(ii) વ્યાપારિક સ્તરે KMnO4 ને MnO2 નું આલ્કલાઇન માધ્યમમાં ઑક્સિડેશન કરનારી સંગલન પ્રક્રિયા કર્યા પછીથી મેંગેનેટ(VI) નું વિદ્યુતવિભાજનીય ઑક્સિડેશનથી બનાવવામાં આવે છે.

પ્રશ્ન 27.
મિશ્રધાતુઓ એટલે શું ? અગત્યની મિશ્રધાતુ કે જે થોડી લેન્થેનોઇડ ધાતુઓ ધરાવે છે તેનું નામ આપો. તેના ઉપયોગો જણાવો.
ઉત્તર:
- મિશ્રધાતુઓ : તેઓ બે અથવા વધારે ધાતુઓ અથવા ધાતુઓનું અધાતુઓ સાથેનું સમાંગ મિશ્રણ છે.
- મિશધાતુ : 95% લેન્થેનોઇડ ધાતુ, 5% આયર્ન અને અલ્પ પ્રમાણમાં S, C, Ca અને Al હોય છે.
- ઉપયોગ : મિશધાતુનો મોટો જથ્થો Mg આધારિત મિશ્રધાતુ બનાવવામાં થાય છે. તે બંદૂકની ગોળી, કવચ અને લાઇટરમાં ચકમક માટેના પથ્થર બનાવવા ઉપયોગમાં લેવાય છે.
પ્રશ્ન 28.
આંતરસંક્રાંતિ તત્ત્વો એટલે શું ? નક્કી કરો કે નીચે દર્શાવેલામાંથી કયા પરમાણ્વીય ક્રમાંકો આંતરસંક્રાંતિ તત્ત્વોના છે : 29, 59, 74, 95, 102, 104
ઉત્તર:
- જે તત્ત્વોમાં છેલ્લે ઇલેક્ટ્રૉન f કોશમાં દાખલ થાય છે તેમને આંતરસંક્રાંતિ તત્ત્વો કહે છે.
- તેની બે શ્રેણી છે,
લેન્થેનોઇડ્સ (Z = 58 – 71)(લેન્થેનમ પછીનાં 14 તત્ત્વો)
ઍક્ટિનોઇડ્સ (Z = 90 – 103)(ઍક્ટિનિયમ પછીનાં 14 તત્ત્વો) - આંતરસંક્રાંતિ તત્ત્વો: 59, 95 અને 102 પરમાણુક્રમાંકના તત્ત્વો આંતરસંક્રાંતિ તત્ત્વો છે.
- 29, 74 અને 104 પરમાણુક્રમાંકનાં તત્ત્વો આંતરસંક્રાંતિ તત્ત્વો નથી.
![]()
પ્રશ્ન 29.
ઍક્ટિનોઇડ તત્ત્વોનું રસાયણવિજ્ઞાન, લેન્થેનોઇડ તત્ત્વોના રસાયણવિજ્ઞાન જેટલું સરળ હોતું નથી. આ તત્ત્વોની ઑક્સિડેશન અવસ્થાઓના આધારે કેટલાક ઉદાહરણો દ્વારા આ વિધાનનું વાજબીપણું ચર્ચો.
ઉત્તર:
- લેન્થેનોઇડ્સ અને ઍક્ટિનોઇડ્સ બંનેની સામાન્ય અવસ્થા +3 છે. ઍક્ટિનોઇડ Ac થી Pu સુધીનાં 5f શ્રેણીના પ્રથમ અડધા ભાગનાં તત્ત્વો સામાન્ય રીતે ઊંચી ઑક્સિડેશન અવસ્થા દર્શાવે છે.
- ઍક્ટિનોઇડ્સના +3 અને +4 આયનો જળવિભાજન પામવાનું વલણ ધરાવે છે. શરૂઆતના અને પછીના ઍક્ટિનોઇડ્સની ઑક્સિડેશન અવસ્થાઓના વિતરણમાં એટલી બધી અનિયમિતતા અને ભિન્નતા હોય છે કે જેથી ઑક્સિડેશન અવસ્થાઓના સંદર્ભમાં ઍક્ટિનોઇડ્સના રસાયણવિજ્ઞાનની સમીક્ષા સંતોષકારક કરી શકાય નહીં.
- જ્યારે લેન્થેનોઇડ્સનું રસાયણવિજ્ઞાન સરળ છે. તેઓ +2, +3, +4 અવસ્થાઓ સરળતાથી દર્શાવે છે. ઉદા., Ce4+, Ce2+, Eu2+, Eu4+, Pr4+, Nd4+, Tb4+ તેઓ O2, H2O, N, S,
X ઍસિડ સાથે સામાન્ય પ્રક્રિયાઓ આપે છે. આટલી સામાન્ય ક્રિયાઓ ઍક્ટિનોઇડ્સમાં નથી. - ઍક્ટિનોઇડમાં Th4+, Pa5+, V6+, Np7+ સુધીની ઊંચી ઑક્સિડેશન અવસ્થાઓ દર્શાવી શકે છે.
પ્રશ્ન 30.
ઍક્ટિનોઇડ્સ શ્રેણીમાં અંતિમ તત્ત્વ કયું છે ? આ તત્ત્વની ઇલેક્ટ્રૉનીય રચના લખો. આ તત્ત્વની શક્ય ઑક્સિડેશન અવસ્થા પર આલોચના કરો.
ઉત્તર:
- Lr(Z = 103), [Rn]86 5f14 6d1 7s2
- તેની શક્ય ઑક્સિડેશન અવસ્થાઓ Lr2+, Lr3+ છે. જેમાં 6d અને 7s ના કુલ ત્રણ ઇલેક્ટ્રૉન દૂર થવાથી Lr3+ સામાન્ય અવસ્થા છે.
પ્રશ્ન 31.
હુંડના નિયમનો ઉપયોગ કરી Ce3+ આયનની ઇલેક્ટ્રોનીય રચના તારવો અને તેની ચુંબકીય ચાકમાત્રા ‘ભ્રમણ-માત્ર’ સૂત્રના આધારે ગણો.
ઉત્તર:
Ce(Z = 58) જેથી Ce3+ માં 55 ઇલેક્ટ્રૉન હાજર હોય. તેની ઇલેક્ટ્રૉનીય રચના Ce3+[Xe]54 4f1 5d0 6s0.
∴ અયુગ્મ ઇલેક્ટ્રૉનની સંખ્યા = 1
∴ μ = \(\sqrt{n(n+2)}\) BM
= \(\sqrt{1(1+2)}\)
= √3
= 1.73 BM
પ્રશ્ન 32.
લેન્થેનોઇડ શ્રેણીના એવા સભ્યોનાં નામ આપો કે જે +4 અને +2 ઑક્સિડેશન અવસ્થા દર્શાવે છે. આ તત્ત્વોની આ પ્રકારની વર્તણૂકને તેમની ઇલેક્ટ્રોનીય રચના સાથે સહસંબંધિત કરવાનો પ્રયત્ન કરો.
ઉત્તર:
- લેન્થેનોઇડ શ્રેણીનાં +4 અને +2 ઑક્સિડેશન અવસ્થા ધરાવતા આયનો : દ્રાવણમાં અથવા ઘન સંયોજનોમાં ક્યારેક +2 અને +4 આંયનો પ્રાપ્ત થાય છે.
- આ લાક્ષણિકતા ખાલી (f0), અર્ધપૂર્ણ ભરાયેલી (f7) અથવા પૂર્ણ ભરાયેલી (f10) પેટાકોશ fની હાજરીના કારણે જોવા મળે છે અથવા તેની નજીકની રચનામાં હોય છે.
ઉદા., Ce4+ : [Xe]54 4f0 માં સંપૂર્ણ ખાલી 4f છે.
(Z = 58) Ce2+ : [Xe]54 4f2
\(\mathrm{E}_{\mathrm{Ce}^{4+} / \mathrm{Ce}^{2+}}^{\ominus}\) = +1.74V
Pr, Nd, Tb અને Dy પણ +4 અવસ્થા દર્શાવે છે.
| (Z = 59) | Pr4+ [Xe]54 4f1 |
| (Z = 60) | Nd4+ [Xe]54 4f2 |
| (Z = 65) | Tb4+ [Xe]54 4f7 |
| (Z = 66) | Dy4+ [Xe]54 4f8 |
પણ માત્ર MO2 ઑક્સાઇડ સંયોજનોમાં જ Ce, Eu, Yb, Sm ધાતુઓ +2 અવસ્થા દર્શાવે છે, જેમની ઇલેક્ટ્રૉનીય રચના નીચે પ્રમાણે છે :
| Ce2+ | Eu2+ | Yb2+ | Sm2+ |
| 4f2 | 4f7 | 4f14 | 4f16 |
આ આયનો પૈકી Eu2+ અર્ધપૂર્ણ પેટાકોશ (f7 ) અને Yb પૂર્ણ ભરાયેલ પેટાકોશ (f14 ) ધરાવે છે, જેથી વિશેષ સ્થાયી છે.
પ્રશ્ન 33.
નીચે દર્શાવેલી બાબતોના સંદર્ભમાં ઍક્ટિનોઇડ્સના રસાયણવિજ્ઞાનની સરખામણી લેન્થેનોઇડ્સના રસાયણવિજ્ઞાન સાથે કરો :
(i) ઇલેક્ટ્રૉનીય રચના
(ii) ઑક્સિડેશન અવસ્થાઓ અને
(iii) રાસાયણિક પ્રતિક્રિયાત્મકતા
ઉત્તર:
- સંક્રાંતિ આયનો સંકીર્ણ સંયોજનો રચવાનો લાક્ષણિક ગુણ ધરાવે છે.
- સંકીર્ણ સંયોજનો : સંકાર્ણ સંયોજનોમાં ધાતુ આયનો નિશ્ચિત સંખ્યામાં ઋણ આયન અથવા તટસ્થ અણુઓ સાથે બંધ બનાવેલ લાક્ષણિક સ્પિસીઝ છે. આવા સંકીર્ણ રચવાની વૃત્તિ સંક્રાંતિ આયનોમાં છે. સંકીર્ણ સ્વિસીઝનાં કેટલાક ઉદાહરણો [Fe(CN)6]4-, [Fe(CN)6]3-, [Cu(NH3)4]2+,[PtCl4]2-, [PtCl6]4- વગેરે.
- સંક્રાંતિ ધાતુઓ મોટી સંખ્યામાં સંકીર્ણ સંયોજનો બનવાના કારણો :
(i) સંક્રાંતિ ધાતુઓ સાપેક્ષીય નાનું કદ ધરાવે છે.
(ii) સંક્રાંતિ આયનોના ઊંચા આયનીય વીજભાર ધરાવે છે.
(iii) સંક્રાંતિ તત્ત્વોમાં આયનોમાં બંધ બનાવવા માટે d કક્ષકો પ્રાપ્ય હોય છે.
પ્રશ્ન 34.
પરમાણ્વીય ક્રમાંક 61, 91, 101 અને 109 વાળા તત્ત્વોની ઇલેક્ટ્રૉનીય રચના લખો.
ઉત્તર:
| Z | ઇલેક્ટ્રૉનીય રચના |
| 61 | [Xe]54 4f5 5d0 6s2 |
| 91 | [Rn]86 5f2 6d1 7s2 |
| 101 | [Rn]86 5f13 6d0 7s2 |
| 109 | [Rn]86 5f14 6d7 7s2 |
પ્રશ્ન 35.
સંક્રાંતિ તત્ત્વોની પ્રથમ શ્રેણીની સામાન્ય લાક્ષણિકતાઓની દ્વિતીય અને તૃતીય શ્રેણીની ધાતુઓ સાથે અનુવર્તી ઊભા સ્તંભોમાં સરખામણી કરો. નીચે દર્શાવેલા મુદ્દાને વિશેષ મહત્ત્વ આપો :
(i) ઇલેક્ટ્રોનીય રચના
(ii) ઑક્સિડેશન અવસ્થાઓ
(iii) આયનીકરણ એન્થાલ્પી અને
(iv) પરમાણ્વીય કદ
ઉત્તર:
(i) ઇલેક્ટ્રૉનીય રચના :
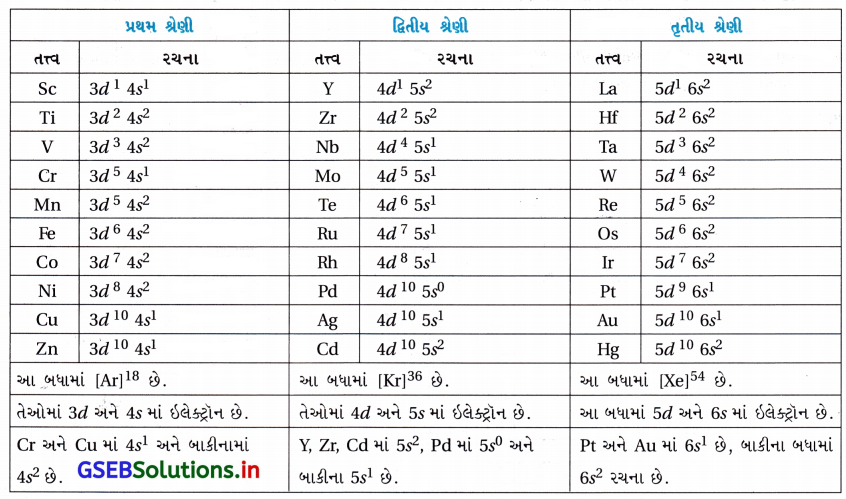
પ્રથમ શ્રેણીમાં 3d, 4s માં, દ્વિતીય શ્રેણીમાં 4d, 5s અને તૃતીય શ્રેણીમાં 5d, 6s માં બાહ્યતમ ઇલેક્ટ્રૉન છે.
(ii) ઑક્સિડેશન અવસ્થાઓ :
| પ્રથમ શ્રેણી | દ્વિતીય શ્રેણી | તૃતીય શ્રેણી |
| • પ્રથમ સંક્રાંતિ વિવિધ ઑક્સિડેશન અવસ્થાઓ દર્શાવે છે. | • સામાન્ય ઑક્સિડેશન અવસ્થા +2 અને +3 છે. જેમાં 680 રચના હોય છે. | • સામાન્ય અવસ્થામાં 7s0 હોય છે. |
| • પ્રથમ શ્રેણીનાં તત્ત્વોની વિવિધ અવસ્થામાં +2 અને +3 સામાન્ય છે. (અપવાદ Sc2+, Zn3+ નથી) |
• Rh2+, Rb3+, Rh4+, Pd2+, Ag+, Cd2+ જાણીતી છે. |
• Ir2+, Ir3+, Au3+ બને છે. પણ તેના જ સમૂહના Ag અને Cuની +3 સ્થિતિ નથી મળતી. |
| • આમાં Mn સુધીનાં તત્ત્વો +2 થી સમૂહ ક્રમ જેટલી મહત્તમ સ્થિતિ દર્શાવે છે. | • Sc3+, Y3+ અને La3+ સામાન્ય સ્થિતિ સ્થાયી છે અને +2 નથી. |
સમૂહ 8 માં Fe ની +2 અને +3 સામાન્ય સ્થિતિ છે, પણ તે જ સમૂહના Ru અને Os ની +4, +6 અને +8 સ્થિતિ જાણીતી છે. (iii) આયનીકરણ ઍન્થાલ્પી : આયનીકરણ ઍન્થાલ્પી એક જ સમૂહમાં સામાન્ય નિયમ પ્રમાણે 34 → 4d → 5d શ્રેણી તરફ ઘટે. કારણ કે પરમાણ્વીય કદ વધે છે.
વાસ્તવિકતામાં 54 શ્રેણીનાં તત્ત્વોની આયનીકરણ ઍન્થાલ્પી 3d શ્રેણીનાં તત્ત્વો કરતાં વધારે હોય છે. કારણ કે 50માં ભરાયેલ 4f થી થતા શીલ્ડિંગનું પરિણામ છે.
(iv) પરમાણ્વીય કદ : પ્રથમ સંક્રાંતિ શ્રેણી (3d)ના તત્ત્વોની સરખામણીમાં દ્વિતીય સંક્રાંતિ શ્રેણી(4d)ના તત્ત્વોના પરમાણ્વીય કદ મોટા હોય છે. પણ તૃતીય સંક્રાંતિ શ્રેણી (5đ)ના તત્ત્વોના પરમાણ્વીય કદ લગભગ દ્વિતીય સંક્રાંતિ શ્રેણીના અનુવર્તી સભ્યોના પરમાણ્વીય કદ જેટલા જ હોય છે.
આમાં લેન્થેનોઇડ સંકોચન થાય છે. જેના કારણે દ્વિતીય અને તૃતીય શ્રેણીના તત્ત્વો લગભગ સમાન ત્રિજ્યા દર્શાવે છે. (ઉદા., Zr, 160 pm, Hf 159 pm) (જુઓ પાઠ્યપુસ્તક આકૃતિ 8.3)
![]()
પ્રશ્ન 36.
નીચે દર્શાવેલા દરેક આયનોમાં ઇલેક્ટ્રૉનની સંખ્યા લખો : Ti2+, V2+, Cr3+, Mn2+, Fe2+, Fe3+, CO2+, Ni2+ અને Cu2+ આ જળયુક્ત આયનો (અષ્ટલકીય) માટે પાંચ 3d કક્ષકો કેવી રીતે ભરાશે તે અંગે તમારી અપેક્ષા જણાવો.
ઉત્તર:
આયન Ti2+(Z = 22)
ઇલેક્ટ્રૉનીય રચના [Ar]18 3d24s0
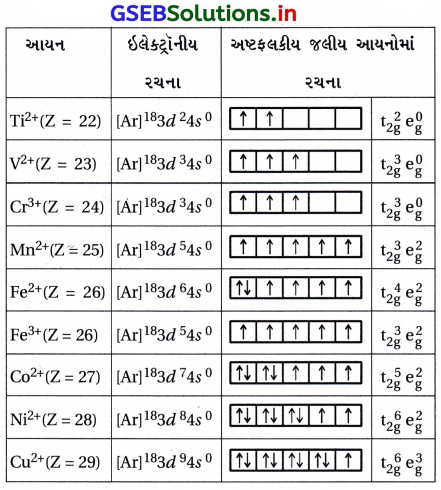
પ્રશ્ન 37.
પ્રથમસંક્રાંતિના તત્ત્વો, ભારે સંક્રાંતિ તત્ત્વો કરતાં ઘણા જુદા ગુણધર્મો ધરાવે છે. આ વિધાનની આલોચના કરો.
ઉત્તર:
પ્રથમસંક્રાંતિ તત્ત્વો, ભારે સંક્રાંતિ તત્ત્વો કરતાં ઘણા જુદા જુદા ગુણધર્મો ધરાવે છે. ઉદા.,
- પ્રથમસંક્રાંતિ શ્રેણીના તત્ત્વો આયર્ન, કૉપરના સાપેક્ષ ભારે સંક્રાંતિ તત્ત્વો સિલ્વર અને ગોલ્ડ ઘણાં ભિન્ન છે.
- Th, Pa અને U જેવાં ભારે તત્ત્વો કેન્દ્રિય રસાયણમાં ઊર્જાના શ્રેષ્ઠ સ્રોત તરીકે પુરવાર થયાં છે, તેના જેમ પ્રથમ સંક્રાંતિ શ્રેણીનાં તત્ત્વો નથી.
- પ્રથમ શ્રેણીના તત્ત્વોના કદ, પરમાણ્વીયકરણ ઊર્જા, ઑક્સિડેશન અવસ્થાઓ, રંગ, ચુંબકીય ગુણો, આંતરાલીય સંયોજનો વગેરે. બધા લાક્ષણિક ગુણોમાં નિયમિતતા છે. તેવી નિયમિતતા ભારે તત્ત્વો ધરાવતા નથી.
આ તત્ત્વોના નીચેના ગુણધર્મોમાં ભિન્નતા છે :
- ગલનબિંદુ
- પરમાણ્વીય ઍન્થાલ્પી
- આયનીકરણ ઍન્થાલ્પી
- ઑક્સિડેશન અવસ્થાઓ
પ્રશ્ન 38.
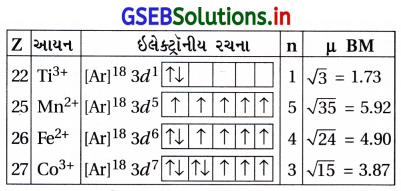
નીચે દર્શાવલી સંકીર્ણ સ્પિસીઝો માટેના ચુંબકીય ચાકમાત્રાના મૂલ્યો પરથી શું નિષ્કર્ષ નીકળી શકે છે ?
ઉદાહરણ – ચુંબકીય ચાકમાત્રા (BM)
K4[Mn(CN)6] – 2.2
[Fe(H2O)6]2+ – 5.3
K2[MnCl4] – 5.9
ઉત્તર:
(i) K4[Mn(CN)6] ની ચુંબકીય ચાકમાત્રા = 2.2 છે.
જેથી તેમાંના મેંગેનીઝ(II) આયનમાં 1 અયુગ્મિત ઇલેક્ટ્રૉન હોવો જોઈએ. (કારણ કે n = 1 તો μ = 1.73 BM અને n = 2 તો μ = 2.83 BM છે.)
Mn2+ હોવાથી સામાન્ય રચના 3d5 હોવી જોઈએ પણ આ સંકીર્ણમાં \(\mathrm{t}_{2 \mathrm{~g}}^5 \mathrm{~d}_{\mathrm{g}}^0\) ની નીચેની રચના હોય.
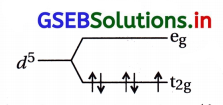
આમાં n = 1 અયુગ્મિત ઇલેક્ટ્રૉન અને μ (સૈદ્ધાંતિક)
1.73 ≈ 2.2 BM
(ii) [Fe(H2O)6]2+ ની ચુંબકીય ચાકમાત્રા 5.3 BM છે.
આમાં Fe2+ આયન તે 3d6 છે અને લિગેન્ડ H2O છે. પ્રાયોગિક μ = 5.3 BM છે.
જો n = 4 હોય તો સૈદ્ધાંતિક μ = 4.97 થાય. જેથી આ સંકીર્ણના Fe2+ આયનમાં 4 અયુગ્મિત ઇલેક્ટ્રૉનની હાજરી હોવી જોઈએ.
∴ Fe2+, 3d6 અષ્ટફલકીય એક્વા સંકીર્ણમાં \(\mathrm{t}_{29}^4 \mathrm{e}_{\mathrm{g}}^2\) હોવો જોઈએ.
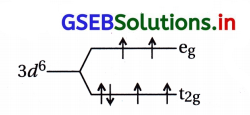
આ રચના પ્રમાણે અયુગ્મિત ઇલેક્ટ્રૉન = 4 છે.
(iii) K2[MnCl4]ની ચુંબકીય ચાકમાત્રા 5.9 BM છે.
ચુંબકીય ચાકમાત્રા 5.9 BM છે, જેથી તેમાં અયુગ્મિત ઇલેક્ટ્રૉન n = 5 હોવા જોઈએ. જેથી
μ = \(\sqrt{n(n+2)}=\sqrt{5(5+2)}\) = 5.92 BM
K2[MnCl4]માં Mn2+ આયન છે તથા સમચતુલકીય આવરણ છે. Mn2+ એટલે 3d5 ઇલેક્ટ્રૉનીય રચના થાય.
GSEB Class 12 Chemistry d અને f-વિભાગનાં તત્ત્વો NCERT Exemplar Questions and Answers
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-I)
પ્રશ્ન 1.
સંક્રાંતિ તત્ત્વ Xની ઇલેક્ટ્રૉનીય રચના +3 ઑક્સિડેશન અવસ્થામાં [Ar]3d5 છે, તો તેનો પરમાણ્વીયક્રમાંક શું છે ?
(A) 25
(B) 26
(C) 27
(D) 24
જવાબ
(B) 26
X3+ : [Ar]3d5 છે.
∴ X3+માં ઇલેક્ટ્રૉન સંખ્યા = 18+ 5 = 23
∴ Xમાં ઇલેક્ટ્રૉન સંખ્યા = 23+ 3 = 26
જેથી વિકલ્પ (B) સાચો છે અને આ તત્ત્વ X તે Fe હશે.
પ્રશ્ન 2.
Cu(II)ની ઇલેક્ટ્રૉનીય રચના 3d9 છે જ્યારે Cu(I)નું ઇલેક્ટ્રોનીય 3d10 છે. નીચેનામાંથી કયું વિધાન સાચું છે ?
(A) Cu(II) વધુ સ્થાયી છે.
(B) Cu(II)ની સ્થિરતા ઓછી છે.
(C) Cu(I) અને Cu(II)ની સ્થિરતા સમાન છે.
(D) Cu(I) અને Cu(II)ની સ્થિરતા કૉપરના ક્ષારની પ્રકૃતિ ઉપર આધાર રાખે છે.
જવાબ
(A) Cu(II) વધુ સ્થાયી છે.
- Cu(I) 3d10 અને Cu(II) 3d9 છે; જેથી Cu(I) સંપૂર્ણ ભરાયેલ 3d ધરાવે છે અને વધારે સ્થાયી છે તેવું લાગે, પણ વાસ્તવિકતામાં Cu(I)ના કરતાં Cu(II) વધુ સ્થાયી છે.
- Cu(I) અને Cu(II) બન્નેમાં સમાન કેન્દ્રીયભાર (29) છે, પણ Cu(II)માં અસરકારક કેન્દ્રીયભાર છે.
2Cu+ → Cu2+ + Cu - Cu+નું વધુ સ્થાયી Cu2+માં પરિવર્તન થાય છે, Cu2+ વધુ સ્થાયી છે.
![]()
પ્રશ્ન 3.
કેટલાંક સંક્રાંતિ તત્વોની ધાત્વીય ત્રિજ્યા નીચે આપેલ છે. નીચેનામાંથી કયા તત્ત્વની ઘનતા સૌથી વધુ છે ?

(A) Fe
(B) Ni
(C) CO
(D) Cu
જવાબ
(D) Cu
- આ બધાંની ઘનતા લગભગ સમાન હોય છે.
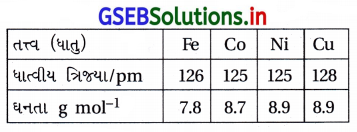
- જોકે એક જ હરોળમાં કેન્દ્રીયભાર વધે તેમ ઘનતા વધે, જે અનુસાર Cuની ઘનતા મહત્તમ થાય. વળી Cuનું પરમાણ્વીય દળ આપેલાં બધામાં મહત્તમ હોવાથી Cuની ઘનતા મહત્તમ થાય.
પ્રશ્ન 4.
સંક્રાંતિ તત્ત્વો સામાન્ય રીતે અયુગ્મિત ઇલેક્ટ્રોનને કારણે રંગીન ક્ષારો બનાવે છે. નીચેનામાંથી કયા સંયોજનો ઘન- અવસ્થામાં રંગીન સંયોજન બનાવે છે ?
(A) Ag2SO4
(B) CuF2
(C) ZnF2
(D) Cu2Cl2
જવાબ
(B) CuF2
- CuF2માં Cu2+ આયન છે, જે 3d9 છે અને તેમાં 1 અયુગ્મિત ઇલેક્ટ્રૉન છે જે કારણથી CuF2 રંગીન ઘન હોય છે.
- (A) Ag2SO4માં Ag+, (C) ZnF2માં Zn2+ અને (D)માં Cu2Cl2માં Cu+માં અયુગ્મિત ઇલેક્ટ્રૉન હાજર નથી તેથી ત્રણેય ઘન રંગવિહીન છે.
પ્રશ્ન 5.
સાંદ્ર H2SO4માં ખૂબ જ ઓછા પ્રમાણમાં KMnO4 ઉમેરવામાં આવે, તો લીલા રંગનું તૈલી સંયોજન મળે છે જે વિસ્ફોટક છે. તો નીચેનામાંથી તે સંયોજનને ઓળખો.
(A) Mn2O7
(B) MnO2
(C) MnSO4
(D) Mn2O3
જવાબ
(A) Mn2O7
- સાંદ્ર H2SO4માં KMnO4 ઉમેરવાથી નીચે પ્રમાણે પ્રક્રિયા થાય છે.

- આ Mn2O7 તૈલી ગ્રીન સંયોજન છે, તે ઑક્સિજનથી ભરપૂર હોવાથી વિસ્ફોટક છે અને MnO2માં વિઘટન પામે છે.
2Mn2O7 → 4MnO2 + 3O2
પ્રશ્ન 6.
તત્ત્વોનો ચુંબકીય ગુણધર્મ તેના અયુમ્મિત ઇલેક્ટ્રોન ઉપર આધાર રાખે છે. સૌથી વધુ ચુંબકીય ચાકમાત્રા ધરાવતું સંક્રાંતિ તત્ત્વનું ઇલેક્ટ્રોનીય બંધારણ ઓળખો.
(A) 3d7
(B) 3d5
(C) 3d8
(D) 3d2
જવાબ
(B) 3d5
- જેમ અયુગ્મિતd ઇલેક્ટ્રૉનની સંખ્યા વધારે હોય તેમ તેની ચુંબકીય ચાકમાત્રા વધારે હોય છે. μ = \(\sqrt{n(n+2)}\) BM જ્યાં n = અયુગ્મિત d ઇલેક્ટ્રૉનની સંખ્યા.
- આપેલી રચનાઓમાં અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યા નીચે પ્રમાણે છે :
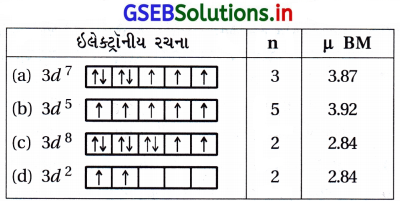
- આમ, 3d5 ની ચુંબકીય ચાકમાત્રા મહત્તમ છે.
પ્રશ્ન 7.
લેન્થેનોઇડ તત્ત્વો માટે નીચેનામાંથી કઈ ઑક્સિડેશન અવસ્થા સામાન્ય છે ?
(A) +2
(B) +3
(C) +4
(D)+5
જવાબ
(B) +3
લેન્થેનોઇડ્સની સામાન્ય ઑક્સિડેશન અવસ્થા +3 છે. જોકે કેટલાંક અન્ય +2, +4, વગેરે f0, f7, f14ની રચનાવાળી સ્થાયી અવસ્થાઓ પણ દર્શાવે છે.
પ્રશ્ન 8.
નીચેનીમાંથી કયું સમીકરણ વિષમીકરણ સમીકરણ છે ?
(i) Cu+ → Cu2+ + Cu
(ii) 3MnO-24 + 4H+ → 2 MnO–4 + MnO2 + 2H2O
(iii) 2KMnO4 → K2MnO4 + MnO2 + O2
(iv) 2 MnO–4 + 3Mn2+ + 2H2O → 5MnO2 + 4H+
(A) (i), (ii)
(B) (i), (ii), (iii)
(C) (ii), (iii), (iv)
(D) (i), (iv)
જવાબ
(A) (i), (ii)
- વિષમીકરણ પ્રક્રિયા : જે પ્રક્રિયામાં એક જ પરમાણુનું ઑક્સિડેશન તથા રિડક્શન થતું હોય તેવી પ્રક્રિયાઓ છે.
પ્રક્રિયા (i) નીચે પ્રમાણે છે :
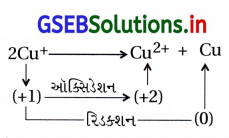
- આ પ્રક્રિયામાં Cu+નું ઑક્સિડેશન Cu2+માં અને રિડક્શન Cu0માં થતું હોવાથી વિષમીકરણ છે.
પ્રક્રિયા (ii) નીચે પ્રમાણે છે :
- આ પ્રક્રિયા (ii) પણ વિષમીકરણ છે, કારણ કે તેમાં \(\mathrm{MnO}_4^{2-}\) નું ઑક્સિડેશન તથા રિડક્શન થાય છે.
(નોંધ : અહીં પ્રશ્નમાં \(\mathrm{MnO}_4^{2-}\) પ્રક્રિયક તરીકે લેવો પડે.)
![]()
પ્રશ્ન 9.
ઑક્ટ્રેલિક એસિડના દ્રાવણમાં KMnO4નું દ્રાવણ ઉમેરવામાં આવે, તો શરૂઆતમાં રંગ દૂર થવાની ક્રિયા ધીમી હોય છે. પરંતુ થોડા સમય બાદ તરત જ રંગ દૂર થાય છે કારણ કે
(A) નીપજ તરીકે CO2 બને છે.
(B) પ્રક્રિયા ઉષ્માક્ષેપક છે.
(C) \(\mathrm{MnO}_4^{-}\) પ્રક્રિયામાં ઉદ્દીપક તરીકે વર્તે છે.
(D) Mn2+ સ્વયં ઉદ્દીપક (auto catalyst) તરીકે વર્તે છે.
જવાબ
(D) Mn2+ સ્વયં ઉદ્દીપક (auto catalyst) તરીકે વર્તે છે.
- ઑક્ઝેલિક ઍસિડના દ્રાવણમાં KMnO4નું દ્રાવણ ઉમેરવામાં આવે ત્યારે નીચેની રેડોક્ષ પ્રક્રિયા થાય છે.

- પ્રક્રિયાના પ્રારંભમાં પ્રક્રિયા ધીમી થાય છે પણ KMnO4 (\(\mathrm{MnO}_4^{-}\) ) ઉમેરતાં તે તરત જ H2S2O4, (C2\(\mathrm{O}_4^{2-}\)) સાથે
પ્રક્રિયા કરી Mn+2 ઉત્પન્ન કરે છે; જે Mn2+ સ્વયં ઉદ્દીપન કરી પ્રક્રિયાવેગ વધારે છે અને ત્વરિત KMnO4 થાય છે.
પ્રશ્ન 10.
ઍક્ટિનોઇડ શ્રેણીમાં 14 તત્ત્વો છે. નીચેનામાંથી કયું તત્ત્વ આ શ્રેણીનું સભ્ય નથી ?
(A) U
(B) NP
(C) Tm
(D)Fm
જવાબ
(C) Tm
Tm (Z = 69) ઍક્ટિનોઇડ્સ શ્રેણીમાં નથી. ઍક્ટિનોઇડ્સ શ્રેણીનાં તત્ત્વોના પરમાણુક્રમાંક Z = 90 થી 103 હોય છે. Tm (થુલિયમ) તે લેન્થેનોઇડ છે.
પ્રશ્ન 11.
KMnO4 ઍસિડિક માધ્યમમાં ઑક્સિડેશનકર્તા તરીકે વર્તે છે, તો ઍસિડિક માધ્યમમાં એક મોલ સલ્ફાઇડ આયનને ઑક્સિડાઇઝ કરવા માટે કેટલા મોલ KMnO4ની જરૂર પડે છે ?
(A) \(\frac{2}{5}\)
(B) \(\frac{3}{5}\)
(C) \(\frac{4}{5}\)
(D) \(\frac{1}{5}\)
જવાબ
(A) \(\frac{2}{5}\)
KMnO4 અને H2S વચ્ચે ઍસિડિક માધ્યમમાં નીચેની રેડોક્ષ પ્રક્રિયા થાય છે.
2MnO–4 + 16H+ + 5S2- → 2Mn2+ + 5S + 8H2O
∴ 2 મોલ KMnO4ની સાથે 5 મોલ સલ્ફાઇડ આયન પ્રક્રિયા કરે જેથી 1 મોલ સલ્ફાઇડ આયન સાથે પ્રક્રિયા કરવામાં \(\frac{2}{5}\) \(\frac{2}{5}\) મોલ KMnO4 ની જરૂર પડશે.
પ્રશ્ન 12.
નીચેનામાંથી કયા ઑક્સાઇડ ઊભયગુણધર્મી છે ?
Mn2O7, CrO3, Cr2O3, CrO,V2O5, V2O4
(A) V2O5, Cr2O3
(B) Mn2O7, CrO3
(C) CrO, V2O5
(D) V2O5, V2O4
જવાબ
(A) V2O5, Cr2O3
- V2O5 અને Cr2O3 તે બન્ને ઉભયગુણી ઑક્સાઇડ છે, કારણ કે તેઓ ઍસિડ અને બેઇઝ બન્નેની સાથે પ્રક્રિયા કરે છે.
Cr2O3 ઉભયગુણી છે કારણ કે –
(ઍસિડ) Cr2O3 + NaOH (બેઇઝ) → Na2Cr2O4 + H2O (બેઇઝ) Cr2O3 + 3H2SO4 (ઍસિડ) → Cr2(SO4)3 + 3H2O - V2O5 ઉભયગુણી છે પણ તે ઍસિડિક વધારે અને બેઝિક ઓછો છે.
પ્રશ્ન 13.
ગેડોલિનિયમ 4F શ્રેણીનું તત્ત્વ છે. તેનો પરમાણ્વીયક્રમાંક 64 છે. નીચેનામાંથી કયું ગેડોલિનિયમની ઇલેક્ટ્રોનીય રચના છે ?
(A) [Xe] 4f75d16s2
(B) [Xe] 4f65d26s2
(C) [Xe] 4f86d2
(D) [Xe] 4f95s1
જવાબ
(A) [Xe] 4f75d16s2
| ક્રમ | ઇલેક્ટ્રૉનીય રચના | પરમાણ્વીય ક્રમાંક |
| (a) | (a) [Xe]54 4f75d16s2 | 64 |
| (b) | (b) [Xe]54 4f65d26s2 | 64 |
| (c) | (c) [Xe]54 4f86d2 | 64 |
| (d) | (d) |[Xe]54 4f95s1 | 64 |
- ઇલેક્ટ્રૉનીય રચના (a)માં 4f7 છે, જેમાં અર્ધપૂર્ણ પેટાકોશ 4fની વિશિષ્ટ સ્થાયિતા છે માટે Gdની સાચી ઇલેક્ટ્રૉનીય રચના (a) છે.
- જ્યારે (b), (c) અને (d)માં Z 64 છે. અસ્થાયી રચના હોવાથી તે Gd માટે ખોટી રચના છે.
પ્રશ્ન 14.
જ્યારે ધાતુની સ્ફટિક રચનામાં નાના પરમાણુઓ ગોઠવાય છે ત્યારે આંતરાલીય સંયોજનો બને છે. નીચેનામાંથી કયો ગુણધર્મ આંતરાલીય સંયોજનોનો લાક્ષણિક ગુણધર્મ નથી ?
(A) શુદ્ધ ધાતુની સરખામણીમાં તેમનાં ગલનબિંદુ ઊંચાં હોય છે.
(B) ખૂબ જ સખત હોય છે.
(C) તે ધાતુઓની વાહકતા જાળવી રાખે છે.
(D) તે રાસાયણિક રીતે ખૂબ જ સક્રિય છે.
જવાબ
(D) તે રાસાયણિક રીતે ખૂબ જ સક્રિય છે.
હકીકતમાં આંતરાલીય સંયોજનની પ્રતિક્રિયાત્મકતા તેમના મૂળ તત્ત્વોના જેવી જ રહે છે પણ વધતી નથી.
પ્રશ્ન 15.
ચુંબકીય ચાકમાત્રા ધરીભ્રમણ કોણીય વેગમાન અને કક્ષીય કોણીય વેગમાન સાથે સંકળાયેલ છે. Cr+3 આયનની માત્ર ધરીભ્રમણ કોણીય વેગમાન ઉપર આધારિત ચુંબકીય ચાકમાત્રાનું મૂલ્ય ……………………. છે.
(A) 2.87 BM
(B) 3.87 BM
(C) 3.47 BM
(D) 3.57 BM
જવાબ
(B) 3.87 BM
- Cr3+ [Ar]18 3d3 4s0 છે
- Cr3+માં અયુગ્મ 3d ઇલેક્ટ્રૉનની સંખ્યા n = 3 છે
- આયનની સ્પિન માત્ર ચુંબકીય ચાકમાત્રાનું સૈદ્ધાંતિક મૂલ્ય μ હોય તો,
μ = \(\sqrt{n(n+2)}\) BM
= \(\sqrt{3(3+2)}\) BM = \(\sqrt{15}\) BM = 3.87 BM
![]()
પ્રશ્ન 16.
આલ્કલાઇન માધ્યમમાં KMnO4 ઑક્સિડેશનકર્તા તરીકે વર્તે છે. જ્યારે આલ્કલાઇન KMnO4ની પ્રક્રિયા KI સાથે થાય છે ત્યારે આયોડાઇડ આયનનું ઑક્સિડેશન …………………… માં થાય છે.
(A) I2
(B) IO–
(C) \(\mathrm{IO}_3^{-}\)
(D) \(\mathrm{IO}_4^{-}\)
જવાબ
(C) \(\mathrm{IO}_3^{-}\)
આલ્કલાઇન માધ્યમમાં KMnO4 અને KI(I–) વચ્ચે નીચેની રેડોક્ષ પ્રક્રિયા થાય છે અને KMnO4 વડે I– નું \(\mathrm{IO}_3^{-}\)માં ઑક્સિડેશન થાય છે.
2KMnO4 + KI + H2O → 2KOH + KIO3 + 2MnO2
અથવા આયોનિક પ્રક્રિયા
\(2 \mathrm{MnO}_4^{-}\) + I– + H2O → 2OH– + \(\mathrm{IO}_3^{-}\) + 2MnO2

પ્રશ્ન 17.
નીચેનામાંથી કયું વિધાન સાચું નથી ?
(A) કૉપર ઍસિડમાંથી હાઇડ્રોજન વાયુ મુક્ત કરે છે.
(B) ઉચ્ચ ઑક્સિડેશન અવસ્થામાં મેંગેનીઝ, ઑક્સિજન અને ફ્લોરિન સાથે સ્થાયી સંયોજનો બનાવે છે.
(C) જલીય માધ્યમમાં Mn3+ અને CO+3 પ્રબળ ઑક્સિડેશનકર્તા છે.
(D) જલીય માધ્યમમાં Ti2+ અને Cr2+ રિડક્શનકર્તા છે.
જવાબ
(A) કૉપર ઍસિડમાંથી હાઇડ્રોજન વાયુ મુક્ત કરે છે.
- (\(\mathrm{E}_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{\ominus}\)) = 0.34 V
(\(\mathrm{E}_{\mathrm{H}^{+} / \mathrm{H}_2}^{\ominus}\)) = 0.0 V - emf શ્રેણીમાં H2ની ઉપર Cu છે; અને H2ના કરતાં Cu નો E⊖ પોટૅન્શિયલ વધારે હોવાથી Cu વડે H+માંથી H2 મુક્ત થતો નથી. Cu + H+ → પ્રક્રિયા થતી નથી. તેથી વિકલ્પ (A) સાચો નથી.
- પણ વિધાનો (B), (C) તથા (D) ત્રણેય સાચાં છે.
પ્રશ્ન 18.
જ્યારે Sn2+ના ક્ષારમાં K2Cr2O7નું એસિડિક દ્રાવણ ઉમેરવામાં આવે ત્યારે Sn2+ નું ………………………. માં પરિવર્તન થાય છે.
(A) Sn
(B) Sn3+
(C) Sn4+
(D) Sn+
જવાબ
(C) Sn4+
K2Cr2O7 ના ઍસિડિક દ્રાવણને Sn+2ના ક્ષારમાં ઉમેરવાથી Cr2O2-7 વડે Sn2+ નું Sn4+ માં ઑક્સિડેશન થાય છે અને Cr2O2-7નું Cr3+માં રિડક્શન થાય છે. આ પ્રક્રિયા નીચે પ્રમાણે છે.
પ્રશ્ન 19.
મેંગેનીઝના ફ્લોરાઇડ (MnF4)માં મેંગેનીઝની ઉચ્ચ ઑક્સિડેશન અવસ્થા +4 છે જ્યારે ઑક્સાઇડ (Mn2O7)માં +7 છે. કારણ કે………………
(A) ફ્લોરિનની વિદ્યુતઋણતા ઑક્સિજનથી વધુ છે.
(B) ફ્લોરિન d-કક્ષકો ધરાવતું નથી.
(C) ફ્લોરિન નીચી ઑક્સિડેશન અવસ્થાને સ્થિર કરે છે.
(D) સહસંયોજક સંયોજનમાં ફ્લોરિન એકલ બંધ બનાવે છે જ્યારે ઑક્સિજન દ્વિબંધ બનાવે છે.
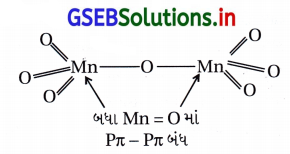
જવાબ
(D) સહસંયોજક સંયોજનમાં ફ્લોરિન એકલ બંધ બનાવે છે જ્યારે ઑક્સિજન દ્વિબંધ બનાવે છે.
F વડે Pπ-Pπ બંધ બનતો નથી પણ O વડે બને છે. ઑક્સિજનની વિદ્યુતઋણતા Fના કરતાં ઓછી છે, વળી ઑક્સિજન સંક્રાંતિ ધાતુ (આયન)ને સાથે Pπ-Pπ બંધ બનાવી શકે છે, જેથી Mnના બધા જ ઇલેક્ટ્રૉન (Mn7+)માં ઑક્સિજનની સાથે બંધ રચી શકે છે.
પ્રશ્ન 20.
ઝિરકોનિયમ 4d સંક્રાંતિ શ્રેણીનું સભ્ય છે. જ્યારે હોફનિયમ 50 સંક્રાંતિ શ્રેણીનું સભ્ય છે પરંતુ તેમની ભૌતિક અને રાસાયણિક પ્રક્રિયા સમાન છે. કારણ કે …………………..
(A) બન્ને d-વિભાગનાં તત્ત્વો છે.
(B) બન્ને સમાન સંખ્યામાં ઇલેક્ટ્રૉન ધરાવે છે.
(C) બન્નેની પરમાણ્વીય ત્રિજ્યા સમાન છે.
(D) બન્ને આવર્ત કોષ્ટકમાં એક જ સમૂહમાં અસ્તિત્વ ધરાવે છે.
જવાબ
(C) બન્નેની પરમાણ્વીય ત્રિજ્યા સમાન છે.
Zr અને Hfમાં લેન્થેનોઇડ સંકોચન થવાથી તેમની પરમાણ્વીય અને આયનીય ત્રિજ્યા લગભગ સમાન છે.
| Zr 160 pm | Zr4+ 79 pm |
| Hf 159 pm | Hf4+ 78 pm |
આ કારણથી તેમનાં ભૌતિક અને રાસાયણિક ગુણધર્મોમાં સમાનતા છે.
પ્રશ્ન 21.
KMnO4 વડે થતી ઑક્સિડેશન પ્રક્રિયામાં માધ્યમને ઍસિડિક બનાવવા માટે શા માટે HCl નો ઉપયોગ થતો નથી ?
(A) KMnO4 અને HCl બન્ને ઑક્સિડેશનકર્તા તરીકે વર્તે છે.
(B) KMnO4 એ HClનું ઑક્સિડેશન Cl2માં કરે છે જે પોતે સ્વયં ઑક્સિડેશનકર્તા છે.
(C) KMnO4 તે HCl કરતાં નિર્બળ ઑક્સિડેશનકર્તા છે.
(D) HClની હાજરીમાં KMnO4 રિડક્શનકર્તા તરીકે વર્તે છે.
જવાબ
(B) KMnO4 એ HClનું ઑક્સિડેશન Cl2માં કરે છે જે પોતે સ્વયં ઑક્સિડેશનકર્તા છે.
- KMnO4 ઑક્સિડેશનકર્તા છે અને HCl રિડક્શનકર્તા છે જેથી KMnO4 વડે HClનું નીચે પ્રમાણે ઑક્સિડેશન થાય છે. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
- આ રીતે KMnO4 અન્યનું ઑક્સિડેશન કરવાની સાથે HClનું પણ ઑક્સિડેશન કરી Cl2 મુક્ત કરે છે જેમાં KMnO4 વપરાય છે, એટલે KMnO4 સાચું મૂલ્ય (કદ) HClની હાજરીમાં મળી શકતું નથી. આ કારણથી ઍસિડીકરણ કરવા માટે HCl વપરાતો નથી.
![]()
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-II)
પ્રશ્ન 1.
સામાન્ય રીતે અયુમ્મિત ઇલેક્ટ્રૉનને કારણે સંક્રાંતિ તત્ત્વોના સંયોજનો રંગીન હોય છે. નીચેનામાંથી ક્યાં સંયોજનો
રંગીન છે ?
(A) KMnO4
(B) Ce(SO4)2
(C) TiCl4
(D) Cu2Cl2
જવાબ
(A), (B)
- (A) KMnO4માં Mn7+(d0) છે. અયુગ્મિત d ઇલેક્ટ્રૉન નથી; તેમ છતાં વીજભારના સ્થળાંતરથી d-d સંક્રમણ થવાથી રંગીન છે.
- (B) Ce(SO4)2માં Ce4+(4f0) છે. અયુગ્મિત f ઇલેક્ટ્રૉન નથી; તેમ છતાં પીળા રંગનો છે કારણ કે વીજભારનું સ્થળાંતર થાય છે.
પ્રશ્ન 2.
ઇલેક્ટ્રૉનના ધરીય અને કક્ષીય ગતિને કારણે સંક્રાંતિ તત્ત્વો ચુંબકીય ચાકમાત્રા ધરાવે છે. નીચેનામાંથી કયા ધાત્વીય આયનોની સ્પિન આધારિત ચુંબકીય ચાકમાત્રા લગભગ સમાન છે ?
(A) CO2+
(B) Cr2+
(C) Mn2+
(D) Cr3+
જવાબ
(A), (D)
જ્યાં n = અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યા
ઉપરની ઇલેક્ટ્રૉનીય રચનાઓ પ્રમાણે (A) CO2+ અને (D) Cr3+માં સમાન સંખ્યામાં 3d અયુગ્મિત ઇલેક્ટ્રૉન છે, જેથી આ બંનેની સ્પિન માત્ર ચુંબકીય ચાકમાત્રા સમાન થશે. જે મૂલ્ય µ = \(\sqrt{n(n+2)}\) માં n = 3 લેવાથી \(\sqrt{15}\) = 3.87 BM હશે.
પ્રશ્ન 3.
ડાયક્રોમેટના સ્વરૂપમાં Cr(VI) પ્રબળ ઑક્સિડેશનકર્તા છે પરંતુ MoO3માં Mo(VI) અને WO3માં W(VI) ઑક્સિડેશનકર્તા નથી, કારણ કે –
(A) Cr(VI) તે Mo(VI) અને W(VI) કરતાં વધુ સ્થાયી છે.
(B) Mo(VI) અને W(VI) બંને Cr(VI)ના કરતાં વધુ સ્થાયી છે.
(C) સમૂહ-6ના સંક્રાંતિ શ્રેણીના ભારે સભ્યોની ઉચ્ચ ઑક્સિડેશન અવસ્થા વધુ સ્થાયી છે.
(D) સમૂહ-6ના સંક્રાંતિ શ્રેણીના ભારે સભ્યોની નીચી ઑક્સિડેશન અવસ્થા વધુ સ્થાયી છે.
જવાબ
(B), (C)
- Cr(VI)નું નીચી Cr(III) વધુ સ્થાયીમાં રૂપાંતર થઈ શકે છે.
Cr 3d સંક્રાંતિ શ્રેણી, સમૂહ-6માં છે.
Mo 4d સંક્રાંતિ શ્રેણી, સમૂહ-6માં છે.
W 5d સંક્રાંતિ શ્રેણી, સમૂહ-6માં છે. - આ ત્રણેય એક જ સમૂહમાં છે, જેથી 3dના Cr(VI)ની ત્રિજ્યા લઘુતમ છે.
- Cr(VI)ની સ્થાયિતા Mo(VI) અને W(VI)ના કરતાં વધારે જોવા મળે છે, જેથી Cr(VI) પ્રબળ ઑક્સિડેશનકર્તા છે.
પ્રશ્ન 4.
નીચેનામાંથી કયા ઍક્ટિનોઇડ +7 સુધીની ઑક્સિડેશન અવસ્થા દર્શાવ છે ?
(A) Am
(B) Pu
(C) U
(D) Np
જવાબ
(B), (D)
- Pu તથા Np +3, +4, +5, +6 અને +7 ઑક્સિડેશન અવસ્થાઓ દર્શાવે છે. તેઓ ક્રમશઃ 3થી 7 ઇલેક્ટ્રૉન ગુમાવી શકે છે.
- પણ બાકીના બન્ને Am અને U મહત્તમ +6 સુધીની +3, +4, +5, +6 અવસ્થાઓ જ દર્શાવે છે.
પ્રશ્ન 5.
ઍક્ટિનોઇડનું સામાન્ય ઇલેક્ટ્રૉનીય સંરચના (n− 2)f1 – 14 (n – 1)d0 – 2 ns2 છે. નીચેનામાંથી કયા ઍક્ટિનોઇડ 6d કક્ષકમાં એક ઇલેક્ટ્રૉન ધરાવે છે.
(A) U (પરમાણ્વીયક્રમાંક 92)
(B) Np (પરમાણ્વીયક્રમાંક 93)
(C) Pu (પરમાણ્વીયક્રમાંક 94)
(D) Am (૫૨માણ્વીયક્રમાંક 95)
જવાબ
(A), (B)
- Pu તથા Np +3, +4, +5, +6 અને +7 ઑક્સિડેશન અવસ્થાઓ દર્શાવે છે. તેઓ ક્રમશઃ 3થી 7 ઇલેક્ટ્રૉન ગુમાવી શકે છે.
- પણ બાકીના બન્ને Am અને U મહત્તમ +6 સુધીની +3, +4, +5, +6 અવસ્થાઓ જ દર્શાવે છે.
![]()
પ્રશ્ન 6.
લેન્થેનોઇડની લાક્ષણિક ઑક્સિડેશન અવસ્થા +3 હોવા છતાં નીચેનામાંથી કયું લેન્થેનોઇડ તત્ત્વ +2 ઓક્સિડેશન અવસ્થા દર્શાવે છે ?
(A) Ce
(B) Eu
(C) Yb
(D) Ho
જવાબ
(B), (C)
- Eu (Z = 63) [Xe]54 4f7 6s2 છે
અને Eu2+ [Xe]54 4f7 6s0 છે
Eu2+માં અર્ધ-પૂર્ણ 4f પેટાકોશની 4f7 વિશેષ સ્થાયી રચના છે, જેથી Eu2+ બને છે - Yb (Z = 70) [Xe]54 4f14 6s2 છે
અને Yb2+ [He]54 4f14 6s0 છે - Yb2+માં પેટાકોશ 4f સંપૂર્ણ ભરાયેલ વિશેષ સ્થાયી 4f14 રચના છે, જે કારણથી Yb2+ ઑક્સિડેશન અવસ્થા
- દર્શાવે છે. Ce અને Hoમાં આવી +2 સ્થાયી રચના બનતી નથી, જેથી તેમના +2 આયનો બનતા નથી.
પ્રશ્ન 7.
નીચેનામાંથી કયા આયનની માત્ર સ્પિન ચુંબકીય ચાકમાત્રા વધુ છે ?
(A) Ti3+
(B) Mn2+
(C) Fe2+
(D) Co3+
જવાબ
(B), (C)
જ્યાં n = અયુગ્મિત d ઇલેક્ટ્રૉનની સંખ્યા
µ = \(\sqrt{n(n+2)}\) BM = સ્પિન માત્ર ચુંબકીય ચાકમાત્રા Mn2+ (5.92BM) અને Fe2+(4.90 BM)જેટલી ઊંચી સ્પિન માત્ર ચુંબકીય ચાકમાત્રા ધરાવશે.
પ્રશ્ન 8.
સંક્રાંતિ તત્ત્વો હેલોજન સાથે દ્વિઅંગી સંયોજન બનાવે છે. નીચેનામાંથી કયું તત્ત્વ MF3 પ્રકારનું સંયોજન બનાવે છે ?
(A) Cr
(B) Co
(C) Cu
(D) Ni
જવાબ
(A), (B)

પ્રશ્ન 9.
નીચેનામાંથી કયું સંયોજન ઑક્સિડેશનકર્તા તરીકે વર્તતું નથી ?
(A) CrO3
(B) MoO3
(C) WO3
(D) CrO2-4
જવાબ
(B), (C)
આ ચારેયમાં ધાતુ (+6) ઑક્સિડેશન અવસ્થામાં છે. +6 ઑક્સિડેશન અવસ્થા ઊંચી અવસ્થા છે, તેમ છતાં MoO3 અને WO3 ઑક્સિડેશનકર્તા તરીકે વર્તતા નથી. કારણ કે Mo અને Wની ઊંચી ઑક્સિડેશન અવસ્થા +6 ઘણી ઊંચી સ્થાયિતા ધરાવતી હોવાથી નીચી અસ્થાયી અવસ્થામાં ફેરવાઈ શકતી નથી.
પ્રશ્ન 10.
લેન્થેનોઇડની લાક્ષણિક ઑક્સિડેશન અવસ્થા +3 છે. પરંતુ સિરિયમ +4 ઑક્સિડેશન અવસ્થા દર્શાવે છે. કારણ કે…………….
(A) તે એક કરતાં વધુ આયનીકરણ ઍન્થાલ્પી ધરાવે છે.
(B) તે નિષ્ક્રિય વાયુ જેવી સંરચના પ્રાપ્ત કરવાની વૃત્તિ ધરાવે છે.
(C) તે f0 સંરચના પ્રાપ્ત કરવાની વૃત્તિ ધરાવે છે.
(D) તે Pb4+ સાથે સમાનતા ધરાવે છે.
જવાબ
(B), (C)
- Ce (Z = 58) : [Xe]54 4f2 5d0 6s2 ઇલેક્ટ્રૉનીય રચના ધરાવે છે. તેમાંથી 4 ઇલેક્ટ્રૉન દૂર થતાં બનતો Ce4+ [Xe]54 4f0 5d0 6s0 રચનાનો બને છે.
- Ce4+માં સંપૂર્ણ ખાલી 4f0ની વિશેષ સ્થાયી, ઉમદા વાયુની [Xe]54ની સ્થાયી રચના છે. આમ (B) અને (C) સાચાં છે.
![]()
ટૂંક જવાબી પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
શા માટે કૉપર ઍસિડમાંથી હાઇડ્રોજનને મુક્ત કરતું નથી ?
ઉત્તર:
\(\mathrm{E}_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{\ominus}\) = +0.34 V છે જે \(\mathrm{E}_{\mathrm{H}^{+} / \mathrm{H}_2}^{\ominus}\) = 0.0 Vના કરતાં
વધારે છે. આથી Cu વડે H+નું H2માં ઑક્સિડેશન થતું નથી.
Cu + 2H+ → Cu2+ + H2 …………. પ્રક્રિયા નથી થતી.
પ્રશ્ન 2.
શા માટે Mn, Ni અને Zn નાં E⊖ મૂલ્યો અપેક્ષા કરતાં વધુ ઋણ છે ?
ઉત્તર:
- Mn2+(d5) અને Zn2+(d10)ની સ્થાયી રચના ધરાવતા હોવાથી Mn અને Znના પોર્ટેન્શિયલ વધારે ઋણ છે.
- Ni2+ની ઊંચી જલીયકરણ ઍન્થાલ્પી ઊંચી છે જેથી E⊖ વધુ ઋણ છે.
| \(\mathrm{E}_{\mathrm{Mn}^{2+} / \mathrm{Mn}}^{\ominus}\) | \(\mathrm{E}_{\mathrm{Zn}^{2+} / \mathrm{Zn}}\) | \(\mathrm{E}_{\mathrm{Ni}^{2+} / \mathrm{Ni}}^{\ominus}\) |
| -1.18 V | -0.76 V | -0.25 V |
પ્રશ્ન 3.
શા માટે Cr ની પ્રથમ આયનીકરણ એન્થાલ્પી Zn કરતાં વધુ છે ?
ઉત્તર:
- Cr [Ar] 3d5 4s1 રચનામાંથી 1 ઇલેક્ટ્રૉન દૂર થઈ અર્ધપૂર્ણ 3d પેટાકોશનો સ્થાયી Cr+ આયન બનતો હોવાથી Crની પ્રથમ આયનીકરણ ઍન્થાલ્પી ઓછી છે.
- Znની 3d10 4s2માંથી 1 ઇલેક્ટ્રૉન દૂર થતાં વિશેષ સ્થાયી રચના બનતી નથી જેથી Crની સાપેક્ષ Znની પ્રથમ આયનીકરણ ઍન્થાલ્પી વધારે છે.
પ્રશ્ન 4.
સંક્રાંતિ તત્ત્વો ઊંચાં ગલનબિંદુ દર્શાવે છે. શા માટે ?
ઉત્તર:
- સંક્રાંતિ તત્ત્વોમાં પરમાણુઓની વચ્ચે મુક્ત ગતિશીલ 30 અને 4s ઇલેક્ટ્રૉનની હાજરીના કારણે મજબૂત ધાત્વીય બંધ હોય છે.
- ઊંચા ગલનબિંદુનું કારણ આંતરપરમાણ્વીય ધાત્વીય બંધનમાં ns ઇલેક્ટ્રૉન ઉપરાંત (n – 1)d કક્ષકોના વધુ ઇલેક્ટ્રૉનની સહભાગિતા છે.
- આ તત્ત્વોની દરેક હરોળમાં d5 ઇલેક્ટ્રૉનીય રચના પર ધાતુઓનાં ગલનબિંદુ મહત્તમ હોય છે.
પ્રશ્ન 5.
જ્યારે Cu2+ આયનની પ્રક્રિયા KI સાથે કરતાં સફેદ અવક્ષેપ મળે છે. રાસાયણિક સમીકરણ દ્વારા આ પ્રક્રિયા સમજાવો.
ઉત્તર:

આ પ્રક્રિયાની નીપજ ક્યુપ્રસ આયોડાઇડ (Cu2I2)ના અવક્ષેપ સફેદ હોય છે. પ્રક્રિયામાં Cu2+નું Cu+માં I– વડે રિડક્શન થાય છે.
પ્રશ્ન 6.
Cu2Cl2 અને CuCl2માંથી કયું વધુ સ્થાયી છે ? શા માટે ?
ઉત્તર:
CuCl2 વધારે અને Cu2Cl2 ઓછો સ્થાયી છે.
CuCl2માં Cu2+ છે.
| ΔrH⊖ (આયનીકરણ ઍન્થાલ્પી) | Ꭼ⊖ |
| Cu+ 745 | |
| Cu2+ 1958 | 0.34 |
CuCl2માં ઊંચી લેટાઇસકરણ ઊર્જાના કારણે ઘન CuCl2 વધારે સ્થાયી છે.
જલીય દ્રાવણમાં ઊંચી જલીયકરણ ઉષ્મા Cu2+ની હોવાથી વધારે સ્થાયી છે.
Cu2+(aq) ની Cu+(aq) કરતાં વધુ સ્થાયિતાનું કારણ Cu+ કરતાં Cu2+નું ΔhydH0નું બહુ વધુ ઋણ મૂલ્ય છે, જે Cuની દ્વિતીય આયનીકરણ ઍન્થાલ્પીની ક્ષતિપૂર્તિ કરતાં વધારે હોય છે.
![]()
પ્રશ્ન 7.
જ્યારે મેંગેનીઝના કથ્થાઈ રંગના સંયોજન (A)ની પ્રક્રિયા HCl સાથે કરતાં તે વાયુ (B) આપે છે. વધુ પ્રમાણમાં આ વાયુની પ્રક્રિયા NH3 સાથે કરતાં તે વિસ્ફોટક સંયોજન (C) આપે છે. સંયોજનો A, B અને C ને ઓળખો.
ઉત્તર:
કથ્થાઈ રંગના સંયોજન (A) MnO2નું HCl સાથે પ્રક્રિયા કરવાથી વાયુ (B) Cl2 બને છે. આ વાયુ Cl2ની NH3 સાથે પ્રક્રિયા કરવાથી વિસ્ફોટક NCl3 (C) બને છે.
A = MnO2 (મેંગેનીઝ ડાયૉક્સાઇડ), કથ્થાઈ રંગનો
B = Cl2 (ક્લોરિન વાયુ)
C = NCl3 (નાઇટ્રોજન ટ્રાયક્લોરાઇડ, જે વિસ્ફોટક) છે.

પ્રશ્ન 8.
ઑક્સિજન કરતાં ફ્લોરિન વધુ વિદ્યુતઋણ છે. છતાં ઊંચી ઑક્સિડેશન અવસ્થાની સ્થિરતા ફ્લોરિન કરતાં ઑક્સિજન વધુ આપે છે. શા માટે ?
ઉત્તર:
ફ્લોરિન ધાતુ સાથે ગુણક બંધ રચી શકતો નથી પણ ઑક્સિજન ધાતુઓ સાથે π બંધ એટલે કે ગુણક બંધ બનાવી શકે છે. ઑક્સિજનની ગુણક બંધ બનાવવાની ક્ષમતા હોવાથી ઑક્સિજન સાથેની ઊંચી ઑક્સિડેશન અવસ્થાઓ સ્થાયિતા હોય છે.
પ્રશ્ન 9.
Cr3+ અને Co2+ આયનમાં અયુગ્મિત ઇલેક્ટ્રોનની સંખ્યા સમાન છે. પરંતુ Cr3+ની ચુંબકીય ચાકમાત્રા 3.87 BM છે જ્યારે Co2+ની 4.87 BM છે. શા માટે ?
ઉત્તર:

સ્પિન માત્રા ચુંબકીય ચાકમાત્રાનાં ગણેલ મૂલ્ય
μ = \(\sqrt{n(n+2)}=\sqrt{3(3+2)}=\sqrt{15}[latex] = 3.87 BM = 3.87 BM
- Cr3+માં સમિત ઇલેક્ટ્રૉનની અસરથી ફક્ત સ્પિન ગતિ અસરકારક હોવાથી ચુંબકીય ચાકમાત્રા 3.87 BM છે, સૈદ્ધાંતિક જેટલી છે.
- Co2+માં કક્ષકીય ગતિ પણ અસરકારક છે અને આ કક્ષકીય ગતિથી ચુંબકીય ક્ષેત્ર પૂરક બનવાથી Co2+ની ચુંબકીય ચાકમાત્રા વધીને 4.87 BM થાય છે.
પ્રશ્ન 10.
શા માટે Ce, Pr અને Ndની આયનીકરણ એન્થાલ્પી Th, Pa અને U કરતાં વધુ છે ?
ઉત્તર:
Ce, Pr અને Nd લેન્થેનોઇડ્સ છે, તેમની બાહ્યતમ 4fમાં અને 6s માં ઇલેક્ટ્રૉન છે. તેમના બાહ્યકોશના ઇલેક્ટ્રૉન કેન્દ્રથી વધારે નજીક હોવાથી મજબૂત રીતે બંધાયેલ હોય છે.
Th, Pa અને U ઍક્ટિનોઇડ્સ છે, તેમની બાહ્યતમ 5f, 6d અને 7s માં ઇલેક્ટ્રૉન હોય છે અને તેમની આયનીકરણ ઍન્થાલ્પીનાં શરૂઆતના લેન્થેનોઇડ્સ (Ce, Pr, Nd) ના કરતાં ઓછાં હોય છે, કારણ કે ઍક્ટિનોઇડ્સમાં 5f ભરાવાનું શરૂ થાય ત્યારે તે અંતર્ભાગમાં ઓછું ભેદન કરશે. તેથી 5f ઇલેક્ટ્રૉન કેન્દ્રીય વીજભાર પ્રત્યે અનુવર્તી લેન્થેનોઇડ્સના 4f ઇલેક્ટ્રૉનની સરખામણીમાં વધુ અસરકારક રીતે શિલ્ડિંગ અસ૨ પામેલા હોય છે. ઍક્ટિનોઇડ્સમાં બાહ્ય ઇલેક્ટ્રૉન ઓછી દૃઢતાથી બંધાયેલા બંધન માટે પ્રાપ્ય હોય છે.
પ્રશ્ન 11.
Zr એ 4d શ્રેણીમાં સમાવિષ્ટ છે જ્યારે Hf એ 51 શ્રેણીમાં સમાવિષ્ટ છે. તેમ છતાં બંનેને અલગ કરવા શા માટે મુશ્કેલ છે ?
ઉત્તર:
- Zr અને Hfની રાસાયણિક ક્રિયાશીલતામાં સામ્યતા છે.
- Zr = 160 pm અને HF = 159 pm જેટલી લગભગ સમાન પરમાણ્વીય ત્રિજ્યા, લેન્થેનોઇડ્સ સંકોચનના કારણે ધરાવે છે. આ રીતે Zr અને Hf ભિન્ન સંક્રાંતિ શ્રેણીનાં હોવા છતાં કુદરતમાં સાથે મળી આવે છે અને તેમના અલગીકરણમાં તકલીફ પડે છે.
પ્રશ્ન 12.
લેન્થેનોઇડની લાક્ષણિક ઑક્સિડેશન અવસ્થા +3 છે. તેમ છતાં સિરિયમ +4 ઑક્સિડેશન અવસ્થા દર્શાવે છે. શા માટે ?
ઉત્તર:
- Ce, Ce3+ અને Ce4+ ઇલેક્ટ્રૉનીય રચના નીચે પ્રમાણે છે.
Ce [Xe]54 5f1 5d1 6s2
Ce3+ [Xe]54 4f0 5d1 6s0
Ce4+ [Xe]54 4f05d0 6s0 - 3 ઇલેક્ટ્રૉન ગુમાવી Ce તેની સામાન્ય અવસ્થા +3 પ્રાપ્ત કરે છે, પણ Ce4+માં ઉમદાવાયુ જેવી લાક્ષણિક સ્થાયી રચના છે, જેથી Ce3+ વધુ એક ઇલેક્ટ્રૉન ગુમાવી, વધારે સ્થાયી Ce4+ બનાવે છે.
પ્રશ્ન 13.
KMnO4 ના દ્રાવણને ઍસિડિક માધ્યમમાં ઓક્ઝેલિક એસિડના દ્રાવણમાં ઉમેરતાં તેનો રંગ દૂર થાય છે શા માટે ? સમજાવો ?
ઉત્તર:
- ઑક્ઝેલિક ઍસિડને KMnO4ના ઍસિડિક દ્રાવણમાં ઉમેરવામાં આવે છે ત્યારે, ઑક્ઝેલિક ઍસિડ (H2C2O4)ના ઑક્સેલેટ આયન (C2O2-4) વડે KMnO4 ના પરમેંગેનેટ આયન (MnO-14) નું Mn2+ માં રિડક્શન થાય છે.

- આ રીતે રંગીન KMnO4 નું રંગવિહીન MnSO4માં પરિવર્તન થતું હોવાથી રંગ અદશ્ય થાય છે.
![]()
પ્રશ્ન 14.
જ્યારે Cr2O2-7 આયન ધરાવતું નારંગી રંગના દ્રાવણમાં આલ્કલી ઉમરેવામાં આવે ત્યારે દ્રાવણ પીળા રંગનું બને છે. આ પીળા દ્રાવણમાં H+ આયન ઉમેરતાં તે નારંગી રંગનું બને છે. સમજાવો, આમ શા માટે થાય છે ?
ઉત્તર:
નારંગી ડાયક્રોમેટમાં આલ્કલી (OH–) ઉમેરતાં પીળો ક્રોમેટ બને છે અને પીળા ક્રોમેટમાં ઍસિડ ઉમેરવાથી નારંગી ડાયક્રોમેટ બને છે.

પ્રશ્ન 15.
KMnO4 ના દ્રાવણનું રિડક્શન કરતાં કાં તો રંગહીન દ્રાવણ મળે છે કે કથ્થાઈ રંગનો અવક્ષેપ કે લીલા રંગનું દ્રાવણ મળે છે. જે દ્રાવણની pH ઉપર આધાર રાખે છે. તે રિડક્શન કયા જુદા-જુદા તબક્કા દર્શાવ છે અને તે કેવી રીતે કરવામાં આવે છે.
ઉત્તર:
- KMnO4 નું રિડક્શન દ્રાવણની pH પ્રમાણે બદલાય છે.
- બેઝિક દ્રાવણમાં KMnO4માંના પરમેંગેનેટમાંથી મૅગેનેટ (લીલો), K2MnO4 બને છે.

2KMnO4 + 2KOH → 2K2MnO4 + H2O + [O]- ઓછા ઍસિડિક દ્રાવણમાં KMnO4માંના MnO–4 નું MnO2માં રિડક્શન થાય છે, જે કથ્થાઈ રંગનો અવક્ષેપ તરીકે મળે છે.

- પૂરતા ઍસિડિક દ્રાવણ (pH << 7) માં MnO–4 નું રંગવિહીન Mn2+ માં રિડક્શન નીચે પ્રમાણે થાય છે.

પ્રશ્ન 16.
સંક્રાંતિ તત્ત્વોની બીજી અને ત્રીજી શ્રેણી એકબીજા સાથે ખૂબ જ સમાનતા ધરાવે છે. જે તેમની પ્રથમ શ્રેણી સાથેની સમાનતા કરતાં વધુ છે. શા માટે ? સમજાવો.
ઉત્તર:
કારણ કે લેન્થેનોઇડ સંકોચનના કારણે દ્વિતીય અને તૃતીય સંક્રાંતિ શ્રેણીનાં તત્ત્વોની પરમાણ્વીય ત્રિજ્યા લગભગ સમાન છે. લેન્થેનોઇડ સંકોચન ન થવાથી પ્રથમ સંક્રાંતિ શ્રેણી (3d)ના તત્ત્વોની સરખામણીમાં દ્વિતીય સંક્રાંતિ શ્રેણી (4d)ના તત્ત્વોનાં પરમાણ્વીય કદ મોટાં હોય છે, પરંતુ તૃતીય સંક્રાંતિ શ્રેણી (5d)ના તત્ત્વોના પરમાણ્વીય કદ લગભગ દ્વિતીય સંક્રાંતિ શ્રેણીના અનુવર્તી સભ્યોના પરમાણ્વીય કદ જેટલા જ હોય છે.
પ્રશ્ન 17.
સમજાવો Cu ના E⊖ નું મૂલ્ય +0.34V છે જ્યારે Zn નું E⊖ નું મૂલ્ય -0.76V છે.
ઉત્તર:
કોઈ પણ ધાતુના રિડક્શન પોર્ટેન્શિયલનું મૂલ્ય (1) પરમાણ્વીયકરણ ઍન્થાલ્પી, આયનીકરણ ઍન્થાલ્પી અને જલીયકરણ ઍન્થાલ્પીના સરવાળાની ઉપર છે (Cu → Cu2+(aq) ની ઊર્જા)> (Zn → Zn2+(aq) )ની ઊર્જા છે.
(a) Cuનો E⊖ ધન છે કારણ કે….
(i) Cr2+ રિડ્યુસિંગ (રિડક્શનકર્તા) છે.

વળી, E⊖ Cr3+/Cr2+ = -1.41 V જે ઋણ મૂલ્ય છે. જે સૂચવે છે કે સ્થિરતા Cr3+ > Cr2+ છે.
આ કારણથી Cr2+ માંથી ઑક્સિડેશન થઈ વધુ સ્થાયી Cr3+ બને છે, અને Cr2+ રિડ્યુસિંગ છે.
(ii) Mn2+ ઑક્સિડાઇઝિંગ (ઑક્સિડેશનકર્તા) છે.

વળી, E⊖ Mn3+/Mn2+ = +1.57 V જે ધન મૂલ્ય છે. જે સૂચવે છે કે સ્થિરતા Mn2+ > Mn3+ છે.
આ કારણોથી Mn3+નું Mn2+ માં રિડક્શન થાય, Mn3+ ઑક્સિડાઇઝિંગ હોય.
(b) જ્યારે Znની પરમાણ્વીયકરણ ઊર્જા ઓછી છે અને Zn2+(d10) સ્થાયી રચના પ્રાપ્ત કરે છે જેથી Znની આયનીકરણ ઍન્થાલ્પી ઓછી છે. પરિણામે Zn2+(aq) બનવાનો E⊖ ઋણ છે.
![]()
પ્રશ્ન 18.
શા માટે ધાતુ આયનની ઑક્સિડેશન અવસ્થા વધવાની સાથે સંક્રાંતિ તત્ત્વોના હેલાઇડ વધુ ને વધુ સહસંયોજક બને છે ?
ઉત્તર:
જેમ ઑક્સિડેશન અવસ્થા ઊંચી હોય તેમ આયનનું કદ ઓછું હોય છે. જાનના નિયમ પ્રમાણે જેમ આયનનું કદ ઓછું તેમ તેની સાથેના બંધની સહસંયોજક બંધની લાક્ષણિકતા (પ્રમાણ) વધે છે. આથી ઊંચી ઑક્સિડેશન સ્થિતિના હેલાઇડ વધારે સહસંયોજક હોય છે.
પ્રશ્ન 19.
પરમાણ્વીય કક્ષકમાં ઇલેક્ટ્રોન ગોઠવાય ત્યારે પ્રથમ 4s કક્ષકમાં અને ત્યારબાદ 3dમાં ગોઠવાય છે પરંતુ પરમાણુના આયનીકરણ દરમિયાન આનાથી વિપરિત થાય છે. શા માટે ?
ઉત્તર:
- કક્ષકોમાં ઇલેક્ટ્રૉન ભરાવાના નિયમ (n + l) અનુસાર પ્રથમ 4s અને પછી 3d કક્ષકો ભરાય છે.
4s માટે (n + l) = (4 + 0) = 4
અને 3d માટે (n + l) = (3 + 2) = 5
જેથી 4s પ્રથમ ભરાય છે. - 4s અને 3d માં ઇલેક્ટ્રૉન ભરાય પછી તરત જ 4s બાહ્યતમ અને 3d અંદરની કક્ષક થવાના કારણે હંમેશાં 4sના બાહ્યતમ ઇલેક્ટ્રૉન પ્રથમ દૂર થાય છે અને ત્યારબાદ 3d માંના ઇલેક્ટ્રૉન દૂર થાય છે.
પ્રશ્ન 20.
સમજાવો : Sc થી Cu તરફ જતાં સંક્રાંતિ તત્ત્વોની પ્રતિક્રિયાત્મકતા (reactivity) ક્રમશઃ ઘટે છે.
ઉત્તર:
Scથી Cu સુધી સંક્રાંતિ તત્ત્વોની પ્રતિક્રિયાત્મકતા નિયમિતપણે ઘટે છે, કારણ કે Scથી Cu તરફ આયનીકરણ ઍન્થાલ્પીમાં નિયમિત વધારો થાય છે. કોઈ પણ સંક્રાંતિતત્ત્વો પ્રતિક્રિયાત્મકતા મુખ્યત્વે આયનીકરણ ઍન્થાલ્પી ઉપર આધાર રાખે છે અને જેની આયનીકરણ ઍન્થાલ્પી ઓછી તેમ તેની પ્રતિક્રિયાત્મકતા વધારે હોય છે.
જોડકાં પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
કોલમ – I અને કોલમ – IIની વસ્તુઓને નીચે આપેલા પ્રશ્નોમાં જોડો.
| કોલમ – I (ઉદ્દીપક) | કોલમ – II (પ્રક્રમ) |
| (A) હાઇડ્રોજનની હાજરીમાં Ni | (1) ઝિગ્લર-નાટા ઉદ્દીપક |
| (B) Cu2Cl2 | (2) સંપર્કવિધિ |
| (C) V2O5 | (3) વનસ્પતિ તેલનું ઘીમાં રૂપાંતર |
| (D) આયર્નનો બારીક ભૂકો | (4) સેન્ડમેયર પ્રક્રિયા |
| (E) TiCl4 + Al(CH3)3 | (5) હેબર વિધિ |
| (6) KClO3 નું વિઘટન |
ઉત્તર:
(A – 3), (B – 4), (C – 2), (D – 5), (E – 1)
| કોલમ – I (ઉદ્દીપક) | કોલમ – II (પ્રક્રમ) |
| (A) હાઇડ્રોજનની હાજરીમાં Ni | (3) વનસ્પતિ તેલનું ઘીમાં રૂપાંતર |
| (B) Cu2Cl2 | (4) સેન્ડમેયર પ્રક્રિયા |
| (C) V2O5 | (2) સંપર્કવિધિ |
| (D) આયર્નનો બારીક ભૂકો | (5) હેબર વિધિ |
| (E) TiCl4 + Al(CH3)3 | (1) ઝિગ્લર-નાટા ઉદ્દીપક |

(E) ઉદ્દીપક : [TiCl4 + Al(CH3)3] તે ઝિગ્લર-નાટા ઉદ્દીપક છે.
પ્રશ્ન 2.
કોલમ – I માં આપેલાં સંયોજન | તત્ત્વને કૉલમ – II માં આપેલા તેના ઉપયોગ સાથે જોડો.
| કૉલમ – I (સંયોજન / તત્ત્વ) | કોલમ – II (ઉપયોગ) |
| (A) લેન્થેનોઇડના ઑક્સાઇડ | (1) આયર્નની મિશ્રધાતુનું ઉત્પાદન |
| (B) લેન્થેનોઇડ | (2) ટેલિવિઝનનો સ્ક્રીન |
| (C) મિશધાતુ | (3) પેટ્રોલિયમના નવીનીકરણમાં |
| (D) મેગ્નેશિયમ ધરાવતી મિશ્રધાતુ…..નો ઘટક છે. | (4) લેન્થેનોઇડ ધાતુ + આયર્ન |
| (E) લેન્થેનોઇડ્ઝા મિશ્ર ઑક્સાઇડનો ઉપયોગ | (5) બંદૂકની ગોળી |
| (6) X-ray Screen માં |
ઉત્તર:
(A – 2), (B – 1), (C – 4), (D – 5), (E – 3)
| કૉલમ – I (સંયોજન / તત્ત્વ) | કોલમ – II (ઉપયોગ) |
| (A) લેન્થેનોઇડના ઑક્સાઇડ | (2) ટેલિવિઝનનો સ્ક્રીન |
| (B) લેન્થેનોઇડ | (1) આયર્નની મિશ્રધાતુનું ઉત્પાદન |
| (C) મિશધાતુ | (4) લેન્થેનોઇડ ધાતુ + આયર્ન |
| (D) મેગ્નેશિયમ ધરાવતી મિશ્રધાતુ…..નો ઘટક છે. | (5) બંદૂકની ગોળી |
| (E) લેન્થેનોઇડ્ઝા મિશ્ર ઑક્સાઇડનો ઉપયોગ | (3) પેટ્રોલિયમના નવીનીકરણમાં |
(A) લેન્થેનોઇડના ઑક્સાઇડ → ટેલિવિઝનનો સ્ક્રીન
(B) લેન્થેનોઇડ → આયર્નની મિશ્રધાતુનું ઉત્પાદન
(C) મિશધાતુ → લેન્થેનોઇડ ધાતુ + આયર્ન
(D) મૅગ્નેશિયમ ધરાવતી મિશ્રધાતુ ………નો ઘટક છે. → બંદૂકની ગોળી
(E) લેન્થેનોઇડ્ઝા મિશ્ર ઑક્સાઇડનો ઉપયોગ → પેટ્રોલિયમના નવીનીકરણમાં
પ્રશ્ન 3.
કૉલમ – I માં આપેલાં ગુણધર્મોને કૉલમ – II માં આપેલ ધાતુ સાથે જોડો.
| કોલમ – I (ગુણધર્મ) | કૉલમ – II (ધાતુ) |
| (A) +8 ઑક્સિડેશન અવસ્થા ધરાવતું તત્ત્વ | (i) Mn |
| (B) +7 ઓક્સિડેશન અવસ્થા ધરાવતું 3d વિભાગનું તત્ત્વ | (ii) Cr |
| (C) 3d વિભાગનું સૌથી વધુ ગલનબિંદુ ધરાવતું તત્ત્વ | (iii) Os |
| (iv) Fe |
ઉત્તર:
(A – iii), (B – i), (C – ii)
| કોલમ – I (ગુણધર્મ) | કૉલમ – II (ધાતુ) |
| (A) +8 ઑક્સિડેશન અવસ્થા ધરાવતું તત્ત્વ | (iii) Os |
| (B) +7 ઓક્સિડેશન અવસ્થા ધરાવતું 3d વિભાગનું તત્ત્વ | (i) Mn |
| (C) 3d વિભાગનું સૌથી વધુ ગલનબિંદુ ધરાવતું તત્ત્વ | (ii) Cr |
(A) ઓસ્મોનિયમ (Os) તત્ત્વ +8 ઑક્સિડેશન સ્થિતિ દર્શાવે છે.
ઉદા., OsO4માં
(B) 3d વિભાગનું મેંગેનીઝ તત્ત્વ +7 સુધી ઑક્સિડેશન અવસ્થા દર્શાવે છે. ઉદા., Mn2O7માં
(C) 3d વિભાગમાંના ક્રોમિયમ તત્ત્વનું ગલનબિંદુ મહત્તમ.
![]()
પ્રશ્ન 4.
કોલમ – I માં આપેલાં વિધાનને કૉલમ – II માં આપેલ ઑક્સિડેશન અવસ્થા સાથે જોડો :
| કૉલમ – I | કોલમ – II |
| (A) MnO2માં Mnની ઑક્સિડેશન અવસ્થા | (i) +2 |
| (B) Mn ની સૌથી સ્થાયી ઑક્સિડેશન અવસ્થા | (ii) +3 |
| (C) ઑક્સાઇડમાં Mn ની સૌથી સ્થાયી ઑક્સિડેશન અવસ્થા | (iii) +4 |
| (iv) +5 | |
| (v) +7 |
ઉત્તર:
(A – iii), (B – i), (C – v), (D – ii)
| કૉલમ – I | કોલમ – II |
| (A) MnO2માં Mnની ઑક્સિડેશન અવસ્થા | (iii) +4 |
| (B) Mn ની સૌથી સ્થાયી ઑક્સિડેશન અવસ્થા | (i) +2 |
| (C) ઑક્સાઇડમાં Mn ની સૌથી સ્થાયી ઑક્સિડેશન અવસ્થા | (v) +7 |
| (D) લેન્થેનોઇડ તત્ત્વોની લાક્ષણિક ઑક્સિડેશન અવસ્થા | (ii) +3 |
(A) MnO2માં Mnની ઑક્સિડેશન અવસ્થા +4 છે.
(B) Mnની મહત્તમ સ્થાયી ઑક્સિડેશન અવસ્થા (Mn2+) છે.
(C) ઑક્સાઇડોમાં Mnની મહત્તમ સ્થાયી ઑક્સિડેશન અવસ્થા +7 છે. .
(D) લેન્થેનોઇડ્સની લાક્ષણિક ઑક્સિડેશન અવસ્થા +3 છે.
પ્રશ્ન 5.
કૉલમ – I માં આપેલાં દ્રાવણોને કૉલમ – II માં આપેલા રંગની સાથે મેળવો :
| કોલમ – I (ક્ષારનું જલીય દ્રાવણ) | કૉલમ – II (રંગ) |
| (A) FeSO4 · 7H2O | (1) લીલો |
| (B) NiCl2 · 4H2O | (2) આછો ગુલાબી |
| (C) MnCl2 · 4H2O | (3) વાદળી |
| (D) CoCl2 × 6H2O | (4) આછો લીલો |
| (E) Cu2Cl2 | (5) ગુલાબી |
| (6) રંગવિહીન |
ઉત્તર:
(A – 4), (B – 1), (C – 2), (D – 5), (E – 6)
| કોલમ – I (ક્ષારનું જલીય દ્રાવણ) | કૉલમ – II (રંગ) |
| (A) FeSO4 · 7H2O | (4) આછો લીલો |
| (B) NiCl2 · 4H2O | (1) લીલો |
| (C) MnCl2 · 4H2O | (2) આછો ગુલાબી |
| (D) CoCl2 × 6H2O | (5) ગુલાબી |
| (E) Cu2Cl2 | (6) રંગવિહીન |
પ્રશ્ન 6.
કોલમ – I ના ગુણધર્મોને કોલમ – II માં આપેલ તત્ત્વો સાથે જોડો.
| કૉલમ – I (ગુણધર્મ) | કોલમ – II (તત્ત્વ) |
| (A) +4 ઑક્સિડેશન અવસ્થા દર્શાવતું લેન્થેનોઇડ તત્ત્વ | (i) Pm |
| (B) +2 ઑક્સિડેશન અવસ્થા દર્શાવતું લેન્થેનોઇડ તત્ત્વ | (ii) Ce |
| (C) રેડિયોસક્રિય લેન્થેનોઇડ | (iii) Lu |
| (D) +3 ઑક્સિડેશન અવસ્થામાં 4f7 ઇલેક્ટ્રોનીય રચના દર્શાવતું લેન્થેનોઇડ તત્ત્વ | (iv) Eu |
| (E) +3 ઑક્સિડેશન અવસ્થામાં 4f14 ઇલેક્ટ્રૉનીય રચના ધરાવતું લેન્થેનોઇડ તત્ત્વ | (v) Gd |
| (vi) Dy |
ઉત્તર:
| કૉલમ – I (ગુણધર્મ) | કોલમ – II (તત્ત્વ) |
| (A) +4 ઑક્સિડેશન અવસ્થા દર્શાવતું લેન્થેનોઇડ તત્ત્વ | (ii) Ce |
| (B) +2 ઑક્સિડેશન અવસ્થા દર્શાવતું લેન્થેનોઇડ તત્ત્વ | (iv) Eu |
| (C) રેડિયોસક્રિય લેન્થેનોઇડ | (i) Pm |
| (D) +3 ઑક્સિડેશન અવસ્થામાં 4f7 ઇલેક્ટ્રોનીય રચના દર્શાવતું લેન્થેનોઇડ તત્ત્વ | (v) Gd |
| (E) +3 ઑક્સિડેશન અવસ્થામાં 4f14 ઇલેક્ટ્રૉનીય રચના ધરાવતું લેન્થેનોઇડ તત્ત્વ | (iii) Lu |

પ્રશ્ન 7.
કૉલમ – Iમાં આપેલા ગુણધર્મોને કોલમ – II માં આપેલ ધાતુ સાથે જોડો.
| કૉલમ – I (ગુણધર્મ) | કોલમ – II (ધાતુ) |
| (A) સૌથી વધુ દ્વિતીય આયનીકરણ એન્થાલ્પી ધરાવતું તત્ત્વ | (i) Co |
| (B) સૌથી વધુ ત્રીજી આયનીકરણ એન્થાલ્પી ધરાવતું તત્ત્વ | (ii) Cr |
| (C) M(CO)6માં M | (iii) Cu |
| (D) સૌથી વધુ પરમાણ્વીય ઉષ્મા | (iv) Zn |
| (v) Ni |
ઉત્તર:
(A – iii), (B – iv), (C – ii), (D – i)
| કૉલમ – I (ગુણધર્મ) | કોલમ – II (ધાતુ) |
| (A) સૌથી વધુ દ્વિતીય આયનીકરણ એન્થાલ્પી ધરાવતું તત્ત્વ | (iii) Cu |
| (B) સૌથી વધુ ત્રીજી આયનીકરણ એન્થાલ્પી ધરાવતું તત્ત્વ | (iv) Zn |
| (C) M(CO)6માં M | (ii) Cr |
| (D) સૌથી વધુ પરમાણ્વીય ઉષ્મા | (i) Co |
(A) Cuની દ્વિતીય આયનીકરણ ઍન્થાલ્પી મહત્તમ 1958 kJ mol– છે, કારણ કે Cu+ (3d10)ની સ્થાયી રચનામાં ઇલેક્ટ્રૉન દૂર કરવો ઘણો મુશ્કેલ છે.
(B) Znની તૃતીય આયનીકરણ ઍન્થાલ્પીમાં Zn2+ (3d10)માંથી ઇલેક્ટ્રૉન દૂર કરવાની આયનીકરણ ઍન્થાલ્પી મહત્તમ છે.
(C) Cr(CO)6 તે સ્થાયી કાર્બોનિલ સંયોજન છે.
(D) નિકલની મહત્તમ પરમાણ્વીયકરણ ઊર્જા છે.
![]()
વિધાન અને કારણ પ્રકારના પ્રશ્નો
નીચેના પ્રશ્નોમાં વિધાન (A) અને ત્યાર પછી કારણ (R) આપેલું છે. પ્રશ્નોની નીચે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરો ઃ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે અને કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
(C) વિધાન (A) સાચું નથી પણ કારણ (R) સાચું છે.
(D) વિધાન (A) અને કારણ (R) બંને સાચાં છે.
પ્રશ્ન 1.
વિધાન (A): Cu2+ નો આયોડાઇડ જાણીતો નથી.
કારણ (R) : Cu2+ એ I–નું ઑક્સિડેશન આયોડિનમાં કરે છે.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
Cu2I2 અસ્થાયી હોવાથી વિઘટન પામતો હોવાથી જાણીતા નથી.
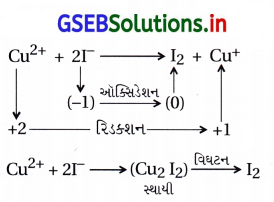
અહીં, Cu2+ ઑક્સિડેશનકર્તા છે.
પ્રશ્ન 2.
વિધાન (A) : Zr અને Hfનું અલગીકરણ મુશ્કેલ છે.
કારણ (R) : કારણ કે Zr અને Hf બંને આવર્ત-કોષ્ટકમાં એક જ સમૂહમાં આવેલા છે.
જવાબ
(B) વિધાન (A) અને કારણ (B) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
Zn અને Hfનું અલગીકરણ મુશ્કેલ છે કારણ કે આ બન્ને લેન્થેનોઇડ સંકોચનના કારણે સમાન ત્રિજ્યા ધરાવતા અને સમાન પ્રતિક્રિયાત્મકતા ધરાવતા હોય છે.
પ્રશ્ન 3.
વિધાન (A) : લેન્થેનોઇડની સરખામણીમાં ઍક્ટિનોઇડ ઓછા સ્થાયી સંકીર્ણ બનાવે છે.
કારણ (R) : ઍક્ટિનોઇડ બંધન માટે 6d કક્ષકની સાથે 4f કક્ષકનો ઉપયોગ કરે છે. પરંતુ લેન્થેનોઇડ 4f કક્ષકનો બંધન માટે ઉપયોગ કરતા નથી.
જવાબ
(C) વિધાન (A) સાચું નથી પણ કારણ (R) સાચું છે.
ઍક્ટિનોઇડ વધુ સ્થાયી સંકીર્ણો રચે છે કારણ કે તેઓ 5f તથા 6d કક્ષકોનો બંધનમાં ઉપયોગ કરે છે. લેન્થેનોઇડ 4fનો બંધનમાં ઉપયોગ નથી કરતા.
પ્રશ્ન 4.
વિધાન (A) : Cu ઍસિડમાંથી હાઇડ્રોજન મુક્ત કરી શકતું નથી.
કારણ (R) : તેનો વિધુતધ્રુવ પોટેન્શિયલ ધન છે.
જવાબ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
પ્રશ્ન 5.
વિધાન (A) : ઓસ્મિયમની સૌથી ઊંચી ઑક્સિડેશન અવસ્થા +3 છે.
કારણ (R) : ઓસ્મિયમ 5d-વિભાગનું તત્ત્વ છે.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
સવિસ્તર પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
A થી E ને ઓળખી અને તેમાં સામેલ પ્રક્રિયાઓ સમજાવો.
ઉત્તર:
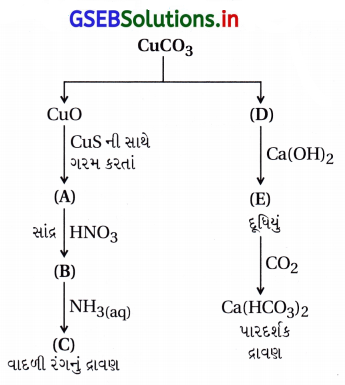
A = Cu, B = Cu(NO3)2, C = Cu(NH3)2+4,
D = CO2, E = CaCO3, F = Cu2[Fe(CN)6],
G = Ca(HCO3)2
આ ફેરફારોમાં નીચેની પ્રક્રિયાઓ થાય છે.

ડાબી તરફની પ્રક્રિયાઓ :

જમણી તરફની પ્રક્રિયાઓ :

![]()
પ્રશ્ન 2.
ક્રોમાઇટની કાચી ધાતુ (A)ને સોડિયમ કાર્બોનેટ સાથે વધુ પ્રમાણમાં હવા સાથે પીગળતા મળતી નીપજ પાણીમાં દ્રાવ્ય થાય છે, પીળા રંગનું સંયોજન (B)નું દ્રાવણ મળે છે. આ પીળા રંગના દ્રાવણની સલ્ફ્યુરિક એસિડ સાથે પ્રક્રિયા કરતા દ્રાવણમાંથી સંયોજન (C)ને સ્ફટિકીકરણ દ્વારા મેળવી શકાય છે. જ્યારે સંયોજન (C)ની પ્રક્રિયા KCI સાથે કરતા સંયોજન (D)ના કેસરી (orange) રંગના અવક્ષેપ સ્ફટિકીકરણ પામે છે. A થી D સુધીના પદાર્થોને ઓળખો અને પ્રક્રિયાઓ લખો.
ઉત્તર:
A = ક્રોમાઇટ ખનિજ, FeCr2O4
B = સોડિયમ ક્રોમેટ (Na2CrO4) …પીળો
C = સોડિયમ ડાયક્રોમેટ (Na2Cr2O7) · 2H2O…નારંગી
D = પોટૅશિયમ ડાયક્રોમેટ (K2Cr2O7) …નારંગી
આપેલી વિગતો ક્રોમાઇટ ખનિજમાંથી પોટૅશિયમ ડાયક્રોમેટ બનાવવાની ઔદ્યોગિક રીત છે. આ પ્રક્રમમાં નીચે પ્રમાણેની પ્રક્રિયાઓ થાય છે.

પ્રશ્ન 3.
જ્યારે મેંગેનીઝના ઑક્સાઇડ (A)ને KOHની સાથે ઑક્સિડેશનકર્તાની હાજરીમાં પીગાળતાં પાણીમાં દ્રાવ્ય થાય છે અને સંયોજન (B)નું ઘેરા લીલા રંગનું દ્રાવણ આપે છે. સંયોજન (B)નું તટસ્થ અથવા ઍસિડિક દ્રાવણમાં વિષમીકરણ (disproportionates) થવાથી જાંબલી સંયોજન (C) મળે છે. સંયોજન (C)નું આલ્કલાઇન દ્રાવણ પોટેશિયમ આયોડાઇડના દ્રાવણનું ઑક્સિડેશન થવાથી સંયોજન (D) અને સંયોજન (A) પણ બને છે. સંયોજન (A) થી (D) ને ઓળખો અને પ્રક્રિયામાં સામેલ સમીકરણો લખો.
ઉત્તર:
(A) = મેંગેનીઝ ડાયૉક્સાઇડ (MnO2)
(B) = પોટૅશિયમ મેંગેનેટ, (K2MnO4) …લીલો
(C) = પોટૅશિયમ પરમેંગેનેટ, (KMnO4) …જાંબલી
(D) = પોટૅશિયમ આયોડેટ (KIO3)
આ પ્રક્રમમાં નીચેની પ્રક્રિયાઓ થાય છે.

પ્રશ્ન 4.
લેન્થેનોઇડ સંકોચનને આધારે નીચેની બાબતો સમજાવો.
(i) La2O3 અને Lu2O3માં બંધનનો સ્વભાવ
(ii) લેન્થેનોઇડના ઑક્સોક્ષારમાં સ્થિરતાનો ક્રમ La થી Lu સુધી
(iii) લેન્થેનોઇડના સંકીર્ણોની સ્થિરતા
(iv) 4d અને 5d વિભાગનાં તત્ત્વોની ત્રિજ્યા
(v) લેન્થેનોઇડ ઑક્સાઇડની ઍસિડિક લાક્ષણિકતાનું વલણ
ઉત્તર:
(i) લેન્થેનોઇડ સંકોચનના કારણે Laથી Lu તરફ પરમાણ્વીય કદ ઘટે છે, જેમ પરમાણ્વીય કદ ઓછું તેમ સહસંયોજક ગુણ વધારે હોય છે, આ અનુસાર La2O3 → Lu2O3 તરફ આયનીય ગુણ ઘટતો અને સહસંયોજક ગુણ વધતો જાય છે. (આવી ઘટના દરેક આવર્તમાં ડાબીથી જમણી તરફ હોય છે જેમ કે Na2O3થી Cl2Oમાં)
(ii) લેન્થેનોઇડ્સમાં ઑક્સોક્ષારોની સ્થાયિતા Laથી Lu તરફ ઘટતી જાય છે, કારણ કે પરમાણ્વીય કદ ઘટતાં જાય છે.
(iii) Laથી Lu સુધી તેમના સંકીર્ણોની સ્થાયિતા વધે છે, કારણ કે આ તત્ત્વોના પરમાણ્વીય કદો ઘટતાં જાય છે.
(iv) 4d અને 5đવિભાગના ઊભાં સમૂહમાં પરમાણ્વીય ત્રિજ્યા લગભગ સમાન રહે છે.
(v) Laથી Luના ઑક્સાઇડનો ઍસિડિક ગુણ ક્રમશઃ વધે છે.
પ્રશ્ન 5.
(a) નીચેના પ્રશ્નોના ઉત્તર આપો :
(i) પ્રથમ સંક્રાંતિ શ્રેણીમાં કયા તત્ત્વની દ્વિતીય આયનીકરણ ઍન્થાલ્પી સૌથી વધુ છે ?
(ii) પ્રથમ સંક્રાંતિ શ્રેણીમાં કયા તત્ત્વની ત્રીજી આયનીકરણ ઍન્થાલ્પી સૌથી વધુ છે ?
(iii) પ્રથમ સંક્રાંતિ શ્રેણીના કયા તત્ત્વની પરમાણ્વીય (atomisation) એન્થાલ્પી સૌથી ઓછી છે ?
(b) ધાતુને ઓળખો અને તમારા ઉત્તરને સમજાવો.
(i) M(CO)5 કાર્બોનિલ (ii) MO3F
ઉત્તર:
(i) કૉપર (Cu) : Cuની ઇલેક્ટ્રૉનીય રચના 3d10 4s1 અને Cu+ની વિશેષ સ્થાયી 3d10 રચના છે. જેથી Cu+માં Cu2+ની રચનાની દ્વિતીય આયનીકરણ ઍન્થાલ્પી મહત્તમ છે.
(ii) ઝિંક (Zn) : Zn અને Zn2+ની ઇલેક્ટ્રૉનીય રચના અનુક્રમે 3d10 4s2 અને 3d10 4s0 છે.
Zn2+માંથી Zn3+ બનવા માટે વિશેષ સ્થાયી 3d10 માંથી ઇલેક્ટ્રૉન દૂર કરવા ઘણી વધારે ઊર્જાની જરૂરિયાત હોવાથી Zn2+ની તૃતીય આયનીકરણ ઍન્થાલ્પી મહત્તમ છે.
(iii) ઝિંક (Zn) : Znની ઇલેક્ટ્રૉનીય રચના [Ar] 3d10 4s2 છે તેમાં બાહ્ય કોષમાં અયુગ્મ ઇલેક્ટ્રૉન નથી, જેથી ઝિંકમાં
નિર્બળ ધાત્વીય બંધ છે અને ઝિંકની પરમાણ્વીયકરણ ઊર્જા લઘુતમ છે.
(b)
(i) M(CO)5 તે ધાતુ કાર્બોનિલ (Fe(CO)5 છે. : તેમાં Fe (Z = 26)ના 26 ઇલેક્ટ્રૉન તથા પાંચ CO લિગાન્ડના (5 × 2) = 10 ઇલેક્ટ્રૉન મળીને (26 + 10) = 36 ઇલેક્ટ્રૉનથી અસરકારક પરમાણ્વીય ક્રમાંક (36). જે સ્થાયી ઉમદાવાયુ (Kr)નો છે. આથી Fe(CO)5 તે સ્થાયી ધાતુ કાર્બોનિલ બનતો હોવાથી M = Fe પસંદ કરવો પડે.
(ii) MO3Fમાં M = Mn લેવાથી MnO3F તેવું ઑક્સો-ફ્લોરાઇડ થાય. આ MnO3Fમાં Mn7+ અવસ્થા હોય જે માટે જ શક્ય છે. આ કારણ અહીં M = Mn હોય.
પ્રશ્ન 6.
સંક્રાંતિ તત્ત્વોની સ્ફટિક રચનામાં નાના પરમાણુઓ જેવા કે H, C અને N ગોઠવાય છે ત્યારે બનતા સંયોજનનો પ્રકાર જણાવો તથા આ સંયોજનોની ભૌતિક અને રાસાયણિક લાક્ષણિકતા જણાવો.
ઉત્તર:
- H, C, N જેવા નાના પરમાણુ સંક્રાંતિતત્ત્વના લેટાઇસમાં ગોઠવાતાં નીપજતાં સંયોજનોને આંતરાલીય સંયોજનો કહે છે.
- આંતરાલીય સંયોજનોની મુખ્ય ભૌતિક અને રાસાયણિક લાક્ષણિકતાઓ :
- જ્યારે સંક્રાંતિ ધાતુઓના સ્ફટિક લેટિસમાં અંદરના ભાગમાં નાના પરમાણુઓ જેવા કે H, C કે N ગોઠવાય છે, ત્યારે બનતાં સંયોજનોને આંતરાલીય સંયોજનો કહે છે. ઉદા., TiC, Mn4N, Fe3H, VH0.56, TiH1.7 વગેરે.
- સામાન્ય રીતે આંતરાલીય સંયોજનો બિનતત્ત્વયોગમિતિય હોય છે અને તેઓ આયનીય કે સહસંયોજક હોતાં નથી. આંતરાલીય સંયોજનોનાં સૂત્રો ધાતુની સામાન્ય ઑક્સિડેશન અવસ્થા દર્શાવતા નથી. તેમના સંઘટનના સ્વભાવને કારણે આ સંયોજનોને આંતરાલીય સંયોજનો કહેવાય છે.
- આંતરાલીય સંયોજનોની ભૌતિક અને રાસાયણિક લાક્ષણિકતાઓ :
(i) તેમનાં ગલનબિંદુ ઊંચાં હોય છે, જે તેમની શુદ્ધ ધાતુનાં ગલનબિંદુના કરતાં પણ વધારે ઊંચાં હોય છે.
(ii) આંતરાલીય સંયોજનો વધુ સખત હોય છે. કેટલાક બોરાઇડ સંયોજનો કઠિનતામાં હીરા જેવા હોય છે.
(iii) આંતરાલીય સંયોજનો ધાત્વીય વાહકતા જાળવી રાખે છે.
(iv) આંતરાલીય સંયોજનો રાસાયણિક રીતે નિષ્ક્રિય હોય છે.
![]()
પ્રશ્ન 7.
(a) સંક્રાંતિ તત્ત્વોની તેમની ઑક્સિડેશન અવસ્થા બદલી શકે છે. તેથી તે ઉદ્દીપક તરીકે વર્તે છે. આયોડાઇડ અને પરસલ્ફેટ આયનો વચ્ચેની પ્રક્રિયાનું Fe(III) કેવી રીતે ઉદ્દીપન (catalyse) કરે છે.
(b) એવી ત્રણ પ્રક્રિયા વર્ણવો જેમાં સંક્રાંતિ ધાતુઓ ઉદ્દીપક તરીકે વર્તે છે.
ઉત્તર:
(a) આયોડાઇડ અને પરસલ્ફેટ વચ્ચેની પ્રક્રિયાનું Fe(III) વડે ઉદ્દીપન :

ΔEA = અવશોષિત ઊર્જા (λ)
ΔET = ઉત્સર્જિત ઊર્જા
ΔE = hv = hc / λ
v = [latex]A\) = દૃશ્યમાન તરંગ
રંગ ઉત્પન્ન થવાનું કારણ : જ્યારે નીચી ઊર્જાવાળી d કક્ષકમાંથી ઇલેક્ટ્રૉન ઊંચી ઊર્જાવાળી d-કક્ષકમાં ઉત્તેજિત થાય છે, ત્યારે ઉત્તેજિતની ઊર્જા અવશોષિત દશ્યમાન પ્રકાશની આવૃત્તિને અનુરૂપ હોય છે. સામાન્ય રીતે આ અવશોષિત આવૃત્તિ દશ્ય ક્ષેત્રમાં હોય છે.

(i) અવલોકિત રંગ અવશોષિત પ્રકાશના પૂરક રંગને અનુરૂપ હોય છે. (ii) અવશોષિત પ્રકાશની આવૃત્તિ લિગેન્ડના સ્વભાવ ઉપર આધાર રાખે છે. (iii) જલીય દ્રાવણોમાં પાણીના અણુઓ લિગેન્ડ તરીકે હોય છે. (iv) કેટલાક સંક્રાંતિ આયનો (જલીય દ્રાવણમાં) નીચેના કોષ્ટક પ્રમાણે રંગ ધરાવે છે.
નોંધ : (i) 3d0 અને 3d10 આયનો રંગીન નથી. (ii) અયુગ્મ 3d ઇલેક્ટ્રૉન હોય તેજ આયનો રંગીન છે. (iii) લિગેન્ડ બધામાં એકસમાન H2O છે. તેમ છતાં બધાના રંગ સમાન નથી. (iv) રંગ તે આયનમાંના ઇલેક્ટ્રૉનની સંખ્યા ઉપરાંત ધાતુ સાથે બદલાઈ શકે છે. (v) V3+(3d2) તથા Fe2+(3d6) અને Ni2+(3d8) ત્રણેય લગભગ લીલા રંગના છે. (vi) કોઈ પણ બે ભિન્ન આયનોના રંગો સંપૂર્ણ સમાન (સમાન v ના) હોતા નથી.

(b) (i) વેનેડિયમ(V) ઑક્સાઇડ (સંપર્ક પ્રક્રમમાં)
(ii) સૂક્ષ્મવિભાજિત આયર્ન (હેબર પ્રક્રમમાં)
(iii) નિકલ ઉદ્દીપકીય (હાઇડ્રોજનીકરણમાં)
પ્રશ્ન 8.
મેંગેનીઝના જાંબલી રંગના સંયોજન (A) ને ગરમ કરતાં તેનું વિઘટન થાય છે અને ઑક્સિજન મુક્ત થાય છે તથા મેંગેનીઝના સંયોજન B અને C બને છે. સંયોજન C ની પ્રક્રિયા KOH સાથે પોટેશિયમ નાઇટ્રેટની હાજરીમાં કરતા સંયોજન B મળે છે. સંયોજન (C)ને સાંદ્ર H2SO4 અને NaCl સાથે ગરમ કરતા ક્લોરિન વાયુ મુક્ત થાય છે તથા અન્ય નીપજો સાથે મેંગેનીઝનું સંયોજન (D) મળે છે. A થી D સુધીનાં સંયોજનોને ઓળખો અને તેમાં સંમિલિત પ્રક્રિયાઓ સમજાવો.
ઉત્તર:
(A) = પોટૅશિયમ પરમેંગેનેટ, (KMnO4)
(B) = પોટૅશિયમ મેંગેનેટ, (K2MnO4)
(C) = મેંગેનીઝ ડાયૉક્સાઇડ, (MnO2)
(D) = મેંગેનીઝ ક્લોરાઇડ (MnCl2)
આ પ્રક્રમમાં નીચેની પ્રક્રિયાઓ થાય છે.
