Gujarat Board GSEB Textbook Solutions Class 12 Chemistry Chapter 9 સવર્ગ સંયોજનો Textbook Questions and Answers.
Gujarat Board Textbook Solutions Class 12 Chemistry Chapter 9 સવર્ગ સંયોજનો
GSEB Class 12 Chemistry સવર્ગ સંયોજનો Text Book Questions and Answers
પ્રશ્ન 1.
વર્નરની અભિધારણાઓના પર્યાયમાં સવર્ગ સંયોજનોમાં બંધન સમજાવો.
ઉત્તર:
(i) વર્નરના સિદ્ધાંત પ્રમાણે ધાતુ આયન બે પ્રકારની સંયોજકતા ધરાવે છે : (a) પ્રાથમિક સંયોજકતા અને (b) દ્વિતીયક સંયોજકતા
(ii) પ્રાથમિક સંયોજકતા સામાન્ય રીતે આયનીકરણ પામે તેવી હોય છે અને ઋણઆયનો વડે સંતોષાય છે.
(iii) દ્વિતીયક સંયોજકતા બિનઆયનીકરણ હોય છે. આ તટસ્થ અણુઓ અથવા ઋણાયન વડે સંતોષાય છે. દ્વિતીયક સંયોજકતા સવર્ગ આંક જેટલી જ હોય છે અને તે ધાતુ માટે નિશ્ચિત હોય છે.
(iv) આયન/સમૂહ જે ધાતુ સાથે દ્વિતીયક બંધનથી જોડાયેલ છે તે તેમની જુદી જુદી સવર્ગ આંકને અનુરૂપ લાક્ષણિક અવકાશીય ગોઠવણી ધરાવે છે. આવી ગોઠવણીને સવર્ગ બહુતલીય (પૉલિહેડ્રા) કહે છે.
સંક્રાંતિ ધાતુઓના સવર્ગ સંયોજનોમાં અષ્ટલકીય, ચતુલકીય અને સમચોરસ ભૌમિતિક આકારો વધારે સામાન્ય છે. આમ, [Co(NH3)6]+3, [CoCl(NH3)5]+2 અને [CoCl2(NH3)4]+ અષ્ટફલકીય છે. જ્યારે [Ni(CO)4] અને [PtCl4]-2 અનુક્રમે સમચતુષ્કલકીય અને સમચોરસ છે.
પ્રશ્ન 2.
FeSO4 ના દ્રાવણને (NH4)2SO4 ના દ્રાવણ સાથે 1 : 1 મોલર પ્રમાણમાં મિશ્ર કરવામાં આવે છે ત્યારબાદ તે Fe2+ આયનની પરખ (કસોટી) આપે છે, જ્યારે CuSO4 ના દ્રાવણને જલીય એમોનિયા સાથે 1 : 4 મોલર પ્રમાણમાં મિશ્ર કરવામાં આવે છે ત્યારે Cu2+ આયનની પરખ (કસોટી) આપતું નથી. સમજાવો, શા માટે ?
ઉત્તર:
- જ્યારે FeSO4 અને (NH4)2SO4 ના દ્રાવણોને 1 : 1 મોલર પ્રમાણમાં મિશ્ર કરવામાં આવે છે. ત્યારે દ્વિક્ષાર (મ્હોર ક્ષાર) બને છે.

- આ દ્વિક્ષારને ઓગાળતા Fe+2 આયન ઉત્પન્ન થાય છે. તેનું જલીય દ્રાવણ Fe+2 ની કસોટી આપે છે.
- પરંતુ જ્યારે CuSO4(aq) ને NH3 સાથે મિશ્ર કરવામાં આવે ત્યારે નીચે મુજબ સંકીર્ણ બને છે.
CuSO4(aq) + NH3(aq) → [Cu(NH3)4] SO4 - આ સંકીર્ણના આયનીકરણથી Cu+2 ઉત્પન્ન થતા નથી. Cu એ [Cu(NH3)4]+2 નો એક ભાગ છે. તેથી તે Cuની કસોટી આપતું નથી.
![]()
પ્રશ્ન 3.
નીચેનામાંથી દરેકના બે-બે ઉદાહરણ આપી સમજાવો.
સવર્ગ સ્વિસીઝ લિગેન્ડ, સવર્ગ આંક, સવર્ગ પૉલિહેડ્રોન હોમોલેપ્ટિક અને હીટરોલેપ્ટિક.
ઉત્તર:
- સવર્ગ આંક : લિગેન્ડના દાતા પરમાણુની સંખ્યા જેની સાથે ધાતુ સીધેસીધી જ બંધિત હોય છે, તેને સવર્ણાંક કહે છે.
ઉદા., [PtCl6]-2 અને [Ni(NH3)4]+2 સંકીર્ણ આયનોમાં Pt અને Ni નો સવર્ગ આંક અનુક્રમે 6 અને 4 છે. - [Fe(C2O4)3]-3 અને [Co(en)3]+3 સંકીર્ણોમાં Fe અને Coનો સવર્ગ આંક 6 છે. કારણ કે C2O2-4 અને en(ઇથેન- 1, 2-ડાયએમાઇન) દ્વિદંતીય લિગેન્ડ છે.
- સવર્ગ પ્રભાવક્ષેત્ર (સવર્ગ સ્પિસીઝ) : મધ્યસ્થ પરમાણુ આયન અને તેની સાથે જોડાયેલ લિગેન્ડને ચોરસ કૌંસમાં સમાવાયા અને તેને સામૂહિક રીતે સવર્ગ પ્રભાવક્ષેત્ર કહે છે.
- આયનીકરણ પામતા સમૂહ કૌંસની બહાર લખાય છે તેને પ્રતિ આયન કહે છે. ઉદા., K4[Fe(CN)6] સંકીર્ણમાં [Fe(CN)6]4- સવર્ગ પ્રભાવક્ષેત્ર છે અને K+ પ્રતિ આયન છે.
- સવર્ગ બહુફલક (પૉલિહેડ્રોન) : મધ્યસ્થ પરમાણુ આયન સાથે સીધા જ જોડાયેલા છે તે લિગેન્ડ પરમાણુઓની અવકાશીય ગોઠવણીથી ઉદ્ભવતી ભૌમિતિક રચનાને સવર્ગ બહુલક કહે છે.
ઉદા., : [Ni(CO)4] → સમચતુલકીય
[Co(NH3)6]+3 → અષ્ટફલકીય
[PtCl4]2- → સમચોરસ - જુદાજુદા સવર્ગ બહુફલકના આકાર :
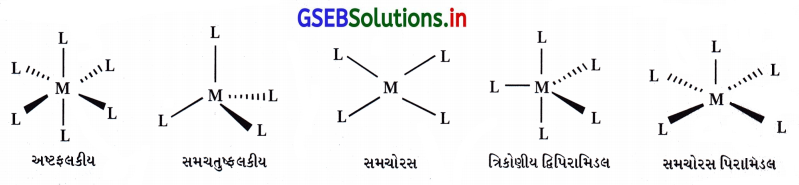
- હોમોલેપ્ટિક સંકીર્ણ : જે સંકીર્ણમાં ધાતુ એક જ પ્રકારના દાતા સમૂહ સાથે બંધિત હોય છે તેને હોમોલેપ્ટિક સંકીર્ણ કહે છે.
ઉદા., : [Co(NH3)6]+ - હિટરોલેપ્ટિક સંકીર્ણ : જે સંકીર્ણમાં ધાતુ એક કરતાં વધારે પ્રકારના દાતા સમૂહ સાથે બંધિત હોય છે તેને હિટરોલેપ્ટિક સંકીર્ણ કહે છે.
ઉદા., : [Co(NH3)4Cl2]+ - લિગેન્ડ : સવર્ગ સંયોજનોમાં મધ્યસ્થ ધાતુ પરમાણુ સાથે બંધિત આયન અથવા અણુને લિગેન્ડ કહે છે.
ઉદા., Cl–, CN–, C2O-24 જેવા ઋણ આયનો અને H2O, NH3, en, pn, ptn જેવા તટસ્થ અણુઓ.
પ્રશ્ન 4.
એકદંતી, દ્વિદંતી અને એમ્બિડેન્ટેટ (ambidentate) લિગેન્ડનો શું અર્થ થાય છે ? દરેકના બે ઉદાહરણ આપો.
ઉત્તર:
(i) એકદંતી લિગેન્ડ: જ્યારે લિગેન્ડ ધાતુ આયન સાથે એકાકી દાતા પરમાણુ દ્વારા બંધિત થાય છે, તેવા લિગેન્ડને એકદંતી લિગેન્ડ કહે છે.
ઉદા., : 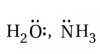 જેવા તટસ્થ અણુઓ અને Cl–, CN–, OH– જેવા ઋણ આયનો
જેવા તટસ્થ અણુઓ અને Cl–, CN–, OH– જેવા ઋણ આયનો
(ii) દ્વિદંતી લિગેન્ડ : જયારે લિગેન્ડ બે દાતા પરમાણુઓ દ્વારા બંધિત થાય છે તેવા લિગેન્ડને દ્વિદંતીય લિગેન્ડ કહે છે.
ઉદા., : H2N – CH2 – CH2 – ![]() (en) (ઇથેન 1,2- ડાયએમાઇન), C2O2-4, (ઑક્સેલેટ)
(en) (ઇથેન 1,2- ડાયએમાઇન), C2O2-4, (ઑક્સેલેટ)
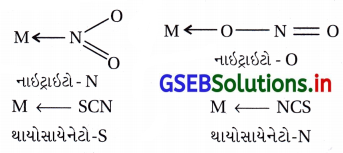
(vi) ઉભયદંતી લિગેન્ડ : જે લિગેન્ડ બે જુદા-જુદા દાતા પરમાણુ ધરાવે છે તથા તે પૈકીના કોઈ એક દાતા પરમાણુ વડે સંકીર્ણમાં
લિગેન્ડ જોડાય છે તેને ઉભયદંતી લિગેન્ડ કહે છે.
ઉદા., : SCN– અને NO–2
SCN– આયન સલ્ફર અથવા નાઇટ્રોજન મારફતે સવર્ગ સંયોજન બનાવે છે.
NO–2 આયન મધ્યસ્થ ધાતુ આયન સાથે નાઇટ્રોજન અથવા ઑક્સિજન દ્વારા સવર્ગ સંયોજન બનાવે છે.
પ્રશ્ન 5.
નીચેની સવર્ગ સ્પિસીઝમાં ધાતુનો ઑક્સિડેશન આંક નિર્દેશો :
(i) [Co(H2O)(CN)(en)2]2+
(ii) [CoBr2(en)2]+
(iii) [PtCl4]2-
(iv) K3[Fe(CN)6]
(v) [Cr(NH3)3Cl3]
ઉત્તર:
(i) [Co(H2O)(CN)(en)2]2+
x + 0 – 1 + (2 × 0) = +2
x = 2 + 1 = 3
(ii) [CoBr2(en)2]+
x + 2 × (-1) + (2 × 0) = +l
x = +3
(iii) [PtCl4]2-
x + (-1)4 = -2
x – 4 = -2
x = +2
(iv) K3[Fe(CN)6]
(+1) × 3 + x + (-1) × 6 = 0
3 + x – 6 = 0
x = +3
(v) [Cr(NH3)3Cl3]
x + (3 × 0) + (3 × (-1)) = 0
x = +3
પ્રશ્ન 6.
IUPAC નિયમોનો ઉપયોગ કરી નીચેનાનાં સૂત્રો લખો :
(i) ટેટ્રાહાઇડ્રૉક્સોઝિંકેટ(II)
(ii) પોટેશિયમટેટ્રાક્લોરાઇડોપેલેડેટ(II)
(iii) ડાયઅમ્માઇનડાયક્લોરોઈડોપ્લેટિનમ(II)
(iv) પોટેશિયમટેટ્રાસાયનાઇડોનિકલેટ(II)
(v) પેન્ટાઅમ્માઇનનાઇટ્રાઇટો-O-કોબાલ્ટ(III)
(vi) હેક્ઝાઅમ્માઇનકોબાલ્ટ(III)સલ્ફેટ
(vii) પોટેશિયમટ્રાય(ઑક્સેલેટો)ક્રોમેટ(III)
(viii) હેક્ઝાઅમ્માઇનપ્લેટિનમ(IV)
(ix) ટેટ્રાબ્રોમાઇડોક્યુપ્રેટ(II)
(x) પેન્ટાઅમ્માઇનનાઇટ્રાઇટો-N-કોબાલ્ટ(III)
ઉત્તર:
(i) ટેટ્રાહાઇડ્રૉક્સોઝિંકેટ(II) → [Zn(OH)4]-2
(ii) પોટૅશિયમટેટ્રાક્લોરાઇડોપેલેડેટ(II) → K2[PdCl4]
(iii) ડાયઅમ્માઇનડાયક્લોરોઇડોપ્લેટિનમ(II) → [Pt(NH3)2Cl2]
(iv) પોટૅશિયમટેટ્રાસાયનાઇડોનિકલેટ(II) → K2[Ni(CN)4]
(v) પેન્ટાઅમ્માઇનનાઇટ્રાઇટો-O-કોબાલ્ટ(III) → [Co(NH3)5(ONO)]+2
(જેમાં O- દર્શાવે છે કે NO લિગેન્ડમાં O થી બંધિત થયેલ છે.)
(vi) હેક્ઝાઅમ્માઇનકોબાલ્ટ(III)સલ્ફેટ → [Co(NH3)6]2 (SO4)3
(vi) પોટૅશિયમટ્રાય(ઑક્સેલેટો)ક્રોમેટ(III) → K3[Cr(C2O4)3]
(viii) હેક્ઝાઅમ્માઇનપ્લેટિનમ(IV) → [Pt(NH3)6]+4
(ix) ટેટ્રાબ્રોમાઇડોક્યુપ્રેટ(II) → [CuBr4]-2
(x) પેન્ટાઅમ્માઇનનાઇટ્રાઇટો-N-કોબાલ્ટ(III) → [Co(NH3)5(NO2)]+2
(અહીં, N- એ દર્શાવે છે કે NO2 માં N થી બંધન થયેલ છે.)
![]()
પ્રશ્ન 7.
IUPAC નિયમોનો ઉપયોગ કરી નીચેનાના પદ્ધતિસરના નામ લખો :
(i) [Co(NH3)6]Cl3
(ii) [Pt(NH3)2 CI(NH2CH3)]Cl
(iii) Ti(H2O)6]3+
(iv) [Co(NH3)4 Cl(NO2)]Cl
(v) [Mn(H2O)6]2+
(vi) [NiCl4]–
(vii) [Ni(NH3)6] Cl2
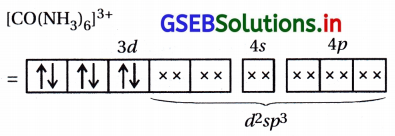
(viii) [Co(en)3]3+
(ix) [Ni(CO)4]
ઉત્તર:
(i) હેક્ઝાઅમ્માઇનકોબાલ્ટ(III)ક્લોરાઇડ
(ii) ડાયઅમ્માઇનક્લોરાઇડો(મિથાઇલએમાઇન)પ્લેટિનમ (II)ક્લોરાઇડ
(iii) હેક્ઝાએક્વાટિટેનિયમ(III)આયન
(iv) ટેટ્રાઅમ્માઇનક્લોરાઇડોનાઇટ્રાઇટો-N-કોબાલ્ટ(III) ક્લોરાઇડ
(v) ક્લોરાઇડ હેક્ઝાએક્વાયેંગેનીઝ(II)આયન
(vi) ટેટ્રાક્લોરાઇડોનિકલેટ(II)આયન
(vii) હેક્ઝાએમ્માઇનનીકસ(II)ક્લોરાઇડs
(viii) ટ્રીસ-(ઇથેન-1,2-ડાયએમાઇન)કોબાલ્ટ(III)આયન
(ix) ટેટ્રાકાર્બોનિલનિકલ(O)
પ્રશ્ન 8.
દરેકનું એક ઉદાહરણ આપી સવર્ગ સંયોજનોમાં શક્ય સમઘટકતાના જુદા જુદા પ્રકારની યાદી બનાવો.
ઉત્તર:
સમઘટકતાના મુખ્યત્વે બે પ્રકાર છે :
(1) બંધારણીય સમઘટકતા : જેના ચાર પ્રકાર છે.
(a) બંધન સમઘટકતા :
[CO(NH3)5NO2]Cl2 અને [CO(NH3)5ONO]Cl2
(b) સવર્ગ સમઘટકતા :
[CO(NH3)6] [Cr(CN)6] અને [Cr(NH3)6] [CO(CN)6]
(c) આયનીકરણ સમઘટકતા :
[CO(NH3)5SO4]Br અને [CO(NH3)5Br]SO4
(d) દ્રાવકમિશ્રણ સમઘટકતા :
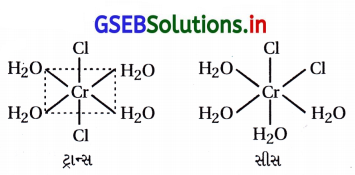
[Cr(H2O)6]Cl3 (જાંબલી) અને [Cr(H2O)5Cl] Cl2 • H2O (ભૂરો-લીલો)
(2) અવકાશીય સમઘટકતા :
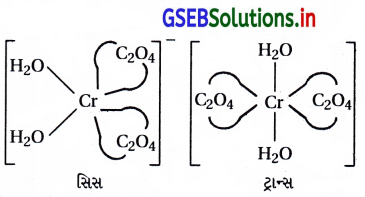
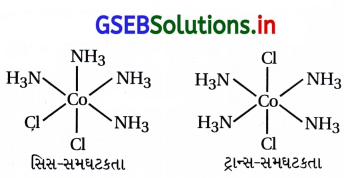
(a) ભૌમિતિક સમઘટકતા :
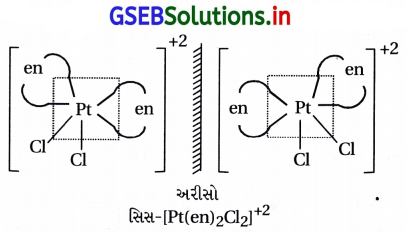
સિસ અને ટ્રાન્સ સમઘટકતા [COCl2(en)2]
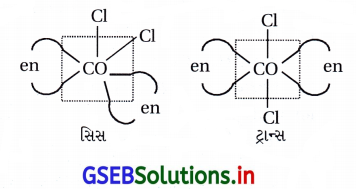
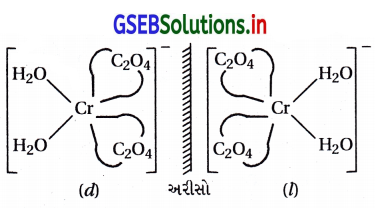
(b) પ્રકાશ સમઘટકતા : : [CO(en)3]+3

પ્રશ્ન 9.
નીચેની સવર્ગ સ્પિસીઝમાં ભૌમિતિક સમઘટક શક્ય છે ?
(i) [Cr(C2O4)3]3-
(ii) [Co(NH3)3Cl3]
ઉત્તર:
(i) [Cr(C2O4)3]3-માં ભૌમિતિક સમઘટકો મળતા નથી.
(ii) [Co(NH3)3Cl3] માં બે ભૌમિતિક સમઘટકો મળે છે.
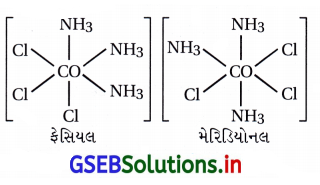
પ્રશ્ન 10.
નીચેનાનાં પ્રકાશીય સમઘટકોના બંધારણ દોરો.
(i) [Cr(C2O4)3]-3
(ii) [PtCl2(en)2]+2
(iii) (Cr(NH3)2 Cl2(en)]+
ઉત્તર:
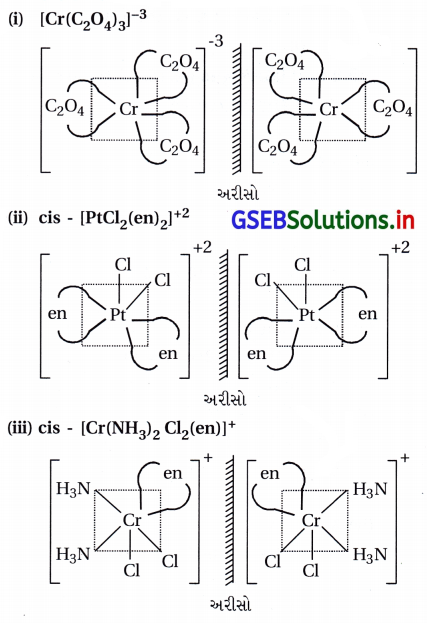
પ્રશ્ન 11.
નીચેનાના બધા જ સમઘટકો (ભૌમિતિક અને પ્રકાશીય) દોરો :
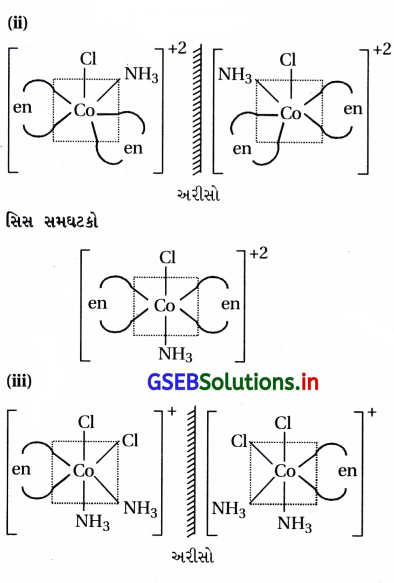
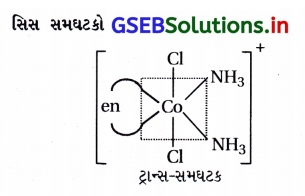
(i) [CoCl2(en)2]+
(ii) [Co(NH3) Cl(en)2]2+
(iii) [Co(NH3)2Cl2(en)]+
ઉત્તર:
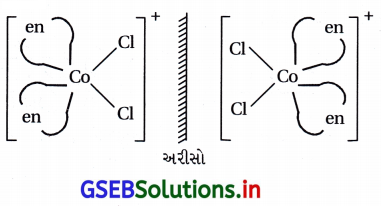
(i) [CoCl2(en)2]+ને બે ભૌમિતિક સમઘટકો મળે છે. અને સિસ-સમઘટક એ પ્રકાશ સમઘટકતા ધરાવે છે.

![]()
પ્રશ્ન 12.
[Pt(NH3)(Br)(Cl)(py)] ના બધા ભૌમિતિક સમઘટકો દોરો અને આમાંના કેટલા પ્રકાશીય સમઘટકતા પ્રદર્શિત કરશે ?
ઉત્તર:
ત્રણ ભૌમિતિક સમઘટકો મળે છે. (બે સિસ અને એક ટ્રાન્સ)
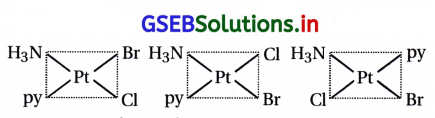
અહીં, સંકીર્ણમાં સવર્ગ આંક 4 હોવાથી તે પ્રકાશીય સમઘટકતા મળશે નહીં.
પ્રશ્ન 13.
જલીય કૉપર સલ્ફેટ રંગીન દ્રાવણ (રંગમાં વાદળી) …………………….
(i) જલીય પોટેશિયમ ફ્લોરાઇડ સાથે લીલા અવક્ષેપ આપે છે અને
(ii) જલીય પોટેશિયમ ક્લોરાઇડ સાથે તેજસ્વી લીલું દ્રાવણ આપે છે. આ પ્રાયોગિક પરિણામો સમજાવો.
ઉત્તર:

પ્રશ્ન 14.
કોપર સલ્ફેટના જલીય દ્રાવણમાં વધુ પ્રમાણમાં જલીય KCN ઉમેરવામાં આવે ત્યારે બનતી સંકીર્ણ સ્વિસીઝ કઈ હશે ? જ્યારે H2S(g) આ દ્રાવણમાંથી પસાર કરવામાં આવે છે ત્યારે કોપર સલ્ફાઇડના અવક્ષેપ શા માટે મળતા નથી ?
ઉત્તર:
જ્યારે CuSO4 માં વધુ પ્રમાણમાં જલીય KCN ઉમેરવામાં આવે ત્યારે K2[Cu(CN4)](aq) સંકીર્ણ બને છે. અહીં CN– પ્રબળ લિગેન્ડ હોવાથી સ્થાયી સંકીર્ણ બને છે. તેના સ્થિરતા અચળાંકની કિંમત = 2.0 × 1017 છે.

પ્રશ્ન 15.
સંયોજકતા બંધન સિદ્ધાંતના આધારે નીચેની સવર્ગ સ્વિસીઝમાં બંધનની ચર્ચા કરો :
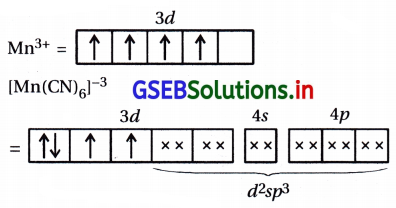
(i) [Fe(CN)6]4-
(ii) [FeF6]3-
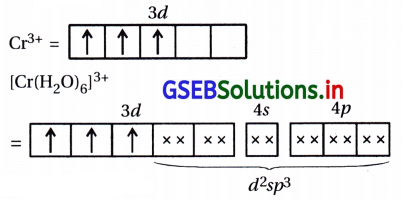
(iii) [Co(C204)3]3-
(iv) [CoF6]3-
ઉત્તર:
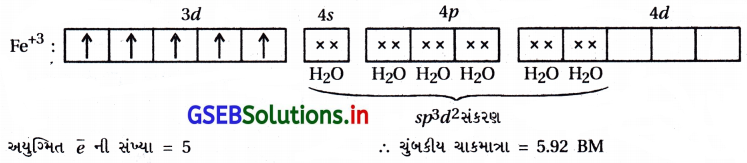
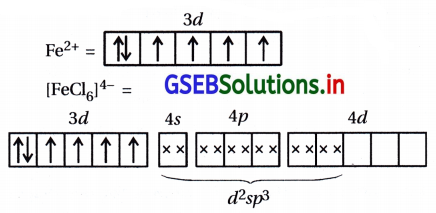
(i) [Fe(CN)6]4- : આ સંકીર્ણમાં Feની ઑક્સિડેશન અવસ્થા +2 છે.
Fe : [Ar] 3d6 4s2
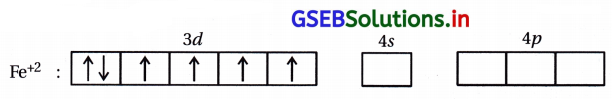
અહીં CN– પ્રબળ લિગેન્ડ હોવાથી d-કક્ષકમાં \(\bar{e}\) નું યુગ્મીકરણ થઈ બે 3d-કક્ષક ખાલી થશે.

બધા જ \(\bar{e}\) યુગ્મિત હોવાથી પ્રતિચુંબકીય સંકીર્ણ છે. 3d-કક્ષક સંકીર્ણમાંના સંકરણમાં ભાગ લેતી હોવાથી આંતરકક્ષકીય સંકીર્ણ છે.
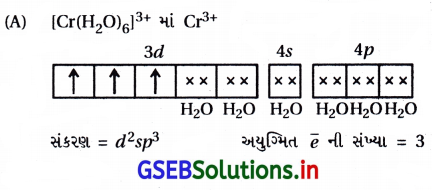
(ii) [FeF6]3- : અહીં, સંકીર્ણમાં Fe એ +3 ઑક્સિડેશન અવસ્થા ધરાવે છે.
Fe+3 : 3d5 4s0
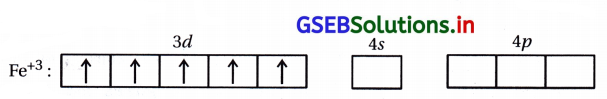
અહીં F– નિર્બળ લિગેન્ડ હોવાથી 3d-કક્ષકમાં \(\bar{e}\) નું યુગ્મીકરણ થશે નહીં.
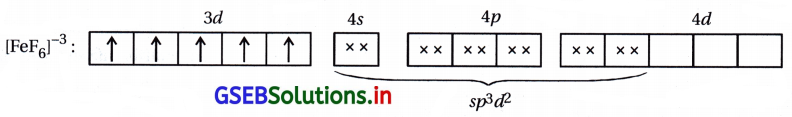
અહીં, સંકીર્ણમાં પાંચ અયુગ્મિત \(\bar{e}\) હોવાથી સંકીર્ણ અનુચુંબકીય છે અને બાહ્યકક્ષકીય સંકીર્ણ છે.
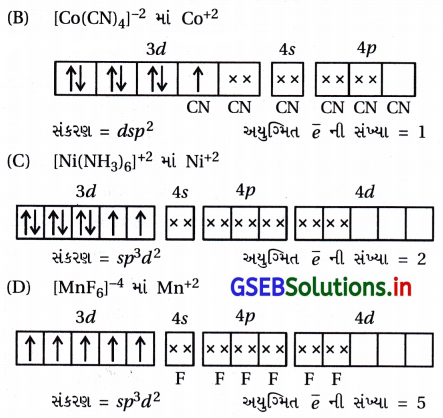
(iii) [Co(C204)3]3- : અહીં, સંકીર્ણમાં CO એ +3 ઑક્સિડેશન અવસ્થા ધરાવે છે.
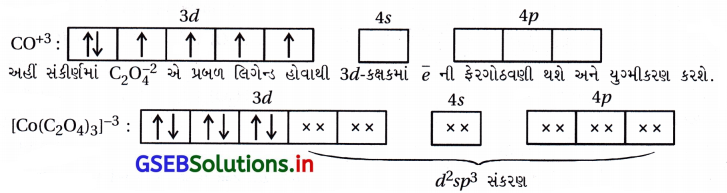
સંકીર્ણમાં બધા જ \(\bar{e}\) યુગ્મિત હોવાથી પ્રતિચુંબકીય છે અને અંદરની 3d-કક્ષક ભાગ લેતી હોવાથી આંતરકક્ષકીય સંકીર્ણ છે.
(iv) [CoF6]3- : અહીં સંકીર્ણમાં Co એ +3 ઑક્સિડેશન અવસ્થા ધરાવે છે.
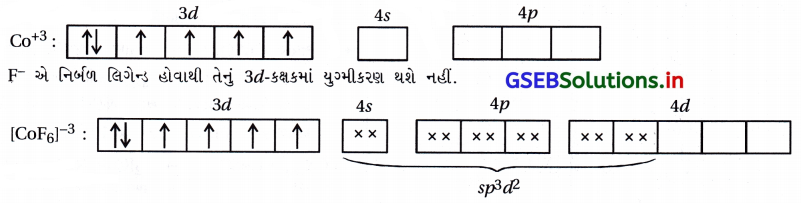
ચાર અયુગ્મિત \(\bar{e}\) હોવાથી અનુચુંબકીય ગુણ ધરાવે છે અને 4d-કક્ષક સંકરણમાં ભાગ લેતી હોવાથી બાહ્યકક્ષક સંકીર્ણ છે.
પ્રશ્ન 16.
અષ્ટલકીય સ્ફટિકક્ષેત્રમાં d-કક્ષકોનું વિપાટન દર્શાવતી આકૃતિ દોરો.
ઉત્તર:
સ્ફટિકક્ષેત્ર સિદ્ધાંત (CFT) સ્થિરવિદ્યુતીય નમૂનો છે.
ધાતુ પરમાણુ આયનમાંથી પાંચ d-કક્ષકોની સરખી ઊર્જા હોય છે. એટલે સમશક્તિ છે. આ સમશક્તિપણું ધાતુ પરમાણુ / આયનની આસપાસ ઋણભારનું ગોલીય સમિત ક્ષેત્ર જાળવી રાખે છે. પરંતુ જો સંકીર્ણમાં લિગેન્ડને લીધે ઋણભાર ક્ષેત્ર હોય ત્યારે તે અસમિત બને છે અને d-કક્ષકોનું સમશક્તિપણું દૂર થાય છે, તે d-કક્ષકોના વિપાટનમાં પરિણમે છે.
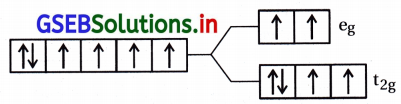
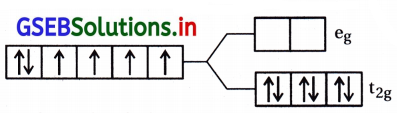
અષ્ટફલકીય સવર્ગ સ્વિસીઝમાં સ્ફટિકક્ષેત્ર વિપાટન : ધાતુ પરમાણુ | આયનની આસપાસ છ લિગેન્ડથી ઘેરાયેલ અષ્ટફલકીય સવર્ગ સ્પિસીઝમાં ધાતુની d-કક્ષકોના ઇલેક્ટ્રૉન અને લિગેન્ડના ઇલેક્ટ્રૉન વચ્ચે અપાકર્ષણ થશે. આ અપાકર્ષણ ધાતુની ત-કક્ષકો લિગેન્ડથી દૂર હોય તેના કરતાં લિગેન્ડની દિશા તરફ હોય ત્યારે વધારે હોય છે. તેથી dx2 – y2 dz2 કક્ષકો વધુ અપાકર્ષણ દર્શાવશે અને વધુ ઊર્જા ધરાવશે. જ્યારે dxy, dyz, dzx d-કક્ષકો જે અક્ષની વચ્ચે હોય છે તે ઓછું અપાકર્ષણ દર્શાવશે અને ઓછી ઊર્જા ધરાવશે.
આથી ધાતુની ત-કક્ષકોનું સમશક્તિપણું દૂર થશે અને પરિણામે ત્રણ કક્ષકો નીચી ઊર્જાનો t2g માં ગોઠવાશે અને બે કક્ષકો ઊંચી ઊર્જાના egમાં ગોઠવાશે. એટલે કે સમશક્તિ સ્તરોમાં લિગેન્ડની હાજરીને કારણે થતા વિપાટનને સ્ફટિકક્ષેત્ર વિપાટન કહે છે અને આ અલગીકરણને Δ0 (પાદાક્ષર o વડે દર્શાવાય છે.
આમ, બે eg કક્ષકોની ઊર્જા (\(\frac{3}{5}\))Δ0 જેટલી વધશે અને ત્રણ t2g ક્ષકોની ઊર્જા (\(\frac{3}{5}\))Δ0 જેટલી ઘટશે.
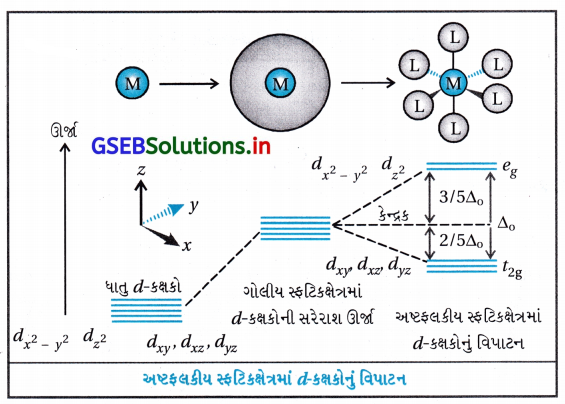
કેટલાક લિગેન્ડ પ્રબળ ક્ષેત્ર ઉત્પન્ન કરે છે. જેથી તેમાં વધારે (મોટું) વિપાટન થશે અને જે લિગેન્ડ નિર્બળ ક્ષેત્ર ઉત્પન્ન કરે છે તેમાં ઓછું (નાનું) વિપાટન થશે.
લિગેન્ડની પ્રબળતાનો ક્રમ નીચે મુજબ દર્શાવી શકાય છે. જેને વર્ણપટી રાસાયણિક શ્રેણી (સ્પેક્ટ્રૉકેમિકલ શ્રેણી) કહે છે.
I– < Br– < SCN– < Cl– < S-2 < F– < OH– < C2O4-2 < H2O < NCS– < edta-4 < NH3 < en < CN– < Co
હવે એકાકી d-ઇલેક્ટ્રૉન t2g કક્ષકોની નીચેની ઓછી ઊર્જાવાળી t2g કક્ષકમાં ભરાશે. d2 અને d3 સવર્ગ સ્પિસીઝમાં d-ઇલેક્ટ્રૉન dૐ હુન્ડના નિયમ પ્રમાણે એકાકી t2g કક્ષકમાં ભરાશે.
d4 આયન માટે e– ની વહેંચણીના બે વિપાટન ઉદ્ભવશે. (i) ચોથો e– t2g સ્તરમાં જશે અને યુગ્મન કરશે. (ii) ચોથો e–eg સ્તરમાં ગોઠવાશે.
ઉપરોક્ત આ બેમાંથી કઈ શક્યતા પરિણમશે તે સ્ફટિકક્ષેત્ર વિપાટન (Δ0)ની સાપેક્ષ માત્રા અને યુગ્મન ઊર્જા (P) પર આધાર રાખશે.
(i) જો Δ0 < P હોય તો ચોથો e–eg કક્ષકમાં ગોઠવાશે અને \(t_{2 \mathrm{~g}}^3 \mathrm{e}_{\mathrm{g}}^1\) સંરચના આપશે. જે લિગેન્ડ આ અસર ઉત્પન્ન કરે તેને નિર્બળ ક્ષેત્ર લિગેન્ડ કહે છે અને તે ઉચ્ચ ભ્રમણ સંકીર્ણ બનાવે છે.
(ii) જો Δ0 > P હોય તો તે ચોથો e–e2g કક્ષકમાં ગોઠવાય છે. \(t_{2 \mathrm{~g}}^4 \mathrm{e}_{\mathrm{g}}^0\) સંરચના આપશે. જે લિગેન્ડ આ અસર ઉત્પન્ન કરે તેને પ્રબળ ક્ષેત્ર લિગેન્ડ કહે છે અને તે નિમ્ન ભ્રમણ સંકીર્ણ બનાવે છે.
d4 થી d7 સંકીર્ણ સ્પિસીઝ નિર્બળક્ષેત્ર કરતાં પ્રબળ ક્ષેત્રના કિસ્સામાં વધુ સ્થાયી હોય છે.
સમચતુલકીય સવર્ગ સ્પિસીઝમાં સ્ફટિકક્ષેત્ર વિપાટન :
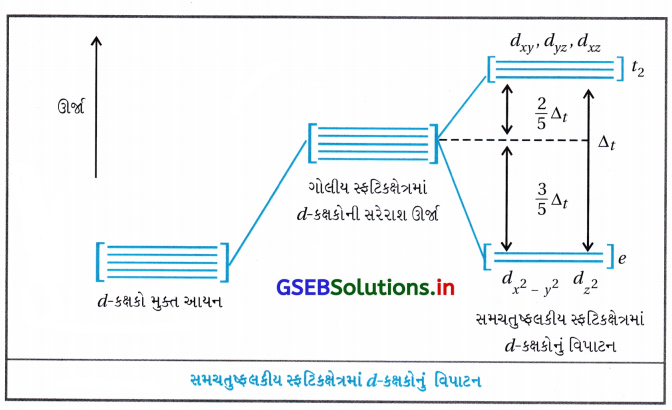
સમચતુલકીય સવર્ગ સ્પિસીઝમાં d-કક્ષકોનું વિપાટન ઊલટું છે અને તે અષ્ટફલકીય ક્ષેત્ર વિપાટન કરતાં ઓછું હોય છે.
સમાન ધાતુ માટે સમાન લિગેન્ડ અને ધાતુ લિગેન્ડ અંતર માટે Δt = (\(\frac{4}{9}\))Δ0 દર્શાવી શકાય છે.
પરિણામે કક્ષકીય વિપાટન ઊર્જાઓ વધુ યુગ્મનને દબાણ કરવા માટે પૂરતી હોતી નથી અને તેથી નિમ્નભ્રમણ સંરચના ભાગ્યે જ જોવા મળે છે.
![]()
પ્રશ્ન 17.
સ્પેક્ટ્રમી રાસાયણિક શ્રેણી શું છે ? નિર્બળ ક્ષેત્ર લિગેન્ડ અને પ્રબળ ક્ષેત્ર લિગેન્ડ વચ્ચે તફાવત સમજાવો.
ઉત્તર:
- લિગેન્ડને તેની પ્રબળતાના વધારા પ્રમાણે ક્રમવાર શ્રેણીમાં નીચે પ્રમાણે દર્શાવી શકાય છે :
I– < Br– < SCN– < Cl– < S-2 < F– < OH– < C2O-24 < HO < NCS– < EDTA-4 < NH3 < en < CN– < CO આ શ્રેણીને સ્પેક્ટ્રમી (વર્ણપટી) રાસાયણિક શ્રેણી કહે છે. - જે લિગેન્ડની (Δ0) સ્ફટિકક્ષેત્ર વિપાટન ઊર્જાનું મૂલ્ય ઓછું હોય તેને નિર્બળક્ષેત્ર લિગેન્ડ કહે છે. આ લિગેન્ડ માટે જ્યાં Δ0 < P = યુગ્મીકરણ ઊર્જા,
- જે લિગેન્ડમાં સ્ફટિકક્ષેત્ર વિપાટનઊર્જાનું મૂલ્ય વધુ હોય તેને પ્રબળક્ષેત્ર લિગેન્ડ કહે છે. આ લિગેન્ડ માટે Δ0 > P
પ્રશ્ન 18.
સ્ફટિકક્ષેત્ર વિપાટન ઊર્જા શું છે ? Δ0 ની માત્રા સવર્ગ સ્પિસીઝમાં d-કક્ષકોની વાસ્તવિક (actual) રચના કેવી રીતે નક્કી કરે છે ?
ઉત્તર:
- અષ્ટફલકીય પ્રકીર્ણમાં લિગેન્ડ ઇલેક્ટ્રૉન અને ધાતુ ઇલેક્ટ્રૉનને લીધે d-કક્ષકોનું સમશક્તિપણું દૂર થશે જેને પરિણામે ઋણ કક્ષકો નીચી ઊર્જાના t2g માં ગોઠવાશે અને બે કક્ષકો ઊંચી ઊર્જાના eg માં ગોઠવાશે. કક્ષકોમાં થતા ઊર્જાના આ તફાવતને સ્ફટિકક્ષેત્ર વિપાટન કહે છે. Δ0 એ અષ્ટફલકીય માટે છે.
- જો Δ0 < P હોય તો, ચોથો \(\bar{e}\) એ eg કક્ષકમાં ગોઠવાશે અને \(t_{2 \mathrm{~g}}^3 \mathrm{e}_{\mathrm{g}}^1\) રચના આપશે તેમને નિર્બળ ક્ષેત્ર લિગેન્ડ કહે છે અને તે ઉચ્ચ ભ્રમણ સંકીર્ણ રચે છે.
- જો Δ0 > P હોય તો, તેનો ચોથો \(\bar{e}\) t2g કક્ષકમાં ગોઠવાશે અને \(t_{2 g}^4 e_g^0\) રચના આપશે તેમને પ્રબળ ક્ષેત્ર લિગેન્ડ કહે છે અને તે નિમ્નભ્રમણ સંકીર્ણ રચે છે.
પ્રશ્ન 19.
[Cr(NH3)6]3+ અનુચુંબકીય છે જ્યારે [Ni(CN)4]2- પ્રતિચુંબકીય છે. સમજાવો શા માટે ?
ઉત્તર:
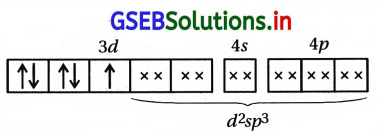
[Cr(NH3)6]3+ સંકીર્ણમાં Cr+3 ઑક્સિડેશન અવસ્થા ધરાવે છે.
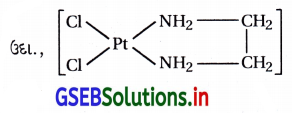
આ સંકીર્ણમાં d2sp3 સંકરણ થાય છે અને ત્રણ અયુગ્મિત \(\bar{e}\) ધરાવે છે. તેથી તે અનુચુંબકીય છે.
[Ni(CN)4]-2 :
આ સંકીર્ણમાં Ni એ +2 ઑક્સિડેશન અવસ્થા ધરાવે છે.

આ સંકીર્ણમાં C\(\overline{\mathrm{N}}\) એ પ્રબળક્ષેત્ર લિગેન્ડ હોવાથી 3d-કક્ષકમાં \(\bar{e}\) નું યુગ્મીકરણ થઈ એક 3d-કક્ષક ખાલી થાય છે.
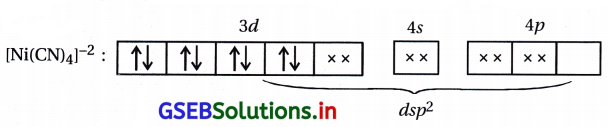
અહીં બધા જ \(\bar{e}\) યુગ્મિત હોવાથી સંકીર્ણ પ્રતિચુંબકીય ગુણધર્મ ધરાવે છે.
પ્રશ્ન 20.
[Ni(H2O)6]2+ નું દ્રાવણ લીલા રંગનું છે પરંતુ [Ni(CN)4]2- નું દ્રાવણ રંગવિહીન છે સમજાવો.
ઉત્તર:
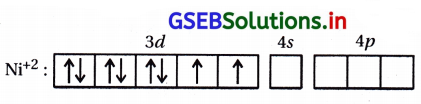
- [Ni(H2O)6]2+ સંકીર્ણમાં H2O એ નિર્બળક્ષેત્ર લિગેન્ડ છે. \(\bar{e}\) નું યુગ્મીકરણ કરતા નથી. તેથી સંકીર્ણમાં અયુગ્મિત \(\bar{e}\) જોવા મળશે. જે d- d સંક્રાંતિ અનુભવી લીલા રંગનું ઉત્સર્જન કરશે તેથી તે તેનું દ્રાવણ લીલા રંગનું જોવા મળશે.
- [Ni(CN)4]2- સંકીર્ણમાં CN– એ પ્રબળક્ષેત્ર લિગેન્ડ હોવાથી બે અયુગ્મિત \(\bar{e}\) નું યુગ્ગીકરણ કરશે. તેથી એક પણ અયુગ્મિત \(\bar{e}\) 3d-કક્ષકમાં ન હોવાથી તે d – d સંક્રાંતિ થશે નહીં. તેથી તેનું દ્રાવણ રંગવિહીન છે.
પ્રશ્ન 21.
[Fe(CN)6]4- અને [Fe(H2O)6]2+ મંદ દ્રાવણમાં જુદા જુદા રંગના હોય છે. શા માટે ?
ઉત્તર:
- ઉપરોક્ત બંને સંકીર્ણમાં Fe એ +2 ઑક્સિડેશન અવસ્થા ધરાવે છે.
Fe2+ : [Ar] 3d6 4s0
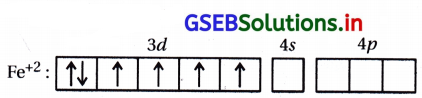
જે ચાર અયુગ્મિત ધરાવે છે.
- H2O નિર્બળ લિગેન્ડ હોવાથી \(\bar{e}\) નું યુગ્મીકરણ થશે નહિ. પરંતુ CN– જેવા પ્રબળ લિગેન્ડની હાજરીમાં \(\bar{e}\) નું યુગ્મીકરણ થશે અને એક પણ અયુગ્મિત \(\bar{e}\) નહીં જોવા મળે.
- આમ, બંને સંકીર્ણમાં અયુગ્મિત \(\bar{e}\) ની સંખ્યામાં તફાવત હોવાથી સંકીર્ણોના મંદ દ્રાવણ જુદા જુદા રંગના હોય છે.
પ્રશ્ન 22.
ધાતુ કાર્બોનિલમાં બંધનના સ્વભાવની (પ્રકૃતિ) ચર્ચા કરો.
ઉત્તર:
- માત્ર કાર્બોનિલ લિગેન્ડ ધરાવતાં જ સંયોજનોને હોમોલેપ્ટિક કાર્બોનિલ સંયોજનો કહે છે.
- આ સંયોજનો મોટાભાગની સંક્રાંતિ ધાતુઓ સાથે જ બને છે. આ કાર્બોનિલ સાદા, ખૂબ સ્પષ્ટ બંધારણ ધરાવતા હોય છે.
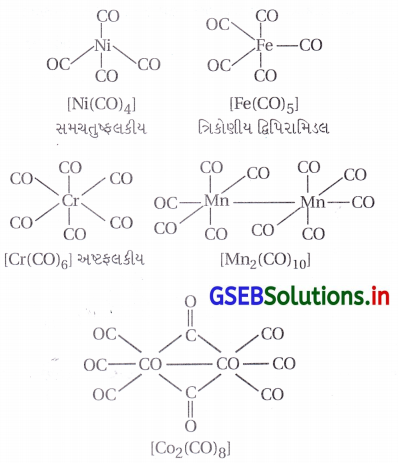
- [Ni(CO)4], [Fe(CO)5] અને [Cr(CO)3] અનુક્રમે સમચતુષ્કલક, ત્રિકોણીય દ્વિપિરામિડલ અષ્ટલકીય રચના ધરાવે છે.
- ડેકાકાર્બોનિલડાયમેંગેનીઝ (0) એ બે ચોરસ પિરામિડલ [Mn(CO)5] એકમોના Mn-Mn બંધ જોડાવાથી બને છે.
- ઓક્ટાકાર્બોનિલડાયકોબાલ્ટ (0) ને Co – Co બંધન બે CO સમૂહ વડે સેતુરચનાથી જોડાયેલ હોય છે.
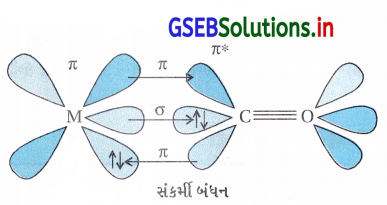
- ધાતુ કાર્બોનિલમાં ધાતુ-કાર્બન બંધ σ અને π બંને લાક્ષણિકતા ધરાવે છે. M-C σ બંધની રચના ધાતુની ખાલી કક્ષકોમાં કાર્બોનિલ કાર્બનના અબંધકારક \(\bar{e}\) ના દાનથી થાય છે.
- M – C π બંધની રચના CO ની ખાલી π* બંધપ્રતિકારક કક્ષકમાં ધાતુની પૂર્ણ ભરાયેલી d-કક્ષકોના દાનથી થાય છે.
- ધાતુનું લિગેન્ડ સાથે બંધન સંકર્મ અસર ઉત્પન્ન કરે છે જે ધાતુ અને CO વચ્ચેના બંધને સબળ બનાવે છે.
![]()
પ્રશ્ન 23.
નીચેના સંકીર્ણોમાં ઑક્સિડેશન અવસ્થા, d- કક્ષકોમાં ભરણ (occupation) અને મધ્યસ્થ ધાતુ આયનનો સવર્ગ આંક જણાવો.
(i) K3[Co(C2O4)3]
(ii) સિસ-[CrCl2(en)2]Cl
(iii) (NH4)2[CoF4]
(iv) [Mn(H2O)6]SO4
ઉત્તર:
(i) K3[Co(C2O4)3]
Co+3 ⇒ [Ar] 3d6
તેથી d-કક્ષક એ 6\(\bar{e}\) ધરાવે છે.
CO નો સવર્ગ આંક = 3 × 2 (C2O-2472 એ દ્વિદંતીય લિગેન્ડ)
= 6
(ii) સિસ-[CrCl2(en)2] Cl
Cr+3 = [Ar] 3d3
તેથી d-કક્ષકો એ 3\(\bar{e}\) ધરાવે છે.
Cr નો સવર્ગ આંક = 2 × 2 (en એ દ્વિદંત લિગેન્ડ છે) + 2
= 6
(iii) (NH4)2[CoF4]
Co+2 = [Ar] 3d7
તેથી d-કક્ષકોએ ૩૯ ધરાવે છે.
Co નો સવર્ગ આંક = 4
(iv) [Mn(H2O)6]SO4
Mn+2 = [Ar] 3d5
તેથી d-કક્ષક એ પાંચ \(\bar{e}\) ધરાવે છે.
Mn નો સવર્ગ આંક = 6
પ્રશ્ન 24.
નીચેના સંકીર્ણમાંના દરેકના IUPAC નામ લખો અને ઑક્સિડેશન અવસ્થા, ઈલેક્ટ્રૉનીય રચના અને સવર્ગ આંક સૂચવો અને સંકીર્ણનું અવકાશ રસાયણ અને ચુંબકીય ચાકમાત્રા જણાવો :
(i) K[Cr(H2O)2(C2O4)2] • 3H2O
(ii) [Co(NH3)5CI] Cl2
(iii) [CrCl3(py)3]
(iv) Cs[FeCl4]
(v) K4[Mn(CN)6]
ઉત્તર:
(i) K[Cr(H2O)2(C2O4)2] • 3H2O
IUPAC નામ : પોટૅશિયમડાયએક્વાઑક્સેલેટોક્રોમેટ(III)હાઇડ્રેટ
સવર્ગ આંક = 6 આકાર = અષ્ટફલકીય
ઑક્સિડેશન અવસ્થા = 3 \(\bar{e}\) રચના = 3d3
અયુગ્મિત \(\bar{e}\) = 3
ચુંબકીય ચાકમાત્રા (μ) = \(\sqrt{n(n+2)}\)
= \(\sqrt{3(3+2)}\) = 3.87 BM
ભૌમિતિક સમઘટકતા :
સિસ સમઘટકતા પ્રકાશ સમઘટકતા ધરાવે છે.
(ii) [Co(NH3)5Cl] Cl2
IUPAC નામ : પેન્ટાઅમ્માઇનક્લોરાઇડોકોબાલ્ટ(III)ક્લોરાઇડ
ઑક્સિડેશન અવસ્થા = +3 સવર્ગ આંક = 6
ઇલેક્ટ્રૉન રચના = 3d6 અયુગ્મિત \(\bar{e}\) = n = 0
ચુંબકીય ચાકમાત્રા (μ) = \(\sqrt{n(n+2)}\) = 0 BM
(iii) [CrCl3(py)3]
IUPAC નામ : ટ્રાયક્લોરાઇડોપિરીડીનક્રોમિયમ(III)
ઑક્સિડેશન અવસ્થા = +3 સવર્ગ આંક = 6
ઇલેક્ટ્રૉન રચના = 3d3 અયુગ્મિત \(\bar{e}\) = 3
ચુંબકીય ચાકમાત્રા (μ) = \(\sqrt{n(n+2)}\)
= 3.87 BM
ભૌમિતિક સમઘટકતા :

(iv) Cs[FeCl4]
IUPAC નામ : સિઝિયમટેટ્રાક્લોરાઇડોફેરેટ(III)
ઑક્સિડેશન અવસ્થા = +3 સવર્ગ આંક = 4
ઇલેક્ટ્રૉન રચના = 3d5 અયુગ્મિત \(\bar{e}\) = 5
ચુંબકીય ચાકમાત્રા (μ) = \(\sqrt{n(n+2)}\)
= 5.92 BM
ભૌમિતિક સમઘટકતા ન મળે.
(v) K4[Mn(CN)6]
IUPAC નામ : પોટૅશિયમહેક્ઝાસાયનોમેંગેનેટ(II)
ઑક્સિડેશન અવસ્થા = +2 સવર્ગ આંક = 6
ઇલેક્ટ્રૉન રચના = 3d5 અયુગ્મિત \(\bar{e}\) = 1
(કારણ કે CN– એ પ્રબળ લિગેન્ડ છે)
ચુંબકીય ચાકમાત્રા (μ) = 1.73 BM
પ્રશ્ન 25.
દ્રાવણમાં સવર્ગ સંયોજનની સ્થાયિતાનો અર્થ શું છે ? સંકીર્ણની સ્થાયિતાનું નિયંત્રણ કરતા પરિબળો જણાવો.
ઉત્તર:
- દ્રાવણમાં સંકીર્ણની સ્થાયિતા સંતુલન અવસ્થામાં સમાવિષ્ટ સ્પિસીઝ વચ્ચે થતા સુયોજનના અંશનો નિર્દેશ કરે છે.
- સુયોજન માટે સંતુલન અચળાંક સ્થાયિતાની માત્રા જથ્થાત્મક રીતે સ્થાયિતા રજૂ કરે છે.
આ પ્રક્રિયા માટે M + 4L → ML4
(સ્થાયિતા અચળાંક) K = \(\frac{\left[\mathrm{ML}_4\right]}{[\mathrm{M}][\mathrm{L}]^4}\) - જેટલો વધારે સ્થાયિતા અચળાંક તેટલું વધારે ML4 નું પ્રમાણ જે દ્રાવણમાં અસ્તિત્વ ધરાવે છે.
- સંકીર્ણની સ્થાયિતાને અસર કરતાં પરિબળો :
(i) મધ્યસ્થ ધાતુ આયનનો વીજભાર ઃ જેમ મધ્યસ્થ ધાતુ આયનનો વીજભાર વધુ તેમ તેની સ્થાયિતા વધુ.
(ii) ધાતુ આયનનો સ્વભાવ : સમૂહ 3 થી 6 અને આંતર- સંક્રાંતિ તત્ત્વો સ્થાયી સંકીર્ણ બનાવે છે. જ્યારે લિગેન્ડનો દાન કરનાર પરમાણુ N, O અને F હોય. સમૂહ 6 પછીના સંક્રાંતિ તત્ત્વો માટે જ્યારે લિગેન્ડનો દાન કરનાર પરમાણુ N, O અને F સમૂહનો ભારે તત્ત્વ હોય.
(iii) લિગેન્ડનો બેઝિક સ્વભાવ : જેમ લિગેન્ડનો બેઝિક (સ્વભાવ) પ્રબળતા વધુ તેમ સંકીર્ણની સ્થાયિતા વધુ.
(iv) કિલેટની હાજરી : કિલેટ ચક્રની હાજરી હોય તો સંકીર્ણની સ્થાયિતા વધે છે.
(v) બહુદંતીય ચક્રીય લિગેન્ડની હાજરી : જો લિગેન્ડ બહુદંતીય અને ચક્રિય હોય તો સંકીર્ણની સ્થાયિતા વધુ હોય છે.
પ્રશ્ન 26.
કિલેટ અસરનો અર્થ શું છે ? ઉદાહરણ આપો.
ઉત્તર:
જ્યારે દ્વિ અથવા બહુદંતીય લિગેન્ડ તેના બે અથવા વધારે દાતા પરમાણુને એકસાથે એકાકી ધાતુ આયનને બંધિત થવા ઉપયોગ કરે છે ત્યારે તે અસરને કિલેટ અસર કહે છે.
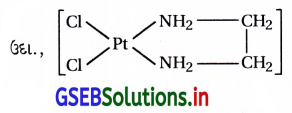
અથવા [PtCl2(en)]
![]()
પ્રશ્ન 27.
નીચેનામાંના દરેકમાં સવર્ગ સંયોજનોનો ફાળો (ભાગ) (role) ઉદાહરણ આપી ટૂંકમાં ચર્ચા કરો :
(i) જૈવિક પ્રણાલી
(ii) ઔષધીય રસાયણશાસ્ત્ર
(iii) વૈશ્લેષિક રસાયણશાસ્ત્ર
(iv) ધાતુઓનું નિષ્કર્ષણ/ધાતુકર્મવિધિ
ઉત્તર:
(i) જૈવિક પ્રણાલી :
- પ્રકાશસંશ્લેષણ માટે જવાબદાર વર્ણક, ક્લોરોફિલ એ Mg ધાતુનું સવર્ગ સંયોજન છે.
- હીમોગ્લોબિન, લોહીનો લાલ વર્ણક જે ઑક્સિજનનાં વાહક તરીકે કાર્ય કરે છે. તે આયર્ન (Fe) નું સવર્ગ સંયોજન છે.
- વિટામિન-B12, સાયનોકોબાલએમાઇન રક્તઅલ્પતા કારક Co (કોબાલ્ટ)નું સવર્ગ સંયોજન છે.
(ii) ઔષધીય રસાયણશાસ્ત્ર :
- પ્લેટિનમના કેટલાક સવર્ગ સંયોજનો અસરકારક રીતે ગાંઠની વૃદ્ધિમાં નિરોધક તરીકે કાર્ય કરે છે. ઉદા., સિસ-પ્લેટિન.
- EDTAનો લેડના વિષાલુકરણની સારવારમાં ઉપયોગ થાય છે.
- Cu અને Fe નો વધારો કિલેટિંગ લિગેન્ડ D-પેનિસિલેમાઇન અને ડેસફેરોક્ઝાઇમ B વડે સવર્ગ સંયોજનો રચના દ્વારા દૂર કરી શકાય છે.
(iii) વૈશ્લેષિક રસાયણશાસ્ત્ર :
- સવર્ગ સંયોજનો ગુણાત્મક અને જથ્થાત્મક રાસાયણિક વિશ્લેષણમાં ઉપયોગી છે.
- ધાતુ આયનની ઘણા લિગેન્ડ સાથેની રંગ આપવાની વિશ્લેષણની પ્રક્રિયાઓ જે સવર્ગ સંયોજનોની રચનાનું પરિણામ છે.
- આવા પ્રક્રિયકોના ઉદાહરણોમાં EDTA, DMG, α-નાઇટ્રૉસો-β-નેપ્થોલ, ક્યુપ્રોન વગેરેનો સમાવેશ થાય છે.
(iv) ધાતુઓનું નિષ્કર્ષણ :
- ગોલ્ડ અને સિલ્વર જેવી ધાતુના નિષ્કર્ષણમાં ઉપયોગી છે. ગોલ્ડ O2, અને H2O ની હાજરીમાં સાયનાઇડ સાથે સંયોજાય છે અને [Au(CN)2]– પાણીમાં રચાય છે. ત્યારબાદ તેમાં Zn ઉમેરી ગોલ્ડને અલગ કરી શકાય છે.
- અશુદ્ધ Ni ને [Ni(CO)4] માં પરાવર્તિત કરવામાં આવે છે. જેનું વિઘટન કરવાથી શુદ્ધ Ni મળે છે.
પ્રશ્ન 28.
[Co(NH3)6]Cl2 સંકીર્ણ દ્વારા દ્રાવણમાં કેટલા આયનો
નીપજશે ?
(i) 6
(ii) 4
(iii) 3
(iv) 2
ઉત્તર:
 જલીય માધ્યમમાં ત્રણ આયનો આપે છે.
જલીય માધ્યમમાં ત્રણ આયનો આપે છે.
પ્રશ્ન 29.
નીચેના આયનોમાંથી કયા આયનનું ચુંબકીય ચાકમાત્રાનું મૂલ્ય સૌથી ઊંચું (વધારે) હશે ?
(i) [Cr(H2O)6]3+
(ii) [Fe(H2O)6]2+
(iii) [Zn(H2O)6]2+
ઉત્તર:
- (i) [Cr(H2O)6]3+ અયુગ્મિત \(\bar{e}\) ની સંખ્યા = 3
(ii) [Fe(H2O)6]2+ અયુર્ભિત \(\bar{e}\) ની સંખ્યા = 4
(iii) [Zn(H2O)6]2+ અયુગ્મિત \(\bar{e}\) ની સંખ્યા = 0 - તેથી [Fe(H2O)6]+2 સંકીર્ણમાં અયુગ્મિત \(\bar{e}\) ની સંખ્યા મહત્તમ છે. તેથી તેની ચુંબકીય ચાકમાત્રા સૌથી વધુ હશે.
પ્રશ્ન 30.
K[Co(CO)4] માં કોબાલ્ટનો ઑક્સિડેશન આંક કેટલો છે ?
(i) +1
(ii) +3
(iii) -1
(iv) -3
ઉત્તર:
K[Co(CO)4] ⇒ x + (4 × 0) = -1
x = −1
∴ Co નો ઑક્સિડેશન આંક −1 થાય.
પ્રશ્ન 31.
નીચેનામાંથી સૌથી વધુ સ્થાયી સંકીર્ણ કર્યું છે ?
(i) [Fe(H2O)6]3+
(ii) [Fe(NH3)6]3+
(iii) [Fe(C2O4)3]3-
(iv) [FeCl6]3-
ઉત્તર:
આપેલ દરેક સંકીર્ણમાં Fe ની ઑક્સિડેશન અવસ્થા +3 છે. પરંતુ સંકીર્ણ [Fe(C2O4)3]– માં ત્રણ C2O-24 આયન છે જે કિલેટિંગ લિગેન્ડ છે. તેથી તે સૌથી વધુ સ્થાયી સંકીર્ણ છે.
પ્રશ્ન 32.
નીચેના માટે દૃશ્યમાન ગાળામાં(region) શોષણની તરંગ- લંબાઈનો સાચો ક્રમ શું હશે ?
[Ni(NO2)6]4-, [Ni(NH3)6]2+, [Ni(H2O)6]2+
ઉત્તર:
- આપેલ દરેક સંકીર્ણમાં Ni+2, આયન છે.
- સ્પેક્ટ્રૉકેમિકલ શ્રેણી મુજબ લિગેન્ડના પ્રબળક્ષેત્રમાં થતા વધારાનો ક્રમ : H2O < NH3 < NO2
- તેથી શોષાયેલી ઊર્જાનો ક્રમ :
[Ni(H2O)6]+2 < [Ni(NH3)6]+2 < [Ni(NO2)6]-4
E = \(\frac{\mathrm{hc}}{\lambda}\)
∴ E α \(\frac{1}{\lambda}\) - શોષાયેલી ઊર્જા અને તરંગલંબાઈ એકબીજાના વ્યસ્ત પ્રમાણમાં છે.
તેથી શોષણની તરંગલંબાઈનો ક્રમ :
[Ni(H2O)6]+2 > [Ni(NH3)6]+2 > [Ni(NO2)6]-4
![]()
GSEB Class 12 Chemistry સવર્ગ સંયોજનો NCERT Exemplar Questions and Answers
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-I)
પ્રશ્ન 1.
Cu+2 આયન વડે બનતા સંકીર્ણમાં નીચેનામાંથી કો સૌથી વધુ સ્થાયી છે ?

જવાબ

જેના log K નું મૂલ્ય વધુ તેની સ્થાયિતા વધુ. Cu+2 + 4CN– ![]() [Cu(CN)4]2 માટે log K = 27.3 નું મૂલ્ય સૌથી વધુ છે. તેથી K નું મૂલ્ય પણ સૌથી વધુ છે.
[Cu(CN)4]2 માટે log K = 27.3 નું મૂલ્ય સૌથી વધુ છે. તેથી K નું મૂલ્ય પણ સૌથી વધુ છે.
પ્રશ્ન 2.
સવર્ગ સંયોજનોનો રંગ સ્ફટિકક્ષેત્ર વિપાટન ઉપર આધાર રાખે છે. સંકીર્ણો [Co(NH3)6]3+, [Co(CN)6]3-, [Co(H2O)]3+ માટે દૃશ્યમાન વિભાગમાં અવશોષાતા
પ્રકાશની તરંગલંબાઈ માટે નીચેનામાંથી કયો ક્રમ સાચો છે ?
(A) [Co(CN)6]3- > [Co(NH3)6]3+ > [Co(H2O)6]3+
(B) [Co(NH3)6]3+ > [Co(H2O)6]3+ > [Co(CN)6]3-
(C) [Co(H2O)6]3+ > [Co(NH3)6]3+ > [Co(CN)6]3-
(D) [Co(CN)6]3- > [Co(NH3)6]3+ > [Co(H2O)6]3+
જવાબ
(C) [Co(H2O)6]3+ > [Co(NH3)6]3+ > [Co(CN)6]3-
- નિર્બળક્ષેત્ર લિગેન્ડ કરતાં પ્રબળક્ષેત્ર લિગેન્ડ પાંચ સમશક્તિક d-કક્ષકોનું વધુ વિભાજન કરે છે.
- લિગેન્ડની પ્રબળતા જેમ વધે તેમ સ્ફટિકક્ષેત્ર વિપાટનની ઊર્જા વધે છે.
ΔΕ = \(\frac{\mathrm{hc}}{\lambda}\) ∴ ΔE α \(\frac{1}{\lambda}\) - આથી, જેમ લિગેન્ડની પ્રબળતા વધે તેમ ΔE (વિપાટન ઊર્જા) વધે અને તરંગલંબાઈ ઘટે.
- તેથી [Co(H2O)6]3+ > [Co(NH3)6]3+ > [Co(CN)6]3-
પ્રશ્ન 3.
0.1 મોલ CoCl3(NH3)5 ની પ્રક્રિયા વધુ પ્રમાણમાં AgNO3 સાથે કરતા 0.2 મોલ AgCl મળે છે, તો દ્રાવણની વાહકતા …………………….. ને સંબંધિત છે.
(A) 1 : 3 વિદ્યુતવિભાજ્ય
(B) 1 : 2 વિદ્યુતવિભાજ્ય
(C) 1 : 1 વિદ્યુતવિભાજ્ય
(D) 3 : 1 વિદ્યુતવિભાજ્ય
જવાબ
(B) 1 : 2 વિદ્યુતવિભાજ્ય
- એક મોલ AgNO3 એ એક મોલ ક્લોરિન આયનનું અવક્ષેપન કરે છે. ઉપરની પ્રક્રિયામાં જ્યારે 0.1 મોલ CoCl3(NH3)5
- વધુ પ્રમાણમાં AgNO3 સાથે પ્રક્રિયા કરે ત્યારે 0.2 મોલ AgCl પ્રાપ્ત થાય છે. જે દર્શાવે છે કે વિદ્યુતવિભાજ્યના દ્રાવણમાં બે મુક્ત Cl– આયન હોવા જોઈએ.
- તેથી સંકીર્ણની રચના……
[Co(NH3)5Cl]Cl2 → [Co(NH3)5Cl]+2(aq) + 2Cl–(aq) - તેથી દ્રાવણમાં એક [Co(NH3)5Cl]+2 અને બે Cl– હોવો જોઈએ. આથી વિકલ્પ (B) યોગ્ય છે.
પ્રશ્ન 4.
જ્યારે 1 મોલ CrCl3 · 6H2O ની પ્રક્રિયા વધુ પ્રમાણમાં AgNO3 સાથે કરવામાં આવે ત્યારે 3 મોલ AgCl મળે છે. તો સંકીર્ણનું સૂત્ર ……………… છે.
(A) [CrCl3(H2O)3] · 3H2O
(B) [CrCl2(H2O)4]Cl · 2H2O
(C) (CrCl . (H2O)5]Cl2 · H2O
(D) [Cr(H2O)6]Cl3
જવાબ
(D) [Cr(H2O)6]Cl3
1 મોલ AgNO3 એ 1 મોલ Cl– આયનનું અવક્ષેપન કરે છે. અહીં, વધુ પ્રમાણમાં AgNO3 ઉમેરતાં 3 મોલ AgCl પ્રાપ્ત થાય છે. તેથી તેમાં ત્રણ મુક્ત Cl– આયન હોવા જોઈએ.
પ્રશ્ન 5.
[Pt(NH3)2 Cl2] નું સાચું IUPAC નામ છે.
(A) ડાયએમ્માઇનડાયક્લોરાઇડોપ્લેટિનમ(II)
(B) ડાયએમ્માઇનડાયક્લોરાઇડોપ્લેટિનમ(IV)
(C) ડાયએમ્માઇનડાયક્લોરાઇડોપ્લેટિનમ(0)
(D) ડાયક્લોરાઇડોડાયએમ્માઇનપ્લેટિનમ(IV)
જવાબ
(A) ડાયએમ્માઇનડાયક્લોરાઇડોપ્લેટિનમ(II)
- અહીં, NH3 તટસ્થ અને Cl– એ ઋણ આયન લિગેન્ડ હોવાથી Pt નો ઑક્સિડેશન આંક +2 થાય.
- તેથી [Pt(NH3)2Cl2] નું IUPAC નામ ડાયએમ્માઇનડાયક્લોરાઇડોપ્લેટિનમ (II)
પ્રશ્ન 6.
સવર્ગ સંયોજનોની સ્થિરતા કિલેટ અસર (Chelation)ના કારણે છે જેને કિલેટ અસર કહે છે. નીચેનામાંથી કઈ સંકીર્ણ સ્પિસીઝ સૌથી વધુ સ્થાયી છે ?
(A) [Fe(CO)5]
(B) [Fe(CN)6]3-
(C) [Fe(C2O4)3]3-
(D) [Fe(H2O)6]3+
જવાબ
(C) [Fe(C2O4)3]3-
જે લિગેન્ડ ચક્રિય રચના બનાવે તેને લેિટિંગ લિગેન્ડ કહે છે. અહીં, માત્ર [Fe(C2O4)3]3- માં રહેલો ઑક્ઝેલેટ આયન કિલેટિંગ લિગેન્ડ છે. તેથી તે સૌથી વધુ સ્થાયી છે.
![]()
પ્રશ્ન 7.
ભૌમિતિક સમઘટકતા ધરાવતો સંકીર્ણ આયન દર્શાવો.
(A) [Cr(H2O)4 Cl2]+
(B) [Pt(NH3)3 Cl]
(C) [Co(NH3)6]3+
(D) [Co(CN)5(NC)]3-
જવાબ
(A) [Cr(H2O)4 Cl2]+
(A) [Cr(H2O)4 Cl2]+ એ MA4B2 પ્રકારનું સવર્ગ સંયોજન છે. તેથી સિસ-ટ્રાન્સ સમઘટકતા ધરાવે છે.
પ્રશ્ન 8.
અષ્ટાકીય [CoCl6]4- માટે CFSE 18,000 cm-1 છે, તો સમચતુલકીય [CoCl4]2- માટે CFSE …………………. હશે.
(A) 18,000 cm-1
(B) 16,000 cm-1
(C) 8,000 cm-1
(D) 20,000 cm-1
જવાબ
(C) 8,000 cm-1
Δt = \(\frac{4}{9}\) Δ0
Δ0 = અષ્ટફલકીય સંકીર્ણ માટે CFSE
Δt = ચતુલકીય સંકીર્ણ માટે CFSE
Δt = \(\frac{4}{9}\) × 18000
= 4 × 2000 = 8,000 cm-1
પ્રશ્ન 9.
ઉભયદંતીય (ambidentate) લિગેન્ડની હાજરીને કારણે સવર્ગ સંયોજનો સમઘટકતા દર્શાવે છે. [Pd(C6H5)2 (SCN)2] અને [Pd(C6H5)2(NCS)2] પ્રકારના પેલેડિયમના
સંકીર્ણો ………………….. છે.
(A) બંધન સમઘટકો
(B) સવર્ગ સમઘટકો
(C) આયનીકરણ સમઘટકો
(D) ભૌમિતિક સમઘટકો
જવાબ
(A) બંધન સમઘટકો
અહીં, NCS (થાયોસાયનેટ) આયન બે જુદા જુદા દાતા પરમાણુ ધરાવે છે. તેથી NCS એ ઉભયદંતીય લિગેન્ડ છે. જે બંધન સમઘટકતા ધરાવે છે.
પ્રશ્ન 10.
સંયોજનો [Co(SO4)(NH3)5]Br અને [Co(SO4)
(NH3)5]Cl …………………… દર્શાવે છે.
(A) બંધન સમઘટકતા
(B) આયનીકરણ સમઘટકતા
(C) સવર્ગ સમઘટકતા
(D) સમઘટકતા નથી.
જવાબ
(D) સમઘટકતા નથી.
અહીં, આપેલ સવર્ગ સંયોજનોમાં અણુસૂત્ર સમાન નથી. તેથી તેમાં સમઘટકતા જોવા મળશે નહીં.
પ્રશ્ન 11.
કિલેટ કર્તા ધાતુ આયન સાથે જોડાવા માટે બે કે બેથી વધુ દાતા પરમાણુ ધરાવે છે. નીચેનામાંથી કયો કિલેટ કર્તા નથી ?
(A) થાયોસલ્ફેટો
(B) ઑક્ઝેલેટો
(C) ગ્લાયસિનેટો
(D) ઇથેન-1, 2-ડાયએમાઇન
જવાબ
(A) થાયોસલ્ફેટો
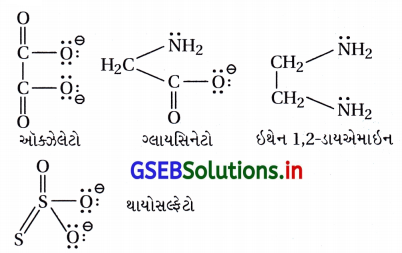
થાયોસલ્ફેટો કિલેટ લિગેન્ડ નથી. કારણ કે તે ભૌમિતિક રીતે એક ધાતુ આયન સાથે જોડાઈ શકતો નથી.
પ્રશ્ન 12.
નીચેનામાંથી કઈ સ્પિસીઝ લિગેન્ડ તરીકે અપેક્ષિત નથી ?
(A) NO
(B) NH+4
(C) NH2CH2CH2NH2
(D) CO
જવાબ
(B) NH+4
લિગેન્ડ પાસે ધાતુ પરમાણુને દાન કરવા માટે ઇલેક્ટ્રૉનયુગ્મ હોવા જોઈએ.
ઉદા., 
જ્યારે NH+4 પાસે ઇલેક્ટ્રૉનયુગ્મ નથી. તેથી તે લિગેન્ડ નથી.
![]()
પ્રશ્ન 13.
[Cr(H2O)6]Cl3 (જાંબલી) અને [Cr(H2O)5 Cl] Cl2 . H2O (રાખોડી લીલો) વચ્ચે કયા પ્રકારની સમઘટકતા અસ્તિત્વ ધરાવે છે ?
(A) બંધન સમઘટકતા
(B) દ્રાવક મિશ્રણ સમઘટકતા
(C) આયનીકરણ સમઘટકતા
(D) સવર્ગ સમઘટકતા
જવાબ
(B) દ્રાવક મિશ્રણ સમઘટકતા
દ્રાવક મિશ્રણ સમઘટકો સ્ફટિક લૅટિસમાં દ્રાવકના અણુઓ સીધા જ ધાતુ આયન સાથે બંધિત થાય છે અથવા માત્ર મુક્ત દ્રાવક અણુ તરીકે હાજર હોય છે. તેના આધારે અલગ પડે છે.
પ્રશ્ન 14.
[Pt(NH3)2Cl(NO2) નું IUPAC નામ ………………. છે.
(A) પ્લેટિનમડાયએમ્માઇનક્લોરોનાઇટ્રાઇટ
(B) ક્લોરોનાઇટ્રાઇટો-N-એમ્માઇનપ્લેટિનમ(II)
(C) ડાયએમ્માઇનક્લોરાઇડોનાઇટ્રાઇટો-N-પ્લેટિનમ(II)
(D) ડાયએમ્માઇનક્લોરોનાઇટ્રાઇટો-N-પ્લેટિનેટ(II)
જવાબ
(C) ડાયએમ્માઇનક્લોરાઇડોનાઇટ્રાઇટો-N-પ્લેટિનમ(II)
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-II)
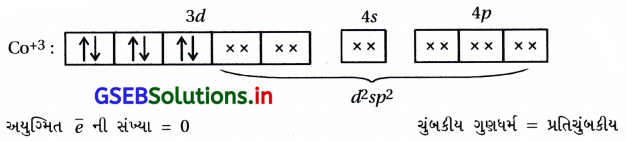
પ્રશ્ન 1.
Mn, Fe અને Co ના પરમાણ્વીયક્રમાંક અનુક્રમે 25, 26 અને 27 છે. નીચેનામાંથી કયા આંતર (inner) કક્ષકીય અષ્ટફલકીય
સંકીર્ણ આયન પ્રતિચુંબકીય છે ?
(A) [Co(NH3)6]+3
(B) [Mn(CN)6]-3
(C) [Fe(CN)6]-4
(D) [Fe(CN)6]-3
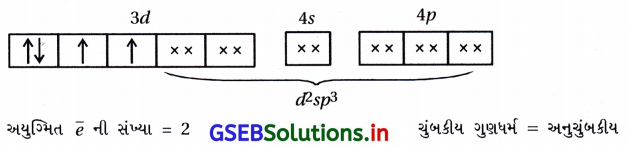
જવાબ
(A), (C)
- [Co(NH3)6]+3 માં Co+3 છે.
- [Mn(CN)6]-3 માં Mn+3 છે.
- [Fe(CN)6]-4 માં Fe+2 છે.
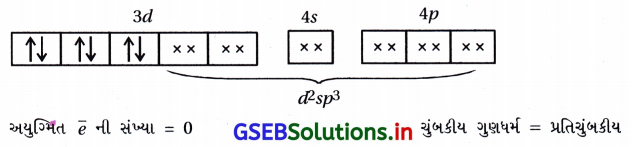
- [Fe(CN)6]-3 માં Fe+3 છે.
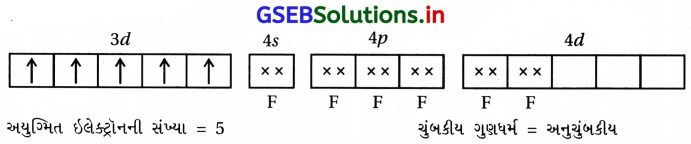
પ્રશ્ન 2.
Mn, Fe, Co અને Ni ના પરમાણ્વીયક્રમાંક અનુક્રમે 25, 26, 27 અને 28 છે. નીચેનામાંથી કયા બાહ્ય કક્ષકીય અષ્ટફલકીય સંકીર્ણ આયનોમાં સમાન સંખ્યામાં અયુમ્મિત ઇલેક્ટ્રૉન છે ?
(A) [MnCl6]3-
(B) [FeF6]-3
(C) [CoF6]-3
(D) [Ni(NH3)6]+2
જવાબ
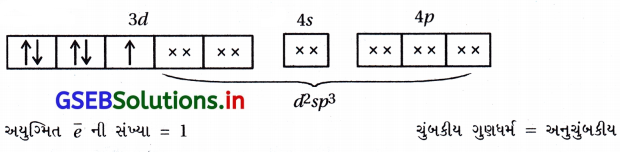
(A), (C)
- [MnCl6]-3 માં Mn+3
- [CoF6]-3 માં Co+3
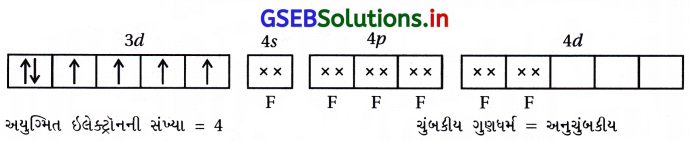
- [Ni(NH3)6]+22 માં Ni+2
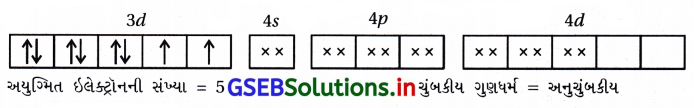
- [FeF6]-3 માં Fe+3
પ્રશ્ન 3.
[Fe(CN)6]-3 સંકીર્ણ માટે નીચેનામાંથી કયા વિકલ્પો સાચા છે ?
(A) d2sp3 સંકરણ
(B) sp3d2 સંકરણ
(C) અનુચુંબકીય
(D) પ્રતિચુંબકીય
જવાબ
(A), (C)
[Fe(CN)6]-3 માં Fe+3

પ્રશ્ન 4.
કોબાલ્ટ(II) ક્લોરાઇડનું ગુલાબી રંગના જલીય દ્રાવણમાં વધુ પ્રમાણમાં HCl ઉમેરતા ઘેરા વાદળી રંગનું બને છે. કારણ કે……….
(A) [Co(H2O)6]+2 એ [CoCl6]-4માં પરિવર્તન થાય છે.
(B) [Co(H2O)6]+2 એ [CoCl4]-2 માં પરિવર્તન થાય છે.
(C) અષ્ટફલકીય સંકીર્ણોની સરખામણીમાં ચતુષ્કલકીય સંકીર્ણોમાં સ્ફટિકક્ષેત્ર વિભાજન ઓછું હોય છે.
(D) અષ્ટફલકીય સંકીર્ણોની સરખામણીમાં ચતુલકીય સંકીર્ણોમાં સ્ફટિકક્ષેત્ર વિભાજન વધુ છે.
જવાબ
(B), (C)
કોબાલ્ટ(II) ક્લોરાઇડના ગુલાબી જલીય દ્રાવણમાં વધુ પ્રમાણમાં HCl ઉમેરવામાં આવે ત્યારે \(\bar{e}\) નું સંક્રમણ t29 માંથી eg ઊર્જાસ્તરમાં થઈ [Co(H2O)6]+2 સંકીર્ણ બને છે.
(i) [Co(H2O)6]+2 એ [CoCl4]-2 માં ફેરવાય છે.
(ii) સમચતુલકીય સંકીર્ણ અને અષ્ટફલકીય સંકીર્ણ વચ્ચેનો
સંબંધ Δt = \(\frac{4}{9}\)Δ0
પ્રશ્ન 5.
નીચેનામાંથી કયા સંકીર્ણો હોમોલેપ્ટિક છે ?
(A) [Co(NH3)6]3+
(B) [Co(NH3)4 Cl2]+
(C) [Ni(CN)4]2-
(D) [Ni(NH3)4 Cl2]
જવાબ
(A), (C)
જે સંકીર્ણમાં ફક્ત એક જ પ્રકારના લિગેન્ડ આવેલ હોય તેને
હોમોલેપ્ટિક સંકીર્ણ કહે છે.
ઉદા., [Co(NH3)6]3+, [Ni(CN)4]2-
![]()
પ્રશ્ન 6.
નીચેનામાંથી કયા સંકીર્ણો હીટરોલેપ્ટિક છે ?
(A) [Cr(NH3)6]+3
(B) [Fe(NH3)4 Cl2]+
(C) [Mn(CN)6]4-
(D) [Co(NH3)4 Cl2]
જવાબ
(B), (D)
સંકીર્ણ જેમાં ધાતુ એક પ્રકાર કરતાં વધારે પ્રકારના દાતા સમૂહ સાથે બંધિત હોય છે. તેને હીટરોલેપ્ટિક સંકીર્ણ કહે છે.
ઉદા., [Fe(NH3)4 Cl2]+,[Co(NH3)4 Cl2]
પ્રશ્ન 7.
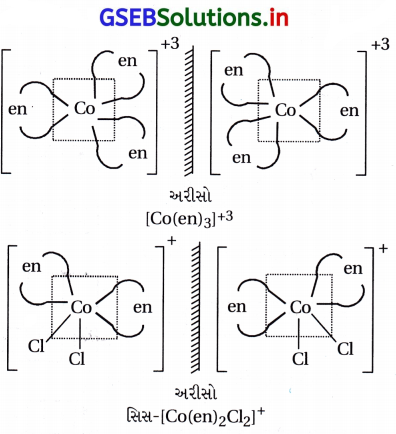
નીચેનામાંથી પ્રકાશક્રિયાશીલ સંયોજનોને ઓળખો :
(A) [Co(en)3]3+
(B) ટ્રાન્સ-(Co(en)2Cl2]+
(C) સિસ-[Co(en)2Cl2]+
(D) [Cr(NH3)5 Cl]
જવાબ
(A), (C)
[Co(en)3]3+ અને સિસ-[Co(en)2Cl2]+ એ પ્રકાશીય રીતે સક્રિય સંયોજન છે. કારણ કે તેમના પ્રતિબિંબ એકબીજા ઉપર અધ્યારોપિત થતા નથી.
પ્રશ્ન 8.
ઇથેન-1, 2-ડાયએમાઇન લિગેન્ડ માટે નીચેનામાંથી સાચાં
વિધાનો ઓળખો :
(A) તે તટસ્થ લિગેન્ડ છે.
(B) તે દ્વિદંતીય લિગેન્ડ છે.
(C) તે કિલેટિંગ લિગેન્ડ છે.
(D) તે એકદંતીય લિગેન્ડ છે.
જવાબ
(A), (B), (C)
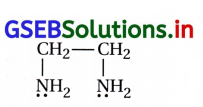
– વીજભાર નથી.
આથી તટસ્થ લિગેન્ડ છે.
– એમિનો સમૂહના બે N પરમાણુ \(\bar{e}\) યુગ્મનું દાન કરે છે. તેથી તે દ્વિદંતીય લિગેન્ડ છે.
– તે ધાતુ સાથે ચક્રિય રચના બનાવે છે. તેથી તે કિલેટિંગ લિગેન્ડ છે.
પ્રશ્ન 9.
નીચેનામાંથી કયા સંકીર્ણે બંધન સમઘટકતા દર્શાવ છે ?
(A) [Co(NH3)5(NO2)]2+
(B) [Co(H2O)5 CO]3+
(C) [Cr(NH3)5 SCN]2+
(D) [Fe(en)2 Cl2]+
જવાબ
(A), (C)
– ઉભયદંતી લિગેન્ડ એ લિંકેજ સમઘટકતા ધરાવે છે.
– [Co(NH3)5(NO2)]2+ માં NO2 એ ધાતુ સાથે N અથવા ઑક્સિજન દ્વારા સવર્ગ બનાવી શકે છે.
– [Cr(NH3)5 SCN]2+ માં SCN એ ધાતુ સાથે N અથવા S મારફતે સવર્ગ સંયોજન બનાવી શકે છે. આથી તે લિંકેજ સમઘટકતા ધરાવે છે.
![]()
ટૂંક જવાબી પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
નીચેના સંકીર્ણોને તેમનાં દ્રાવણોની વાહકતાના ચડતા ક્રમમાં ગોઠવો :
[Co(NH3)3 Cl3],
[Co(NH3)4] Cl2]Cl,
[Co(NH3)6 Cl3,
[Cr(NH3)5 Cl]Cl2
ઉત્તર:
જે સંવર્ગ સંયોજન દ્રાવણમાં વધુ આયનો આપે તેની વાહકતા વધુ હોય છે.

પ્રશ્ન 2.
સવર્ગ સંયોજન CrCl3 · 4H2O ની પ્રક્રિયા સિલ્વર નાઇટ્રેટ સાથે કરતા સિલ્વર ક્લોરાઇડના અવક્ષેપ મળે છે. તેના દ્રાવણની મોલર વાહકતા બંને આયનોની કુલ સંખ્યા ઉપર આધાર રાખે છે. સંયોજનનું બંધારણીય સૂત્ર અને નામ લખો.
ઉત્તર:
દ્રાવણમાં બે આયનો મળે છે. તેથી એક જ Cl– એ સંકીર્ણની બહારની બાજુ હોવો જોઈએ.
સંકીર્ણનું અણુસૂત્ર : [Co(H2O)4Cl2]Cl
IUPAC નામ : ટેટ્રાએક્વાડાયક્લોરાઇડોકોબાલ્ટ(III)ક્લોરાઇડ
પ્રશ્ન 3.
[M(AA)2X2]n+ પ્રકારનો સંકીર્ણ પ્રકાશક્રિયાશીલ છે. સંકીર્ણના બંધારણ બાબતે આ શું સૂચવે છે ? આવા એક સંકીર્ણનું ઉદાહરણ આપો.
ઉત્તર:
- [M(AA)2X2]n+ સંકીર્ણ પ્રકાશક્રિયાશીલ છે, જે સિસ- અષ્ટફલકીય બંધારણ ધરાવે છે. ઉદા., સિસ-[Pt(en)2Cl2]+2
- તેમના પ્રતિબિંબ એકબીજા ઉપર અધ્યારોપિત થતા નથી.
પ્રશ્ન 4.
કારણ આપી સમજાવો : “[MnCl4]-2 ની ચુંબકીય ચાકમાત્રા 5.92 BM છે.”
ઉત્તર:
[MnCl4]-2 માં Mn+2 એ પાંચ અયુગ્મિત \(\bar{e}\) ધરાવે છે તેથી sp3 સંકરણ થઈ સંકીર્ણ સમચતુલકીય રચના ધરાવે છે અને સંકીર્ણ 5.92 BM ચુંબકીય ચાકમાત્રા ધરાવે છે.
પ્રશ્ન 5.
સ્ફટિક્ષેત્ર વાદના આધારે સમજાવો કે શા માટે Co (III) નિર્બળક્ષેત્ર લિગેન્ડ સાથે અનુચુંબકીય અષ્ટફલકીય સંકીર્ણ બનાવે છે જ્યારે પ્રબળક્ષેત્ર લિગેન્ડ સાથે પ્રતિચુંબકીય અષ્ટલકીય સંકીર્ણ બનાવે છે.
ઉત્તર:
- નિર્બળક્ષેત્ર લિગેન્ડ સાથે Δ0 < P (યુગ્મીકરણ ઊર્જા) તેથી Co(III)ની ઇલેક્ટ્રૉન રચના \(\mathrm{t}_{2 \mathrm{~g}}^4 \mathrm{e}_{\mathrm{g}}^2\) અયુગ્મિત \(\bar{e}\) હોવાથી તે અનુચુંબકીય ગુણ ધરાવે છે.
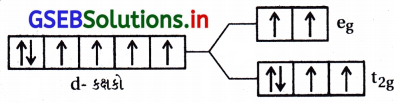
- પ્રબળક્ષેત્ર લિગેન્ડ સાથે Δ0 > P છે. તેથી Co(III) ની \(\bar{e}\) રચના \(\) થશે. તેથી તેમાં એકપણ અયુમ્મિત \(\bar{e}\) નથી અને તે પ્રતિચુંબકીય ગુણ ધરાવે છે.
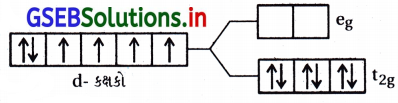
![]()
પ્રશ્ન 6.
શા માટે નીચી સ્પિન ધરાવતા સમચતુલકીય સંકીર્ણો બનતા નથી ?
ઉત્તર:
સમચતુલકીય સંકીર્ણમાં અષ્ટફલકીયની સરખામણીમાં ઓછું વિભાજન થાય છે. સમાન ધાતુ અને સમાન લિગેન્ડ માટે, Δt = (\(\frac{4}{9}\)) Δ0 દર્શાવી શકાય છે. પરિણામે, કલકીય વિપાટન (વિભાજન) ઊર્જાઓ વધુ યુગ્મનને દબાણ કરવા માટે પૂરતી હોતી નથી અને તેથી નિમ્ન ભ્રમણ સંરચના ભાગ્યે જ જોવા મળે છે.
પ્રશ્ન 7.
સ્ફટિકક્ષેત્ર વિપાટન વાદના આધારે નીચે આપેલ સંકીર્ણોની ઇલેક્ટ્રોનીય રચના આપો.
[CoF6]3-, [Fe(CN)6]4- અને [Cu(NH3)6]2+
ઉત્તર:
- સ્પેક્ટ્રૉકેમિકલ શ્રેણીના આધારે લિગેન્ડની પ્રબળતામાં થતા વધારાનો ક્રમ : F– < NH3 < CN–
- તેથી, CN– અને NH3 પ્રબળ લિગેન્ડ હોવાથી t29 માં યુગ્મીકરણ થશે.
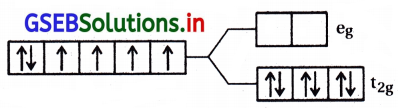
[CoF6]-3; Co+3 = (d6) \(\mathrm{t}_{2 \mathrm{~g}}^4 \mathrm{e}_{\mathrm{g}}^2\)
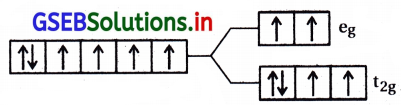
[Fe(CN)6]-4; Fe+2 = (d6) \(\mathrm{t}_{2 \mathrm{~g}}^4 \mathrm{e}_{\mathrm{g}}^0\)
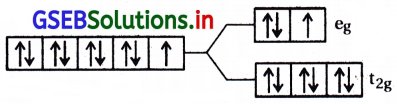
[Cu(NH3)6]+2; Cu+2 = (d9) \(t_{2 g}^6 e_g^3\)
પ્રશ્ન 8.
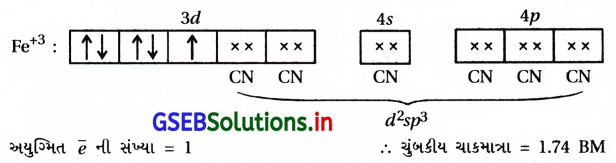
સમજાવો : શા માટે [Fe(H2O)6]3+ ની ચુંબકીય ચાકમાત્રાનું મૂલ્ય 5.92 BM છે જ્યારે [Fe(CN)6]3- નું મૂલ્ય માત્ર 1.74 BM છે ?
ઉત્તર:
- [Fe(CN6)]-3 માં CN– એ પ્રબળ લિગેન્ડ હોવાથી Fe+3 માં રહેલા ચોથા ઇલેક્ટ્રૉનનું યુગ્મીકરણ થઈ d2sp3 સંકરણ થશે.
- [Fe(H2O)6]3+ માં H2O એ નિર્બળ લિગેન્ડ હોવાથી Fe+3 માં રહેલા \(\bar{e}\) નું યુગ્મીકરણ થશે નહીં અને sp3d2 સંકરણ થશે.
પ્રશ્ન 9.
નીચેના સંકીર્ણ આયનોને સ્ફટિકક્ષેત્ર વિપાટન ઊર્જા (Δ0) ના ચડતા ક્રમમાં ગોઠવો.
[CrCl6]3-, [Cr(CN)6]3-, [Cr(NH3)6]3+
ઉત્તર:
જે સંકીર્ણ સંયોજન પ્રબળક્ષેત્ર લિગેન્ડ ધરાવે તેની સ્ફટિકક્ષેત્ર વિપાટન ઊર્જા વધારે હોય છે.
તેથી CFSE નો ચડતો ક્રમ : [CrCl6]-3 < [Cr(NH3)6]+3 < [Cr(CN)6]-3,
કારણ કે લિગેન્ડની પ્રબળતાનો ક્રમ : Cl– < NH3 < CN– છે.
પ્રશ્ન 10.
સમાન ભૂમિતિ ધરાવતાં સંયોજનો શા માટે ભિન્ન ચુંબકીય ચાકમાત્રા ધરાવે છે ?
ઉત્તર:
- ચુંબકીય ચાકમાત્રા એ સંકીર્ણમાં રહેલા લિગેન્ડની પ્રબળતા ૫૨ આધાર રાખે છે. જો CFSE વધારે હોય તો તે નીચા મૂલ્ય ધરાવતી ચુંબકીય ચાકમાત્રા ધરાવે છે. ઉદા., [Co(NH3)6]+3 તે પ્રતિચુંબકીય બને છે કારણ કે NH3 પ્રબળક્ષેત્ર લિગેન્ડ છે.
- જો CFSE ઓછી હોય તો ઊંચા મૂલ્ય ધરાવતી ચુંબકીય ચાકમાત્રા ધરાવે છે. ઉદા., [CoF6]-3 તે અનુચુંબકીય બને છે કારણ કે F– એ નિર્બળક્ષેત્ર લિગેન્ડ છે.
- [CoF6]-3 અને [Co(NH3)6]+3 બંનેની ભૌમિતિક રચના સમાન છે.
![]()
પ્રશ્ન 11.
શા માટે CuSO4 · 5H2O વાદળી રંગનો છે જ્યારે CuSO4 રંગવિહીન છે ?
ઉત્તર:
- CuSO4 · 5H2O માં H2O એ લિગેન્ડ તરીકે વર્તે છે અને સ્ફટિકક્ષેત્ર વિપાટન શક્ય બને છે. તેથી d – d સંક્રાંતિ અનુભવી CuSO4 · 5H2O વાદળી રંગ ધરાવે છે.
- જ્યારે નિર્જળ CuSO4 માં H2O હાજર નથી. તેથી તેમાં સ્ફટિકક્ષેત્ર વિપાટન શક્ય નથી. તેથી CuSO4 રંગવિહીન છે.
પ્રશ્ન 12.
જ્યારે ઉભયદંતીય (ambidentate) લિગેન્ડ મધ્યસ્થ ધાતુ આયન સાથે જોડાય ત્યારે જોવા મળતી સમઘટકતાનું નામ આપો. ઉભયદંતીય લિગેન્ડનાં બે ઉદાહરણ આપો.
ઉત્તર:
- લિગેન્ડ કે જે બે જુદાજુદા દાતા પરમાણુઓ ધરાવે છે તથા તે પૈકીના કોઈ એક દાતા પરમાણુ વડે સંકીર્ણમાં લિગેન્ડ જોડાય છે. તેને ઉભયદંતી લિગેન્ડ કહે છે. ઉદા., SCN– એ સલ્ફર અને નાઇટ્રોજન મારફતે સવર્ગ સંયોજન બનાવી શકે છે.
- ઉભયદંતીય લિગેન્ડ ધરાવતા સંકીર્ણ સંયોજનોમાં લિંકેજ સમઘટકતા જોવા મળે છે. ઉદા., (i) [Co(NH3)5 SCN]+3 (ii) [Fe(NH3)5 (NO2)]+3
જોડકાં પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
કૉલમ – Iમાં આપેલા સંકીર્ણ ક્ષારોને કૉલમ – IIમાં આપેલ તેમના રંગ સાથે જોડો.
| કૉલમ – I | કૉલમ – II |
| (A) [Co(NH3)6]3+ | (i) જાંબલી |
| (B) [Ti(H2O)6]3+ | (ii) લીલો |
| (C) [Ni(H2O)6]2+ | (iii) ઝાંખો વાદળી |
| (D) [Ni(H2O)4(en)+2(aq) | (iv) પીળાશ પડતો કેસરી |
| (v) વાદળી |
(a) (A – i) (B – ii) (C – iv) (D – v)
(b) (A – iv) (B – iii) (C – ii) (D – i)
(c) (A – iii) (B – ii) (C – iv) (D – i)
(d) (A – iv) (B – i) (C – ii) (D – iii)
જવાબ
(b) (A – iv) (B – iii) (C – ii) (D – i)
| કૉલમ – I | કૉલમ – II |
| (A) [Co(NH3)6]3+ | (iv) પીળાશ પડતો કેસરી |
| (B) [Ti(H2O)6]3+ | (iii) ઝાંખો વાદળી |
| (C) [Ni(H2O)6]2+ | (ii) લીલો |
| (D) [Ni(H2O)4(en)+2(aq) | (i) જાંબલી |
પ્રશ્ન 2.
કોલમ – Iમાં આપેલાં સવર્ગ સંયોજનોને કૉલમ – IIમાં આપેલ ધાતુ પરમાણુ સાથે જોડીને સાચો વિકલ્પ પસંદ કરો.
| કોલમ – I (સવર્ગ સંયોજનો) | કૉલમ – II (કેન્દ્રસ્થ ધાતુ પરમાણુ) |
| (A) ક્લોરોફિલ | (i) રોડિયમ |
| (B) લોહીનો વર્ણક | (ii) કોબાલ્ટ |
| (C) વિલકિનસન ઉદ્દીપક | (iii) કેલ્શિયમ |
| (D) વિટામિન B12 | (iv) આયર્ન |
| (v) મેગ્નેશિયમ |
(a) (A – v) (B – iv) (C – i) (D – ii)
(b) (A – iii) (B – iv) (C – v) (D – i)
(c) (A – iv) (B – iii) (C – ii) (D – i)
(d) (A – iii) (B – iv) (C – i) (D – ii)
જવાબ
(a) (A – v) (B – iv) (C – i) (D – ii)
| કોલમ – I (સવર્ગ સંયોજનો) | કૉલમ – II (કેન્દ્રસ્થ ધાતુ પરમાણુ) |
| (A) ક્લોરોફિલ | (v) મેગ્નેશિયમ |
| (B) લોહીનો વર્ણક | (iv) આયર્ન |
| (C) વિલકિનસન ઉદ્દીપક | (i) રોડિયમ |
| (D) વિટામિન B12 | (ii) કોબાલ્ટ |
પ્રશ્ન 3.
કોલમ – Iમાં આપેલાં સંકીર્ણ આયનોને કૉલમ – IIમાં આપેલા સંકરણ અને અયુગ્મિત ઇલેક્ટ્રોન સાથે જોડીને સાચો વિકલ્પ પસંદ કરો.
| કૉલમ – I (સંકીર્ણ આયન) | કૉલમ – II (સંકરણ, અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યા) |
| (A) [Cr(H2O)6]3+ | (i) dsp2, 1 |
| (B) [Co(CN)4]2- | (ii) sp3d2, 5 |
| (C) [Ni(NH3)6]2+ | (iii) d2sp3, 3 |
| (D) [MnF6]4- | (iv) sp3, 4 |
| (v) sp3d2, 2 |
(a) (A – iii) (B – i) (C – v) (D – ii)
(b) (A – iv) (B – iii) (C – ii) (D – i)
(c) (Aiii) (B – ii) (C – iv) (D – i)
(d) (A – iv) (B – i) (C – ii) (D – iii)
જવાબ
(b) (A – iv) (B – iii) (C – ii) (D – i)
| કૉલમ – I (સંકીર્ણ આયન) | કૉલમ – II (સંકરણ, અયુગ્મિત ઇલેક્ટ્રૉનની સંખ્યા) |
| (A) [Cr(H2O)6]3+ | (iv) sp3, 4 |
| (B) [Co(CN)4]2- | (iii) d2sp3, 3 |
| (C) [Ni(NH3)6]2+ | (ii) sp3d2, 5 |
| (D) [MnF6]4- | (i) dsp2, 1 |
![]()
પ્રશ્ન 4.
કૉલમ – Iમાં આપેલ સંકીર્ણ સ્પિસીઝને કોલમ – IIમાં રહેલા સમઘટકતા સાથે યોગ્ય ક્રમમાં જોડો ઃ
| કૉલમ – I (સંકીર્ણ સ્વિસીઝ) | કોલમ – II (સમઘટકતા) |
| (A) [Co(NH3)4Cl2]+ | (i) પ્રકાશીય |
| (B) સિસ- [Co(en)2Cl2]+ | (ii) આયનીકરણ |
| (C) [Co(NH3)5(NO2)] Cl2 | (iii) સવર્ગ |
| (D) [Co(NH3)6] [Cr(CN)6] | (iv) ભૌમિતિક |
| (v) બંધન |
(a) (A – i) (B – ii) (C – iv) (D – v)
(b) (A – iv) (B – iii) (C – ii) (D – i)
(c) (A – iv) (B – i) (C – v) (D – iii)
(d) (A – iv) (B – i) (C – ii) (D – iii)
જવાબ
| કૉલમ – I (સંકીર્ણ સ્વિસીઝ) | કોલમ – II (સમઘટકતા) |
| (A) [Co(NH3)4Cl2]+ | (iv) ભૌમિતિક |
| (B) સિસ- [Co(en)2Cl2]+ | (i) પ્રકાશીય |
| (C) [Co(NH3)5(NO2)] Cl2 | (ii) આયનીકરણ |
| (D) [Co(NH3)6] [Cr(CN)6] | (iii) સવર્ગ |
(A) [Co(NH3)4Cl2]+ માં ભૌમિતિક સમઘટકતા મળે.
(B) સિસ – [Co(en)2Cl2]+ એ પ્રકાશીય સમઘટકતા ધરાવે.
(C) [Co(NH3)5(NO2)] Cl2 એ લિગેન્ડની હેરાફેરી કરવાથી આયનીકરણ સમઘટકતા મળે છે.
(D) [Co(NH3)6] [Cr(CN)6] એ સવર્ગ સમઘટકતા ધરાવે છે.
પ્રશ્ન 5.
કૉલમ – Iમાં આપેલાં સંયોજનોને કૉલમ – IIમાં આપેલ કોબાલ્ટની ઑક્સિડેશન અવસ્થા સાથે જોડો અને સાચો વિકલ્પ પસંદ કરો.
| કૉલમ – I (સંયોજન) | કૉલમ – II (C0નો ઑક્સિડેશન આંક) |
| (A) [Co(NCS)(NH3)5](SO3) | (i) +4 |
| (B) [Co(NH3)4Cl2]SO4 | (ii) 0 |
| (C) Na4[CO(S2O3)3] | (iii) +1 |
| (D) [Co2(CO)8] | (iv) +2 |
| (v) +3 |
(a) (A – i) (B – ii) (C – iv) (D – v)
(b) (A – iv) (B – iii) (C – ii) (D – i)
(c) (A – v) (B – i) (C – iv) (D – ii)
(d) (A – iv) (B – i) (C – ii) (D iii)
જવાબ
(c) (A – v) (B – i) (C – iv) (D – ii)
| કૉલમ – I (સંયોજન) | કૉલમ – II (C0નો ઑક્સિડેશન આંક) |
| (A) [Co(NCS)(NH3)5](SO3) | (v) +3 |
| (B) [Co(NH3)4Cl2]SO4 | (i) +4 |
| (C) Na4[CO(S2O3)3] | (iv) +2 |
| (D) [Co2(CO)8] | (ii) 0 |
(A) [Co(NCS)(NH3)5](SO3)
x – 1 + (5 × 0) = +2
x = +2 + 1 = +3
(B) [Co(NH3)4Cl2]SO4
x + (4 × 0) + (2 x -1) = +2
x – 2 = +2 ∴ x = +4.
(C) Na4[CO(S2O3)3]
x + 3 × (-2) = -4
x – 6 = -4 ∴ x = +2
(D) [Co2(CO)8]
x – (8 × 0) = 0
∴ x = 0
વિધાન અને કારણ
નીચેના પ્રશ્નોમાં વિધાન (A) અને ત્યાર પછી કારણ (R) આપેલું છે. પ્રશ્નોની નીચે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરો :
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે અને કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
(B) વિધાન (A) અને કારણ (B) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
(C) વિધાન (A) સાચું છે પણ કારણ (R) ખોટું છે.
(D) વિધાન (A) ખોટું છે પણ કારણ (R) સાચું છે.
પ્રશ્ન 1.
વિધાન (A) : કલેટિંગ (chelating) લિગેન્ડ વડે ઝેરી ધાતુ આયનોને દૂર કરી શકાય છે.
કારણ (R) : કિલેટ સંયોજનો વધુ સ્થાયી છે.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે અને કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
વિષકારક ધાતુના દ્રાવણમાં જ્યારે કિલેટિંગ લિગેન્ડ ઉમેરવામાં આવે ત્યારે કિલેટિંગ લિગેન્ડ ધાતુ સાથે સ્થાયી સંકીર્ણની રચના કરે છે. તેથી કિલેટિંગ લિગેન્ડ સાથે વિષકારક ધાતુ દૂર થાય છે.
![]()
પ્રશ્ન 2.
વિધાન (A) : [Cr(H2O)6]Cl2 અને [Fe(H2O)6]Cl2 રિડ્યુસિંગ પ્રકૃતિ ધરાવે છે.
કારણ (R) : તેમની d-કક્ષકોમાં અયુમ્મિત ઇલેક્ટ્રોન હાજર છે.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
[Cr(H2O)6]Cl2 અને [Fe(H2O)6]Cl2 એ રિડક્શનકર્તા છે. કારણ કે તે ટ મેળવી સ્થાયી સંકીર્ણની રચના કરે છે.
પ્રશ્ન 3.
વિધાન (A) : સવર્ગ સંયોજનોમાં ઉભયદંતીય લિગેન્ડને કારણે બંધનીય સમઘટકતા જોવા મળે છે.
કારણ (R) : ઉભયદંતીય લિગેન્ડ બે ભિન્ન દાતા પરમાણુ ધરાવે છે.
જવાબ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે અને કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
ઉભયદંતીય લિગેન્ડ બે જુદા જુદા \(\bar{e}\) દાતા પરમાણુ ધરાવે છે. તેથી તે લિંકેજ સમઘટકતા ધરાવે છે.
પ્રશ્ન 4.
વિધાન (A) : MX6 અને MX5L (X અને L એકદંતીય લિગેન્ડ) પ્રકારના સંકીર્ણો ભૌમિતિક સમઘટકતા દર્શાવતા નથી.
કારણ (R) : સવર્ણાંક 6 ધરાવતા સંકીર્ણો ભૌમિતિક સમઘટકતા દર્શાવતા નથી.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
જો સંકીર્ણ MA4B2 અથવા [M(AB)2 X2] પ્રકારના હોય તો જ તેમાં ભૌમિતિક સમઘટકતા જોવા મળે.
પ્રશ્ન 5.
વિધાન (A) : [Fe(CN6)]3- આયન બે અયુગ્મિત ઇલેક્ટ્રૉનને આનુષંગિક ચુંબકીય ચાકમાત્રા દર્શાવે છે.
કારણ (R) : કારણ કે તે d2sp3 પ્રકારનું સંકરણ ધરાવે છે.
જવાબ
(D) વિધાન (A) ખોટું છે પણ કારણ (R) સાચું છે.
[Fe(CN6)]-3 માં Fe+3 છે.
અયુગ્મિત \(\bar{e}\) ની સંખ્યા = 1
સંકરણ = d2sp3
ચુંબકીય ચાકમાત્રા = μ = \(\sqrt{n(n+2)}\)
= \(\sqrt{1(1+2)}\) = 1.73 BM
![]()
સવિસ્તર પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
સ્ફટિક્ષેત્ર વાદના આધારે નીચે આપેલાં સંયોજનોમાં ઊર્જા સ્તરની આકૃતિ દોરો. કેન્દ્રસ્થ ધાતુ પરમાણુ આયનની ઇલેક્ટ્રૉનીય રચના લખો અને તેમની ચુંબકીય ચાકમાત્રાનું મૂલ્ય નક્કી કરો.
(a) [CoF6]3-, [Co(H2O)6]2+, [Co(CN)6]3-
(b) [FeF6]3-, [Fe(H2O)6]2+, [Fe(CN)6]4-
ઉત્તર:
(a) [CoF6]3-
F– એ નિર્બળક્ષેત્ર લિગેન્ડ છે.
Co3+ = 3d6 (\(\left(\mathrm{t}_{2 \mathrm{~g}}^4 \mathrm{e}_{\mathrm{g}}^2\right)\)
અયુગ્મિત \(\bar{e}\) ની સંખ્યા = 4
ચુંબકીય ચાર્કમાત્રા = 4.92 BM
[Co(H2O)6]2+
H2O એ નિર્બળક્ષેત્ર લિગેન્ડ છે.
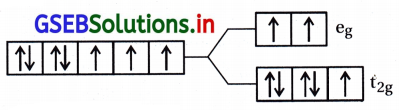
CO2+ = 3d7 \(\left(\mathrm{t}_{2 \mathrm{~g}}^5 \mathrm{e}_{\mathrm{g}}^2\right)\)
અયુગ્મિત \(\bar{e}\) ની સંખ્યા = n = 3
ચુંબકીય ચાકમાત્રા = 3.87 BM
[Co(CN)6]3-
CN એ પ્રબળક્ષેત્ર લિગેન્ડ છે.
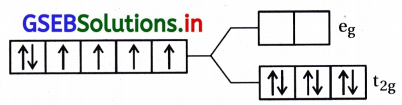
Co+3 = 3d6 \(\left(\mathrm{t}_{2 \mathrm{~g}}^6 \mathrm{e}_{\mathrm{g}}^0\right)\)
અયુગ્મિત \(\bar{e}\) ની સંખ્યા = 0
પ્રતિચુંબકીય ગુણધર્મ = (μ = 0)
(b) [FeF6]3-
F એ નિર્બળ લિગેન્ડ છે.
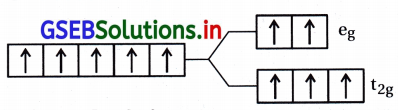
Fe3+ = 3d5 \(\left(\mathrm{t}_{2 \mathrm{~g}}^3 \mathrm{e}_{\mathrm{g}}^2\right)\)
અયુગ્મિત \(\bar{e}\) ની સંખ્યા = n = 5
ચુંબકીય ચાકમાત્રા = 5.92 BM
[Fe(H2O)6]2+
H2O એ નિર્બળ લિગેન્ડ છે.
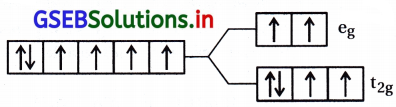
Fe+2 = 3d6 \(\left(\mathrm{t}_{2 \mathrm{~g}}^4 \mathrm{e}_{\mathrm{g}}^2\right)\)
અયુગ્મિત \(\bar{e}\) ની સંખ્યા n = 4
ચુંબકીય ચાકમાત્રા = 4.92 BM
[Fe(CN)6]4-
CN એ પ્રબળક્ષેત્ર લિગેન્ડ છે.
Fe+2 = 3d6 \(\left(\mathrm{t}_{2 \mathrm{~g}}^6 \mathrm{e}_{\mathrm{g}}^0\right)\)
અયુગ્મિત \(\bar{e}\) ની સંખ્યા = 0
પ્રતિચુંબકીય ગુણધર્મ = 0.0 BM
પ્રશ્ન 2.
નીચે આપેલા સંકીર્ણમાં સંયોજકતા બંધનવાદને આધારે નીચે આપેલ સંબંધો સમજાવો :
[1] [Mn(CN)6]3-
[2] [Co(NH3)6]3+
[3] [Cr(H2O)6]3+
[4] [FeCl6]4-
(a) સંકરણનો પ્રકાર
(b) આંતર કે બાહ્ય કક્ષકીય સંકીર્ણ
(c) ચુંબકીય ગુણધર્મ
(d) માત્ર સ્પિન આધારિત ચુંબકીય ચાકમાત્રા
ઉત્તર:
[1] [Mn(CN)6]3- માં Mn3+
(a) d2sp3 સંકરણ
(b) આંતરકક્ષકીય સંકીર્ણ
(c) બે અયુગ્મિત \(\bar{e}\) હોવાથી અનુચુંબકીય
(d) ચુંબકીય ચાકમાત્રા μ = 2.82 BM
[2] [Co(NH3)6]3+ માં Co3+

(a) d2sp3 સંકરણ
(b) આંતરકક્ષકીય સંકીર્ણ
(c) પ્રતિચુંબકીય (અયુગ્મિત \(\bar{e}\) નથી)
(d) ચુંબકીય ચાકમાત્રા μ = 0
[3] [Cr(H2O)6]3+ માં Cr3+
(a) d2sp3 સંકરણ
(b) આંતરકક્ષકીય સંકીર્ણ
(c) અનુચુંબકીય (3 અયુગ્મિત \(\bar{e}\))
(d) ચુંબકીય ચાકમાત્રા μ = 3.87 BM
[4] [FeCl6]4- માં Fe2+
(a) sp3d2 સંકરણ
(b) બાહ્ય કક્ષકીય સંકીર્ણ
(c) અનુચુંબકીય (4 અયુગ્મિત \(\bar{e}\))
(d) ચુંબકીય ચાકમાત્રા μ = 4.92 BM
![]()
પ્રશ્ન 3.
CoSO4Cl. 5NH3 બે સમઘટકીય સ્વરૂપ A અને B માં અસ્તિત્વ ધરાવે છે. સમઘટક A, AgNO3 સાથે પ્રક્રિયા કરીને સફેદ અવક્ષેપ આપે છે, પરંતુ BaCl2 સાથે પ્રક્રિયા કરતો નથી. સમઘટક B, BaCl2 સાથે સફેદ અવક્ષેપ આપે છે પરંતુ AgNO3 સાથે પ્રક્રિયા કરતો નથી. નીચેના પ્રશ્નોના જવાબ આપો :
(a) A અને B ને ઓળખો અને તેમનાં બંધારણીય સૂત્ર લખો.
(b) આ સમઘટકતાનું નામ આપો.
(c) A અને B ના IUPAC નામ આપો.
ઉત્તર:
- સમઘટક-A એ AgNO3 સાથે સફેદ અવક્ષેપ આપે છે. તેથી સવર્ગ સંયોજનમાં Cl– એ બહારની બાજુ હાજર છે.
- સમઘટક-B એ BaCl2 સાથે સફેદ અવક્ષેપ આપે છે. તેથી સવર્ગ સંયોજનમાં SO-24 એ બહારની બાજુ હાજર છે.
(a) સમઘટક-A ⇒ [Co(NH3)5SO4] Cl
સમઘટક-B ⇒ [Co(NH3)5Cl] SO4
(b) આયનીકરણ સમઘટકતા
(c) સમઘટક-A ⇒ પેન્ટાએમ્માઇનસલ્ફેટોકોબાલ્ટ(III)ક્લોરાઇડ
સમઘટક-B ⇒ પેન્ટાએમ્માઇનક્લોરાઇડો(III)સલ્ફેટ
પ્રશ્ન 4.
સંકીર્ણ દ્વારા અવશોષિત પ્રકાશ અને દેખાતા રંગ વચ્ચે શું સંબંધ છે ?
ઉત્તર:
- જ્યારે સફેદ પ્રકાશમાંનો કેટલોક ભાગ તે નમૂનામાંથી પસાર થાય છે ત્યારે તે દૂર થાય છે. તેથી બહાર નીકળતો પ્રકાશ સફેદ રહેતો નથી. સંકીર્ણનો રંગ જે શોષાય છે તે રંગનો પૂરક હોય છે. પૂરક રંગ બાકી રહેતી તરંગલંબાઈથી ઉત્પન્ન થતો રંગ છે. ઉદા.,,જો સંકીર્ણ દ્વારા લીલો રંગ શોષાય તો તે લાલ દેખાય છે.
- સ્ફટિકક્ષેત્ર સિદ્ધાંત મુજબ ધાતુમાં સંકીર્ણની ધરા અવસ્થામાં t2g સ્તરમાં પ્રાપ્ય છે. પછીની ઊંચી અવસ્થા જે \(\bar{e}\) માટે પ્રાપ્ય છે તે ખાલી eg સ્તરમાં છે. જો સંકીર્ણ વડે વાદળી-લીલા ગાળાને અનુરૂપ પ્રકાશ શોષવામાં આવે, તો તે ઇલેક્ટ્રૉન t2g સ્તરમાંથી eg સ્તરમાં ઉત્તેજિત કરશે. પરિણામે સંકીર્ણ જાંબલી રંગનો દેખાય છે.
- લિગેન્ડની ગેરહાજરીમાં સ્ફટિકક્ષેત્ર વિપાટન થતું નથી અને તેથી પદાર્થ રંગવિહીન છે. ઉદા., નિર્જળ CuSO4 સફેદ છે. પરંતુ CuSO4 · 5H2O રંગે વાદળી છે.
પ્રશ્ન 5.
સમાન ધાતુ અને સમાન લિગેન્ડ ધરાવતા અષ્ટફલકીય અને સમચતુલકીય સંકીર્ણોમાં શા માટે ભિન્ન રંગો જોવા મળે છે ?
ઉત્તર:
- સ્ફટિકક્ષેત્રના સિદ્ધાંત મુજબ અષ્ટફલકીય અને સમચતુલકીય ક્ષેત્ર વિપાટન એકબીજા સાથે સંબંધિત છે.
Δt = (\(\frac{4}{9}\))Δ0
જમાં, Δt = સમચતુલકીય ક્ષેત્રમાં સ્ફટિકક્ષેત્ર વિપાટન
Δ0 અષ્ટફલકીય ક્ષેત્રમાં સ્ફટિકક્ષેત્ર વિપાટન - પ્રકાશની શોષાયેલ તરંગલંબાઈ અને સ્ફટિકક્ષેત્ર વિપાટન ઊર્જા વચ્ચે સંબંધ….
Δ0 = E = \(\frac{h c}{\lambda}\)
Ε α \(\frac{1}{\lambda}\) - તેથી, સમાન ધાતુ અને સમાન લિગેન્ડ ધરાવતા સંકીર્ણ અષ્ટફલકીય સંકીર્ણમાં શોષાયેલ પ્રકાશની તરંગલંબાઈ સમચતુલકીય સંકીર્ણ કરતાં વધારે હોય છે.