Gujarat Board GSEB Class 10 Science Important Questions Chapter 3 ધાતુઓ અને અધાતુઓ Important Questions and Answers.
GSEB Class 10 Science Important Questions Chapter 3 ધાતુઓ અને અધાતુઓ
વિશેષ પ્રશ્નોત્તર
પ્રશ્ન 1.
નીચેના વિધાનોનાં વૈજ્ઞાનિક કારણ આપો :
ઍલ્યુમિનિયમ ધાતુ નાઇટ્રિક ઍસિડ સાથે હાઇડ્રોજન વાયુ ઉત્પન કરતી નથી.
ઉત્તર:
ઍલ્યુમિનિયમ ધાતુ નાઇટ્રિક ઍસિડ સાથે હાઇડ્રોજન વાયુ ઉત્પન્ન કરતી નથી, કારણ કે નાઇટ્રિક ઍસિડ એ પ્રબળ ઑક્સિડેશનકર્તા હોવાથી તે ઉત્પન્ન થતા હાઇડ્રોજન વાયુનું પાણીમાં ઑક્સિડેશન કરે છે અને પોતે કોઈ પણ નાઇટ્રોજન ઑક્સાઇડ(N2O, NO કે NO2)માં રિડક્શન પામે છે.
પ્રશ્ન 2.
નીચેના પ્રશ્નોનાં ઉત્તર આપોઃ
(1) ભૂજન અને કૅલ્સિનેશન સમજાવો.
ઉત્તર:
સંકેન્દ્રિત કાચી ધાતુ (અયસ્કોને ધાતુ -ઑક્સાઇડમાં રૂપાંતરિત કરવા માટે ભૂજન અને કૅલ્ટિનેશન પદ્ધતિનો ઉપયોગ થાય છે.
(i) ભૂંજન સલ્ફાઇડયુક્ત અયસ્ક (કાચી ધાતુ)ને વધુ માત્રામાં હવાની હાજરીમાં સખત ગરમ કરતાં તે ધાતુ-ઑક્સાઇડમાં ફેરવાય છે અને બધી બાષ્પશીલ અશુદ્ધિઓ (SO2(g)) દૂર થાય છે. આ પદ્ધતિને ભૂંજન કહે છે.
દા. ત.,
2ZnS(s) + 3O2(g) ![]() 2ZnO(s) + 2SO2(g)
2ZnO(s) + 2SO2(g)
2HgS(s) + 3O2(g)![]() 2 + 2HgO (s) + 2SO2(g)
2 + 2HgO (s) + 2SO2(g)
2PbS(s) + 3O2(g) ![]() 2FbO(s) + 2SO2g)
2FbO(s) + 2SO2g)
(ii) કેલ્સિનેશન કાર્બોનેટયુક્ત અયસ્ક (કાચી ધાતુ)ને મર્યાદિત માત્રામાં હવાની હાજરીમાં સખત ગરમ કરતાં તે ધાતુ-ઑક્સાઈડમાં ફેરવાય છે અને બધી બાષ્પશીલ અશુદ્ધિઓ (CO2(g)) દૂર થાય છે. આ પદ્ધતિને કૅલ્સિનેશન કહે છે.
દા. ત.,
MgCO3(s) ![]() MgO(s) + CO2(g)
MgO(s) + CO2(g)
ZnCO3(s) ![]() ZnO(s) + CO2(g)
ZnO(s) + CO2(g)
![]()
(2) સોનાની શુદ્ધતા કેરેટ એકમમાં સમજાવો.
ઉત્તર:
સોનાની શુદ્ધતાને કૅરેટ એકમમાં રજૂ કરવામાં આવે છે.
- શુદ્ધ સોનાને 24 કેરેટનું ગણવામાં આવે છે. તે ખૂબ જ નરમ હોવાથી તેમાંથી બનાવેલાં આભૂષણો પર થોડુંક દબાણ આવે તોપણ તેમના આકાર બદલાઈ જાય છે. પણ જો શુદ્ધ સોનામાં થોડાક પ્રમાણમાં તાંબું કે ચાંદી ઉમેરવામાં આવે, તો તેની મજબૂતાઈ વધે છે. આવા સોનાને 22 કેરેટનું સોનું કહે છે.
- આપણા દેશમાં સામાન્ય રીતે આભૂષણો 22 કેરેટ સોનાનાં હોય છે.
- 22 કેરેટનું સોનું એટલે 22 ભાગ શુદ્ધ સોનું અને 2 ભાગ તાંબુ કે ચાંદી ધરાવતી મિશ્રધાતુ છે.
(3) ભૌતિક ગુણધર્મોના આધારે ધાતુ તત્ત્વો અને અધાતુ તત્ત્વોનો તેનો તફાવત લખો.
ઉત્તર:

(4) તફાવત લખોઃ કૅલ્સિનેશન અને ભંજન
ઉત્તર:

(5) સમજાવો:
(a) શા માટે કૉપરનો ઉપયોગ નળ કે ગરમ પાણીની ટાંકી બનાવવા થાય છે, જ્યારે અન્ય ધાતુનો ઉપયોગ થતો નથી?
(b) જો લોખંડની ખીલીઓને કૉપર સલ્ફટના દ્રાવણમાં મૂકવામાં આવે તો શું થશે?
(c) નીચેનાં રાસાયણિક સમીકરણો પૂર્ણ કરો અને તેને સમતોલિત કરો:
(i) Ca + H2O →
(ii) Al + HCl →
(iii) Fe + H2O →
ઉત્તર:
(a) કૉપર ઠંડા પાણી, ગરમ પાણી કે પાણીની બાષ્પ સાથે પ્રક્રિયા કરતું નથી. જ્યારે અન્ય ધાતુઓ ઠંડા પાણી, ગરમ પાણી કે પાણીની બાષ્પ સાથે પ્રક્રિયા કરે છે. વળી, કૉપર સસ્તું અને સરળતાથી પ્રાપ્ત થાય છે. આથી તેનો ઉપયોગ નળ કે ગરમ પાણીની ટાંકી બનાવવા થાય છે.
(b) લોખંડની ખીલીઓને કૉપર સલ્ફટના દ્રાવણમાં મૂકતાં, આયર્ન દ્વારા કૉપરનું વિસ્થાપન થતાં કૉપર સલ્ફટના દ્રાવણનો વાદળી રંગ ઝાંખો પડી જાય છે. .
(c)
- Ca + 2H2O → Ca(OH)2 + H2(g)
- 2Al + 6HCl → 2AlCl3 + 3H2(g)
- 3Fe + 4H2O → Fe3O4 + 4H2(g)
(6) તમે કેવી રીતે સાબિત કરશો કે ઝિંક એ કૉપર કરતાં હું વધુ સક્રિય છે?
ઉત્તર:
ઝિંક અને કૉપરની પટ્ટી તથા કૉપર સલ્ફટ અને ઝિક સલ્લેટનું દ્રાવણ ધરાવતી બે કસનળીઓ લો. ઝિંકની પટ્ટીને કૉપર સલ્ફટના દ્રાવણમાં અને કૉપરની પટ્ટીને ઝિંક સલ્ફટના દ્રાવણમાં ડુબાડો.
અવલોકનઃ ઝિકની પટ્ટી અને કૉપર સલ્ફટના દ્રાવણવાળી કસનળીમાં પ્રક્રિયા થશે. જેમાં કૉપર સલ્ફટના દ્રાવણનો વાદળી રંગ ઝાંખો થશે. જ્યારે બીજી કસનળીમાં કોઈ ફેરફાર થતો નથી. આ રંગપરિવર્તન સાબિત કરે છે કે, ઝિક એ કૉપર કરતાં વધુ સક્રિય છે.
(7) સાંદ્ર HClનું 5 mL દ્રાવણ (કસનળી A), સાંદ્ર HNO3નું 5 mL દ્રાવણ (કસનળી B) અને સાંદ્ર ICI (15mL) + સાંદ્ર HNO3(5mL) દ્રાવણ (કસનળી C) લો. ધાતુનો એક નાનો ટુકડો પ્રત્યેક કસનળીમાં મૂકવામાં આવે છે. કસનળી A અને Eમાં કોઈ ફેરફાર થતો નથી, પરંતુ કસનળી cમાં ધાતુ ઓગળી જાય છે, તો આ ધાતુ કઈ હશે?
ઉત્તર:
ચાંદી કે સોનું હશે, કારણ કે કસનળી માં ઍક્વા રીજિયા દ્રાવણ બને છે.
![]()
(8) ત્રણ તત્ત્વો x, y, zની ઇલેક્ટ્રૉન-રચના નીચે મુજબ છે :
x ⇒ 2, 8.
y ⇒ 2, 8, 6
z ⇒ 2, 8, 1
તે ધાતુ અને અધાતુ ઓળખો.
ઉત્તર:
ઇલેક્ટ્રૉન-રચના મુજબ, x તત્ત્વ 10 ઇલેક્ટ્રૉન, y તત્ત્વ 16 ઇલેક્ટ્રૉન અને z તત્ત્વ 11 ઇલેક્ટ્રૉન ધરાવે છે.
આથી x તત્ત્વ 10Ne (નિયોન), y તત્ત્વ 16s (સલ્ફર) હશે, જ્યારે z તત્ત્વ 11Na (સોડિયમ) હશે. આમ, x અને y અધાતુ છે અને z ધાતુ છે.
(9) Au, Fe, Cu, Mg, Ca, Zn, Ag, Kને સક્રિયતાના ઊતરતા ક્રમમાં ગોઠવો.
ઉત્તર:
સક્રિયતાનો ઊતરતો ક્રમ :
K > Ca > Mg > Zn > Fe > Cu > Ag > Au
(10) ZnO ઉભયગુણી છે, તે દર્શાવતી પ્રક્રિયા લખો.
ઉત્તર:
ZnO + 2HCl → ZnCl2 + H2O
ZnO + 2NaOH → Na2ZnO2 (સોડિયમ ઝિકેટ) + H2O
પ્રશ્નોત્તર
પ્રશ્ન 1.
તત્ત્વોને તેમની વાહકતાના ગુણધર્મને આધારે ઉદાહરણ ? સહિત વર્ગીકૃત કરો.
ઉત્તર:
તત્ત્વોને તેમની વાહકતાના ગુણધર્મને આધારે નીચે મુજબ ત્રણ પ્રકારે વર્ગીકૃત કરી શકાય:
- ધાતુ તત્ત્વોઃ તેઓની વાહકતાનું મૂલ્ય ખૂબ જ વધુ હોય છે. દા. ત., કોપર (Cu), ઍલ્યુમિનિયમ (Al), સિલ્વર (Ag).
- અધાતુ તત્ત્વોઃ તેઓની વાહકતાનું મૂલ્ય ખૂબ જ ઓછું હોય છે. દા. ત., ઑક્સિજન (O2), નાઇટ્રોજન (N2), ક્લોરિન (Cl2), સલ્ફર (S).
- અર્ધધાતુ તત્ત્વો તેઓની વાહકતાનું મૂલ્ય ધાતુ તત્ત્વો કરતાં ઓછું, પરંતુ અધાતુ તત્ત્વો કરતાં વધુ હોય છે. દા. ત., સિલિકોન (Si), જર્મેનિયમ (Ge).
પ્રશ્ન 2.
ધાતુના સામાન્ય ગુણધર્મો લખો.
ઉત્તર:
ધાતુના સામાન્ય ગુણધર્મો નીચે પ્રમાણે છે :
- ધાતુઓ તેમની શુદ્ધ અવસ્થામાં ચળકાટવાળી સપાટી ધરાવે છે.
- તે ઓરડાના તાપમાને ઘન (પારા સિવાય) અને સખત હોય છે.
- તે તણાવપણા અને ટિપાઉપણાનો ગુણ ધરાવે છે.
- તે ઉષ્મા અને વિદ્યુતના સારા વાહક છે.
- તેમનાં ગલનબિંદુ ઊંચાં હોય છે.
- તે રણકાર (Sonorous) ઉત્પન્ન કરે છે.
પ્રશ્ન 3.
અધાતુ તત્ત્વોનાં એવાં ઉદાહરણ આપો કે જે ઘન, વાયુ અને પ્રવાહી સ્વરૂપે જોવા મળે છે?
ઉત્તર:
ઘન સ્વરૂપ : કાર્બન, સલ્ફર, આયોડિન
પ્રવાહી સ્વરૂપ : બ્રોમિન વાયુ સ્વરૂપ ઑક્સિજન, હાઇડ્રોજન, નાઇટ્રોજન
![]()
પ્રશ્ન 4.
અધાતુ તત્ત્વોના સામાન્ય ગુણધર્મો લખો.
ઉત્તર:
અધાતુ તત્ત્વોના સામાન્ય ગુણધર્મો નીચે પ્રમાણે છે:
- અધાતુ તત્ત્વો ઘન અથવા વાયુ સ્વરૂપે જોવા મળે છે. (અપવાદ : બ્રોમિન પ્રવાહી છે.)
- તે ઉષ્મા અને વિદ્યુતનાં અવાહક હોય છે.
- તે ટિપાઉપણા અને તણાવપણાનો ગુણ ધરાવતા નથી.
- તેનાં ગલનબિંદુ અને ઉત્કલનબિંદુ પ્રમાણમાં નીચા હોય છે.
- તે રણકાર ઉત્પન્ન કરતા નથી.
પ્રશ્ન 5.
ધાતુ તત્ત્વો અને અધાતુ તત્ત્વોના અપવાદ લખો.
અથવા
સમજાવો કે, તત્ત્વોનું ફક્ત ભૌતિક ગુણધર્મોના આધારે વર્ગીકરણ કરી શકાય નહિ.
ઉત્તર:
ધાતુ તત્ત્વોના અપવાદઃ
- તમામ ધાતુઓ ઓરડાના તાપમાને ઘન હોય છે, પરંતુ પારો પ્રવાહી છે.
- સામાન્ય રીતે ધાતુઓનાં ગલનબિંદુ ઊંચાં હોય છે, પરંતુ ગેલિયમ અને સીઝિયમનાં ગલનબિંદુ નીચાં છે.
- ધાતુ તત્ત્વોને છરી વડે કાપી શકાય નહિ, પરંતુ આલ્કલી ધાતુઓ(લિથિયમ, સોડિયમ, પોટેશિયમ)ને છરી વડે કાપી શકાય છે.
અધાતુ તત્ત્વોના અપવાદઃ
- સામાન્ય રીતે અધાતુ તત્ત્વો = ઘન કે વાયુ સ્વરૂપે જોવા મળે છે, પરંતુ બ્રોમિન પ્રવાહી સ્વરૂપે = જોવા મળે છે.
- સામાન્ય રીતે અધાતુ તત્ત્વો ચળકાટ ધરાવતાં નથી, પરંતુ = આયોડિન ચળકાટ ધરાવે છે.
- અધાતુ તત્ત્વોનાં ગલનબિંદુ નીચાં હોય છે, પરંતુ કાર્બનના અપરરૂપ હીરાનું ગલનબિંદુ ખૂબ જ ઊંચું છે.
- અધાતુ તત્ત્વો સામાન્ય રીતે વિદ્યુતના અવાહક હોય છે, પરંતુ કાર્બનનો અપરરૂપ ગ્રેફાઇટ વિદ્યુતનો સુવાહક છે.
પ્રશ્ન 6.
મૅગ્નેશિયમની પટ્ટી અને સલ્ફરના પાઉડરને સળગાવતાં મળતી નીપજ કયો ગુણ ધરાવે છે? તેની લિટમસપેપર પર શું અસર થાય છે?
ઉત્તરઃ
મૅગ્નેશિયમની પટ્ટી અને સલ્ફરના પાઉડરને સળગાવતાં નીપજ તરીકે અનુક્રમે મૅગ્નેશિયમ ઑક્સાઈડ (MgO) અને સલ્ફર ડાયૉક્સાઈડ (SO2) મળે છે.
મૅગ્નેશિયમ ઑક્સાઈડ બેઝિક ગુણ ધરાવતો હોવાથી તે લાલ લિટમસપેપર ભૂરું બનાવે છે, જ્યારે સલ્ફર ડાયૉક્સાઈડ ઍસિડિક ગુણ ધરાવતો હોવાથી તે ભૂરું લિટમસપેપર લાલ બનાવે છે.
પ્રશ્ન 7.
ઍસિડિક ઑક્સાઇડ અને બેઝિક ઑક્સાઇડ એટલે શું?
ઉત્તર:
જે ઑક્સાઇડ પાણીમાં ઓગળીને ઍસિડ બનાવે છે, તેને ઍસિડિક ઑક્સાઇડ કહે છે.
દા. ત., CO2(g) + H2O(l) → H2CO3(aq)
અધાતુ તત્ત્વોના ઑક્સાઇડ ઍસિડિક હોય છે.
જે ઑક્સાઇડ પાણીમાં ઓગળીને બેઇઝ બનાવે છે, તેને બેઝિક ઑક્સાઇડ કહે છે.
દા. ત., Na2O(s) + H2O(l) → 2NaOH(aq)
ધાતુ તત્ત્વોના ઑક્સાઈડ બેઝિક હોય છે.
![]()
પ્રશ્ન 8.
ઑક્સાઇડ કેવી રીતે બને? કોપર અને ઍલ્યુમિનિયમને હવામાં ગરમ કરતાં મળતી નીપજોનાં નામ અને સમતોલિત સમીકરણ લખો.
ઉત્તર:
ધાતુઓ ઑક્સિજન સાથે સંયોજાઈને ધાતુ ઑક્સાઇડ બનાવે છે.

પ્રશ્ન 9.
કઈ ધાતુના ઑક્સાઇડ પાણીમાં દ્રાવ્ય થઈ આલ્કલી (બેઇઝ) બનાવે છે? તેમના સમતોલિત રાસાયણિક સમીકરણ લખો.
ઉત્તર:
સોડિયમ અને પોટેશિયમ ધાતુના ઑક્સાઇડ પાણીમાં દ્રાવ્ય થઈ આલ્કલી બનાવે છે. જેમ કે,
Na2O(s) + H2O(l) → 2NaOH(aq)
K2O(s) + H2O(l) → 2KOH(aq)
પ્રશ્ન 10.
પોટેશિયમ (K), સોડિયમ (Na), મૅગ્નેશિયમ (Mg), ઍલ્યુમિનિયમ (Al), ઝિંક (Zn), સીસું (Pb), લોખંડ (Fe), કૉપર (Cu), ચાંદી (Ag) અને સોનું (Au) ધાતુની ઑક્સિજન સાથેની પ્રક્રિયા સમજાવો.
ઉત્તર:
અહીં, આપેલ ધાતુઓની ક્રિયાશીલતા જુદી જુદી હોવાથી રે તેમની ઑક્સિજન સાથેની પ્રક્રિયા સમાન દરે થતી નથી. જેમ કે,
- પોટેશિયમ અને સોડિયમ ધાતુઓ ખૂબ જ સક્રિય (ક્રિયાશીલ) હોવાથી તેને હવામાં ખુલ્લી રાખતાં તે સળગી ઊઠે છે. આથી તેમને કેરોસીનમાં ડુબાડી રાખવામાં આવે છે.
- ગ્નેશિયમ, ઍલ્યુમિનિયમ, ઝિંક અને સીસું (લેડ – lead) ધાતુઓ સામાન્ય તાપમાને ઑક્સિજન સાથે પ્રક્રિયા કરી ઑક્સાઇડ બનાવે છે, જે ધાતુની સપાટી પર રક્ષણાત્મક પાતળા સ્તર વડે ઢંકાઈ જાય છે. આથી તે ધાતુનું વધુ ઑક્સિડેશન થતું અટકાવે છે.
- લોખંડ સામાન્ય તાપમાને હવા સાથે પ્રક્રિયા કરતું નથી. લોખંડને ગરમ કરતાં તે સળગતું નથી, પરંતુ લોખંડના વહેર(ભૂકો)ને બર્નરની જ્યોતમાં નાખતાં તે ઝડપથી સળગે છે.
- કૉપરને હવામાં ગરમ કરવામાં આવે ત્યારે તે ઑક્સિજન સાથે સંયોજાઈને કાળા રંગનો કૉપર (II) ઑક્સાઇડ બનાવે છે, જે કૉપર ધાતુ પર સ્તર સ્વરૂપે લાગી જાય છે.
- ચાંદી અને સોનું ઊંચા તાપમાને પણ ઑક્સિજન સાથે પ્રક્રિયા કરતી નથી.
પ્રશ્ન 11.
ધાતુઓ પાણી સાથે પ્રક્રિયા કરીને કઈ નીપજ બનાવે છે?
પોટેશિયમ K), સોડિયમ (Na), કેલ્શિયમ (Ca), મૅગ્નેશિયમ (Mg), ઍલ્યુમિનિયમ (AI), લોખંડ (e), ઝિંક (Zn), સીસું (Pb), કોપર (Cu), ચાંદી (Ag) અને સોનું (Au) ધાતુની પાણી સાથેની પ્રક્રિયા સમજાવો.
ઉત્તર:
ધાતુઓ પાણી સાથે પ્રક્રિયા કરી ધાતુ-ઑક્સાઈડ બનાવે છે છે તથા હાઈડ્રોજન વાયુ મુક્ત કરે છે.
- ધાતુ-ઑક્સાઈડ પાણીમાં દ્રાવ્ય થઈ ધાતુ હાઇડ્રૉક્સાઈડ બનાવે છે.
ધાતુ + પાણી → ધાતુ-ઑક્સાઇડ + હાઇડ્રોજન
ધાતુ-ઑક્સાઇડ + પાણી → ધાતુ હાઇડ્રૉક્સાઇડ - પોટેશિયમ અને સોડિયમ ધાતુઓ ઠંડા પાણી સાથે તીવ્ર (ઉગ્ર) રીતે પ્રક્રિયા કરીને હાઇડ્રોજન વાયુ મુક્ત કરે છે, જે તરત જ સળગી ઊઠે છે. કારણ કે આ પ્રક્રિયા ઉષ્માક્ષેપક હોય છે.
2K(s) + 2H2O(l) → 2KOH(aq) + H2(g) + ઉષ્મા-ઊર્જા
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g) + ઉષ્મા-ઊર્જા - કેલ્શિયમની પાણી સાથેની પ્રક્રિયા ઓછી તીવ્ર હોય છે. પરિણામે ઉત્પન્ન થતી ઉષ્મા, હાઇડ્રોજન માટે આગ પકડવા માટે પૂરતી હોતી નથી.
Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g) અહીં, કૅલ્શિયમ સપાટી પર તરી આવે છે, કારણ કે ઉદ્ભવતા હાઈડ્રોજન વાયુના પરપોટા ધાતુની સપાટી પર ચીપકે છે. - મૅગ્નેશિયમ ઠંડા પાણી સાથે પ્રક્રિયા કરતી નથી, પરંતુ તે ગરમ પાણી સાથે પ્રક્રિયા કરીને મૅગ્નેશિયમ હાઇડ્રૉક્સાઈડ અને હાઇડ્રોજન બનાવે છે.
Mg + 2H25O (ગરમ) → Mg(OH)2(aq) + H2(g)
અહીં, મૅગ્નેશિયમ પણ તરવાનું શરૂ કરે છે, કારણ કે ઉદ્ભવતા હાઇડ્રોજન વાયુના પરપોટા ધાતુની સપાટી પર ચીપકે છે. - ઍલ્યુમિનિયમ, લોખંડ અને ઝિક ધાતુઓ ઠંડા કે ગરમ પાણી સાથે પ્રક્રિયા કરતી નથી, પરંતુ તેઓ પાણીની બાષ્પ સાથે પ્રક્રિયા કરી ધાતુ-ઑક્સાઈડ અને હાઈડ્રોજન બનાવે છે.
2Al(s) + H2O(g) → Al2O3(s) + 3H2(g)
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g) - સીસું, કૉપર, ચાંદી અને સોનું જેવી ધાતુઓ પાણી સાથે સહેજ પણ પ્રક્રિયા કરતી નથી.
પ્રશ્ન 12.
મૅગ્નેશિયમ, ઍલ્યુમિનિયમ, ઝિંક અને લોખંડની મંદ સફ્યુરિક ઍસિડ સાથેની પ્રક્રિયાનાં સમતોલિત સમીકરણો લખો.
ઉત્તર:
Mg(s) + H2SO4(aq) →MgSO4(aq) + H2(g)
2Al(s) + 3H2SO4(aq) → Alp(SO) (aq) + 3H2(g)
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g)
![]()
પ્રશ્ન 13.
કઈ ધાતુ નાઇટ્રિક ઍસિડ સાથે હાઇડ્રોજન વાયુ મુક્ત કરતી નથી? શા માટે?
ઉત્તર:
ઍલ્યુમિનિયમ (Al) અને ક્રોમિયમ (Cr) ધાતુ નાઇટ્રિક ઍસિડ સાથે હાઇડ્રોજન વાયુ મુક્ત કરતી નથી, કારણ કે નાઇટ્રિક ઍસિડ (HNO3) એ પ્રબળ ઑક્સિડેશનકર્તા હોવાથી તે H2 વાયુનું પાણીમાં ઑક્સિડેશન કરે છે અને પોતે કોઈ પણ નાઇટ્રોજન ઑક્સાઇડ(N2O, NO કે NO2)માં રિડક્શન પામે છે.
પ્રશ્ન 14.
મંદ નાઇટ્રિક ઍસિડ સાથે કઈ ધાતુઓ હાઇડ્રોજન વાયુ મુક્ત કરશે? પ્રક્રિયા સમીકરણ લખો.
ઉત્તર:
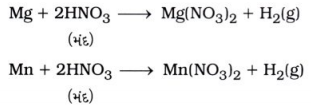
મૅગ્નેશિયમ (Mg) અને મૅગેનીઝ (Mn) ધાતુઓ ખૂબ જ મંદ નાઇટ્રિક ઍસિડ સાથે હાઇડ્રોજન વાયુ મુક્ત કરશે.
પ્રશ્ન 15.
ધાતુની નાઇટ્રિક ઍસિડ સાથેની પ્રક્રિયાથી કઈ નીપજ મળશે તેનો આધાર શેના પર રહેલ છે? ઉદાહરણ સાથે સમજાવો.
ઉત્તર:
ધાતુની નાઇટ્રિક ઍસિડ સાથેની પ્રક્રિયાથી કઈ નીપજ મળશે તેનો આધાર ધાતુના પ્રમાણ તથા ઍસિડની પ્રબળતા પર રહેલ છે. જેમ કે, ધાતુની મંદ નાઇટ્રિક ઍસિડ સાથે પ્રક્રિયા થતાં ધાતુના નાઇટ્રેટ ક્ષાર તથા NO કે N2O વાયુ ઉત્પન્ન થશે.
પરંતુ, ધાતુની સાંદ્ર નાઇટ્રિક ઍસિડ સાથે પ્રક્રિયા થતાં ધાતુના નાઇટ્રેટ ક્ષાર તથા NO2 વાયુ ઉત્પન્ન થાય છે.
ઉદાહરણ :
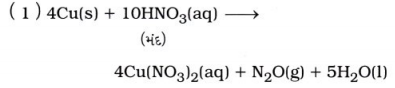
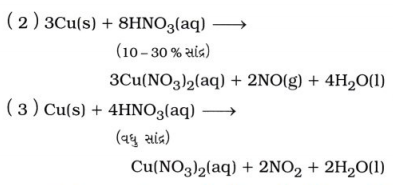
પ્રશ્ન 16.
કૉપર ધાતુ મંદ HCl સાથે પ્રક્રિયા કરતી નથી. શા માટે?
ઉત્તર:
કૉપર ધાતુ ખૂબ જ ઓછી સક્રિય ધાતુ હોવાથી તે મંદ હાઇડ્રોક્લોરિક ઍસિડ સાથે પ્રક્રિયા કરતી નથી. આથી તે H2 વાયુના પરપોટા આપતું નથી અને તાપમાનમાં પણ કોઈ ફેરફાર થતો નથી.
પ્રશ્ન 17.
મૅગ્નેશિયમ ધાતુની મંદ HCl સાથેની પ્રક્રિયાની પ્રતિક્રિયાત્મકતા સૌથી વધુ છે. શા માટે?
ઉત્તર:
મૅગ્નેશિયમ વધુ સક્રિય ધાતુ હોવાથી તે મંદ HCl સાથે પ્રક્રિયા કરી વધુ H2 વાયુ ઉત્પન્ન કરે છે. આથી વધુ પ્રમાણમાં પરપોટા ઉત્પન્ન થાય છે. આ પ્રક્રિયા દરમિયાન વધુ ઉખા ઉત્પન્ન થાય છે. આથી કહી શકાય કે, મૅગ્નેશિયમની પ્રતિક્રિયાત્મકતા સૌથી વધુ છે.
પ્રશ્ન 18.
ઍક્વા રીજિયા (રોયલ પાણી) (અશ્લરાજ) એટલે શું? તેમાં કઈ કઈ ધાતુઓ ઓગળી શકે?
ઉત્તર:
સાંદ્ર હાઇડ્રોક્લોરિક ઍસિડ અને સાંદ્ર નાઇટ્રિક ઍસિડનું કદથી 3: 1 પ્રમાણ ધરાવતા તાજા મિશ્રણને ઍક્વા રીજિયા (રોયલ પાણી) (અમ્લરાજ) કહે છે. ઍક્વા રીજિયા એ પ્રબળ ક્ષારીય ધ્રુમાયમાન પ્રવાહી છે. ઍક્વા રીજિયા દ્રાવણમાં સોના તેમજ પ્લેટિનમ જેવી ઉમદા ધાતુઓ ઓગળી શકે છે. 3.2.4 ધાતુઓ અન્ય ધાતુના ક્ષારના દ્રાવણ સાથે કેવી રીતે પ્રક્રિયા કરે છે.
પ્રશ્ન 19.
વિસ્થાપન પ્રક્રિયા (Displacement reaction) એટલે શું? Fe અને cu પૈકી કઈ ધાતુ વધુ પ્રતિક્રિયાત્મક છે? શા માટે?
ઉત્તર:
જે પ્રક્રિયામાં વધુ સક્રિય ધાતુ તેનાથી ઓછી સક્રિય ધાતુને તેના સંયોજનના દ્રાવણમાંથી કે પીગળેલ સ્વરૂપમાંથી વિસ્થાપિત કરે, તો તેવી પ્રક્રિયાને વિસ્થાપન પ્રક્રિયા કહે છે.
Fe અને cu પૈકી Fe વધુ પ્રતિક્રિયાત્મક છે, કારણ કે Cu કરતાં Fe વધુ સક્રિય ધાતુ છે. 3.2.5 પ્રતિક્રિયાત્મકતા (સક્રિયતા) શ્રેણી.
![]()
પ્રશ્ન 20.
ધાતુની પ્રતિક્રિયાત્મકતા અથવા સક્રિયતા શ્રેણી (The reactivity series) કોને કહે છે? જુદી જુદી ધાતુઓને તેમની પ્રતિક્રિયાત્મકતાના ઊતરતા ક્રમમાં ગોઠવો.
ઉત્તર:
જુદી જુદી ધાતુઓને તેમની પ્રતિક્રિયાત્મકતા(સક્રિયતા)ના ઘટતા (ઊતરતા) ક્રમમાં ગોઠવતાં બનતી શ્રેણીને સક્રિયતા શ્રેણી કહે છે.
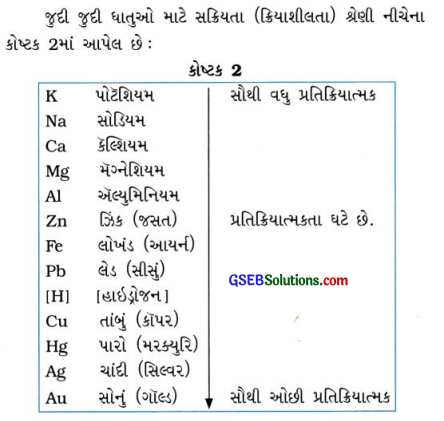
પ્રશ્ન 21.
ચાર ધાતુઓ A, B, C અને Dના નમૂના લીધેલા છે અને નીચે દર્શાવેલ દ્રાવણમાં એક પછી એક ઉમેરેલ છે. પ્રાપ્ત થયેલ પરિણામોને નીચે મુજબ કોષ્ટકમાં સારણીબદ્ધ કરેલ છે :
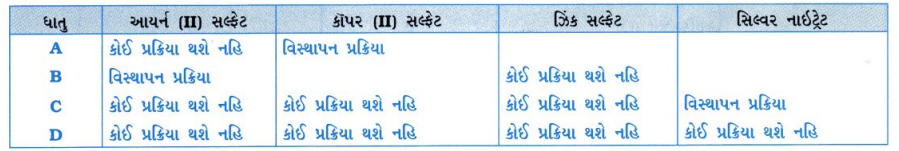
ધાતુઓ A, B, C અને D વિશે નીચે દર્શાવેલા પ્રશ્નોના ઉત્તર માટે ઉપર્યુક્ત કોષ્ટકનો ઉપયોગ કરો :
(1) સૌથી વધુ સક્રિય ધાતુ કઈ છે?
(2) જો ને કૉપર (II) સલ્ફટના દ્રાવણમાં ઉમેરવામાં આવે, તો તમે શું અવલોકન કરશો?
(3) ધાતુઓ A, B, C અને Dને પ્રતિક્રિયાત્મકતાના ઊતરતા ક્રમમાં ગોઠવો.
ઉત્તર:
(1) ધાતુ B સૌથી વધુ સક્રિય છે.
(2) કૉપર (II) સલ્ફટના દ્રાવણનો વાદળી રંગ દૂર થાય છે ? અને લાલ કથ્થાઈ રંગનું કૉપર B ધાતુ પર જમા થશે.
(3) પ્રતિક્રિયાત્મકતાનો ઊતરતો ક્રમ : B > A > C > D
પ્રશ્ન 22.
સક્રિય ધાતુમાં મંદ હાઇડ્રોક્લોરિક ઍસિડ ઉમેરવામાં આવે ત્યારે કયો વાયુ ઉત્પન્ન થાય છે? લોખંડની મંદ Hyso, સાથેની પ્રક્રિયાનું રાસાયણિક સમીકરણ લખો.
ઉત્તર:
સક્રિય ધાતુ જ્યારે મંદ હાઇડ્રોક્લોરિક ઍસિડ સાથે પ્રક્રિયા કરે છે ત્યારે હાઇડ્રોજન વાયુ ઉત્પન્ન થાય છે.
સક્રિય ધાતુ ઍસિડમાંથી હાઇડ્રોજન વાયુનું વિસ્થાપન કરે છે ? અને હાઇડ્રોજન વાયુ મુક્ત થાય છે.
Fe(s) + H2SO4(aq) (મંદ) → FeSO4(aq) + H2(g)
પ્રશ્ન 23.
જ્યારે આયર્ન (II) સલ્ફટના દ્રાવણમાં ઝિંક ઉમેરવામાં = આવે છે ત્યારે તમે શું અવલોકન કરો છો? અહીં થતી રાસાયણિક પ્રક્રિયા લખો.
ઉત્તર:
ઝિક (Zn) એ આયર્ન (Fe) કરતાં વધુ સક્રિય છે. આથી તેને આયર્ન (II) સલ્ફટમાં ઉમેરતાં તે આયર્ન ધાતુનું વિસ્થાપન કરે છે. પરિણામે દ્રાવણનો રંગ ઝાંખો પડે છે. જ્યારે ઝિંક સલ્ફટ બનવાથી દ્રાવણનો લીલો રંગ રંગવિહીન બને છે અને ભૂખરા-કાળા રંગની આયર્ન ધાતુ જમા થાય છે.
Zn(s) + FeSO4(aq) → ZnSO4(aq) + Fe(s)
પ્રશ્ન 24.
નિષ્ક્રિય વાયુઓ (He, Ne, Ar), ધાતુઓ (Na, Mg, A, K, Ca) અને અધાતુઓ(N, O, P S, Cl)ની ઇલેક્ટ્રૉનીય રચના સમજાવો.
ઉત્તર:
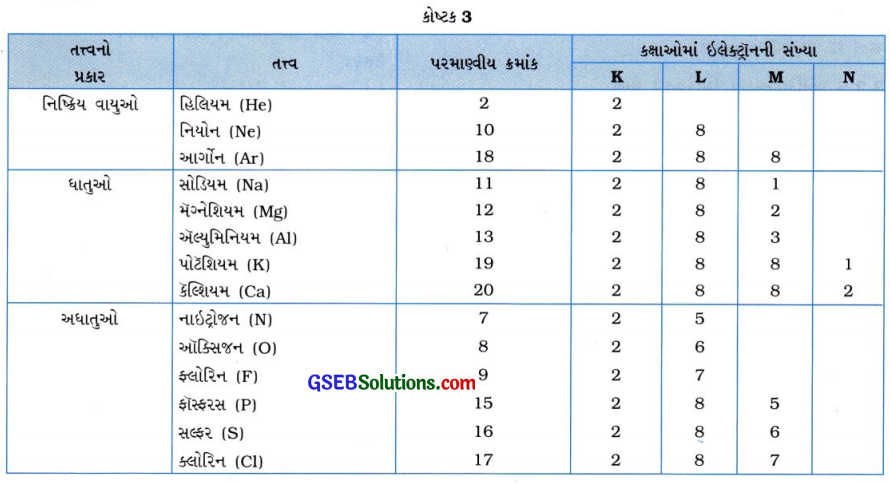
પ્રશ્ન 25.
આયનીય સંયોજનો અથવા વિદ્યુતસંયોજક સંયોજનો (Electrovalent compounds) એટલે શું? ઉદાહરણ આપી સમજાવો.
અથવા
સોડિયમ ક્લોરાઇડ(NaCl)નું નિર્માણ સમજાવો.
ઉત્તર:
ધાતુમાંથી અધાતુમાં ઇલેક્ટ્રૉનની આપ-લે દ્વારા બનતાં સંયોજનોને આયનીય સંયોજનો અથવા વિદ્યુતસંયોજક સંયોજનો કહે છે.
સોડિયમનો પરમાણ્વીય ક્રમાંક 11 છે. સોડિયમ પરમાણુની બાહ્યતમ M કક્ષામાં એક ઇલેક્ટ્રૉન છે, સોડિયમ પરમાણુ M કક્ષાનો એક ઇલેક્ટ્રૉન ગુમાવીને સોડિયમ ધનાયન (Na+) બનાવે છે અને ઉમદા વાયુ (Ne) જેવી સ્થાયી અષ્ટક રચના પ્રાપ્ત કરે છે.
![]()
આ જ પ્રમાણે ક્લોરિનનો પરમાણ્વીય ક્રમાંક 17 છે. ક્લોરિન પરમાણુની બાહ્યતમ M કક્ષામાં સાત ઇલેક્ટ્રૉન છે, સોડિયમ દ્વારા ગુમાવેલ એક ઇલેક્ટ્રૉન ક્લોરિન મેળવીને ક્લોરાઇડ ઋણાયન (Cl–) બનાવે છે અને ઉમદા વાયુ (Ar) જેવી સ્થાયી અષ્ટક રચના પ્રાપ્ત કરે છે.
![]()
સોડિયમ ધનાયન (Na+) અને ક્લોરાઇડ સણાયન (Cl–) વિરુદ્ધ વીજભાર ધરાવતા હોવાથી, તેઓ એકબીજાને આકર્ષે છે અને સ્થિર વિદ્યુત આકર્ષણ બળથી જકડાઈને સોડિયમ ક્લોરાઇડ (NaCl) બનાવે છે.
![]()
સોડિયમ ક્લોરાઇડ અણુ સ્વરૂપે નહિ, પરંતુ વિરુદ્ધ વીજભારિત આયનોના સમુદાય (સમુચ્ચય) સ્વરૂપે અસ્તિત્વ ધરાવે છે.
Na+ અને Cl– આયનો વચ્ચે બનતા બંધને આયનીય બંધ કહે છે.
![]()
પ્રશ્ન 26.
મૅગ્નેશિયમ ક્લોરાઇડ(MgCl2)નું નિર્માણ ઇલેક્ટ્રૉનની આપ-લે દ્વારા સમજાવો.
ઉત્તર:
મૅગ્નેશિયમનો પરમાણ્વીય ક્રમાંક 12 છે. તે બે ઇલેક્ટ્રૉન ગુમાવીને સ્થાયી અષ્ટક રચના પ્રાપ્ત કરે છે.
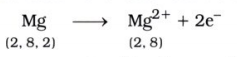
આ જ પ્રમાણે ક્લોરિનનો પરમાણ્વીય ક્રમાંક 17 છે. તે એક ઇલેક્ટ્રૉન મેળવીને સ્થાયી અષ્ટક રચના પ્રાપ્ત કરે છે.
![]()
આમ, મૅગ્નેશિયમ પરમાણુ તેના બે ઇલેક્ટ્રૉન પૈકી એક-એક ઇલેક્ટ્રૉન બંને ક્લોરિન પરમાણુને આપીને મૅગ્નેશિયમ ક્લોરાઇડ બનાવે છે.
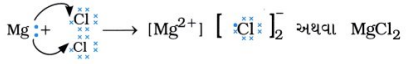
પ્રશ્ન 27.
આયનીય સંયોજનના સામાન્ય ગુણધર્મો લખો.
ઉત્તર:
આયનીય સંયોજનોના સામાન્ય ગુણધર્મો નીચે પ્રમાણે છે:
- ભૌતિક સ્વભાવઃ ધન અને ઋણ આયનો વચ્ચે પ્રબળ આકર્ષણ બળ હોવાના કારણે આયનીય સંયોજનો ઘન અને થોડા સખત હોય છે.
- આ સંયોજનો સામાન્ય રીતે બરડ (brittle) હોય છે અને દબાણ આપતાં તૂટીને ટુકડા થઈ જાય છે.
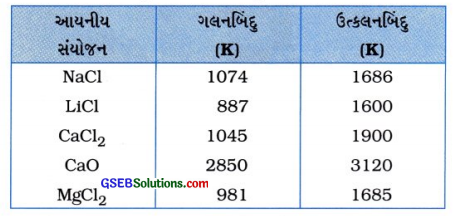
- ગલનબિંદુ અને ઉત્કલનબિંદુ આયનીય સંયોજનોમાં આયનો વચ્ચે રહેલ પ્રબળ આંતર-આયનીય આકર્ષણ બળને તોડવા માટે ખૂબ વધુ પ્રમાણમાં ઊર્જાની જરૂર પડે છે. આથી આયનીય સંયોજનોના ગલનબિંદુ અને ઉત્કલનબિંદુ ઘણાં ઊંચાં હોય છે. જેમ કે,
- દ્રાવ્યતા આયનીય સંયોજનો (વિદ્યુત સંયોજક સંયોજનો) સામાન્ય રીતે પાણીમાં દ્રાવ્ય હોય છે, પરંતુ પેટ્રોલ અને કેરોસીન જેવા કાર્બનિક દ્રાવકોમાં અદ્રાવ્ય હોય છે.
- વિદ્યુતનું વહન : દ્રાવણમાં વિદ્યુતનું વહન તેમાં મુક્ત રહેલા વીજભારિત કણો(આયનો)ની ગતિશીલતાના કારણે હોય છે. આયનીય સંયોજનોનાં પાણીમાં બનાવેલ દ્રાવણ આયનો ધરાવે છે. આથી દ્રાવણમાંથી વિદ્યુતપ્રવાહ પસાર કરવામાં આવે, તો આયનો વિરુદ્ધ વિદ્યુતધ્રુવો તરફ ગતિ કરે છે. પરિણામે આયનીય સંયોજનોનું જલીય દ્રાવણ વિદ્યુતનું સુવાહક હોય છે.
પરંતુ ઘન અવસ્થામાં આયનીય સંયોજનો વિદ્યુતનું વહન કરતા નથી, કારણ કે ઘન અવસ્થામાં આયનો મજબૂત આકર્ષણથી બંધાયેલા હોવાથી ઘન અવસ્થામાં આયનોનું સ્થાનાંતર શક્ય નથી.
જ્યારે આયોનિક સંયોજનો પીગળેલી અવસ્થામાં વિદ્યુતનું વહન કરે છે, કારણ કે આયોનિક સંયોજનોને પિગળવા ઉષ્મા આપતાં વિરુદ્ધ વીજભાર ધરાવતા આયનો વચ્ચેના સ્થિર વિદ્યુતીય આકર્ષણ બળો નિર્બળ બનતાં આયનો છૂટા પડે છે. આમ, પીગળેલી અવસ્થામાં આયનોનું સ્થાનાંતર શક્ય બનતું હોવાથી તે વિદ્યુતનું વહન કરે છે, એટલે કે વિદ્યુતના સુવાહક બને છે.
પ્રશ્ન 28.
સક્રિયતાના આધારે ધાતુઓનું વર્ગીકરણ સમજાવો.
ઉત્તરઃ
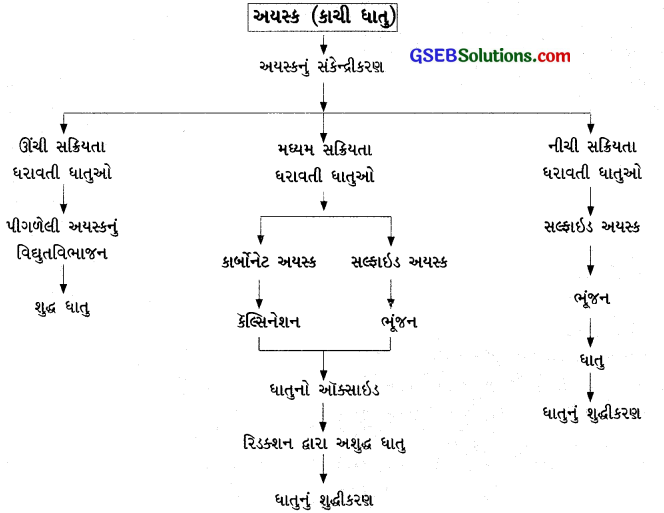
સક્રિયતાના આધારે ધાતુઓને ત્રણ રીતે વર્ગીકૃત કરી શકાય :

- ઊંચી સક્રિયતા ધરાવતી ધાતુઓ
- સક્રિયતા શ્રેણીમાં ટોચ પર રહેલી ધાતુઓ
દા. ત., K, Na, Ca, Mg અને Al. - આ ધાતુઓ એટલી હદે સક્રિય હોય છે કે Mg મેળવાય છે. ક્યારેય કુદરતમાં મુક્ત સ્વરૂપે મળતી નથી.
- સક્રિયતા શ્રેણીમાં ટોચ પર રહેલી ધાતુઓ
- મધ્યમ સક્રિયતા ધરાવતી ધાતુઓ:
સક્રિયતા શ્રેણીની મધ્યમાં રહેલી ધાતુઓ મધ્યમ સક્રિય હોય છે.
દા. ત., Zn, Fe, Pb, Cu- આ ધાતુઓ ઑક્સાઈડ, સલ્ફાઈડ અથવા કાર્બોનેટ સ્વરૂપે પૃથ્વીના ભૂપૃષ્ઠમાંથી મળે છે.
- નીચી સક્રિયતા ધરાવતી ધાતુઓઃ
- સક્રિયતા શ્રેણીમાં તળિયે રહેલી ધાતુઓ સૌથી આથી મુક્ત ઓછી સક્રિય હોય છે.
- તે ઘણી વાર મુક્ત અવસ્થામાં મળે છે.
દા. ત., સોનું અને ચાંદી. - ચાંદી અને કૉપર તેમના સલ્ફાઈડ અથવા ઑક્સાઈડ સ્વરૂપે પૃથ્વીના ભૂપૃષ્ઠમાંથી સંયુક્ત અવસ્થામાં મળે છે.
- ઘણી ધાતુઓની અયસ્ક ઑક્સાઈડ હોય છે. આમ થવાનું કારણ એ છે કે ઑક્સિજન ખૂબ જ સક્રિય તત્ત્વ છે અને પૃથ્વી પર વિપુલ પ્રમાણમાં મળે છે.
![]()
પ્રશ્ન 29.
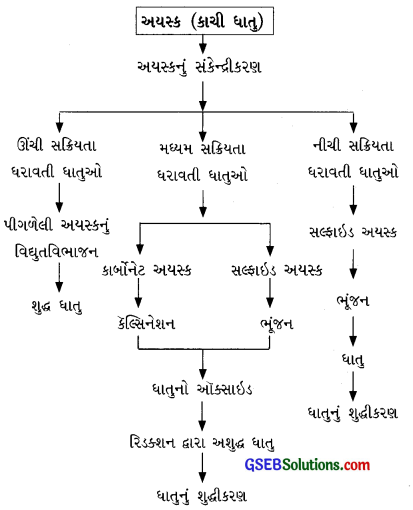
કાચી ધાતુમાંથી શુદ્ધ ધાતુના નિષ્કર્ષણમાં સમાવિષ્ટ તબક્કાઓ ચાર્ટ સ્વરૂપે દર્શાવો.
ઉત્તર:
કાચી ધાતુમાંથી શુદ્ધ ધાતુ મેળવવા માટેના વિવિધ તબક્કાઓ નીચેના ચાર્ટ સ્વરૂપે દર્શાવી શકાય:
પ્રશ્ન 30.
ગેંગ એટલે શું? ગેંગને દૂર કરવા માટે વપરાતી પદ્ધતિઓનો આધાર શેના પર રહેલો છે?
ઉત્તરઃ
કાચી ધાતુમાં તત્ત્વ એકલું હોતું નથી, પરંતુ તેમાં વધુ માત્રામાં માટી, રેતી તથા અનિચ્છનીય પદાર્થો પણ અશુદ્ધિ સ્વરૂપે હોય છે. આવી અશુદ્ધિઓને ગેંગ કહે છે.
ગેંગને દૂર કરવા માટે વપરાતી પદ્ધતિઓનો આધાર ગેંગ અને કાચી ધાતુના ભૌતિક અથવા રાસાયણિક ગુણધર્મો વચ્ચે રહેલા તફાવત પર રહેલો છે. 3.4.સક્રિયતા શ્રેણીમાં નીચે રહેલી ધાતુઓનું નિષ્કર્ષણ
પ્રશ્ન 31.
સક્રિયતા શ્રેણીમાં નીચે રહેલી ધાતુઓનું નિષ્કર્ષણ સમજાવો.
ઉત્તરઃ
સક્રિયતા શ્રેણીમાં નીચે રહેલી ધાતુઓ ખૂબ જ નિષ્ક્રિય હોય છે.
- આ ધાતુઓના ઑક્સાઇડને માત્ર ગરમ કરી તેનું રિડક્શન થઈ ધાતુ છૂટી પડે છે.
- દા. ત., સિન્નાબાર (HgS) એ મરક્યુરીની કાચી ધાતુ છે.
- જ્યારે તેને હવામાં ગરમ કરવામાં આવે છે ત્યારે પ્રથમ તે મરક્યુરિક ઑક્સાઇડ(HgO)માં ફેરવાય છે. ત્યારબાદ મરક્યુરિક ઑક્સાઇડને વધુ ગરમ કરતાં તે મરક્યુરી(Hg)માં રિડક્શન પામે છે.
2gS(s) + 3O2(g) 2HgO(s) + 2SO2(g)
2HgO(s) + 2SO2(g)
2HgO(s)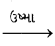 2Hg(l) + O2(g)
2Hg(l) + O2(g) - આ જ પ્રમાણે કૉપર કે જે કુદરતમાં Cups સ્વરૂપે તેના અયસ્ક તરીકે મળે છે, તેને ગરમ કરવાથી નીચે મુજબ કૉપર (Cu) ધાતુ મળે છે.
2Cu2S(s) + 3O2(g)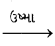 2Cu2O(s) + 2SO2(g)
2Cu2O(s) + 2SO2(g)
2Cu2O(s) + Cu2S(s)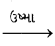 6Cu(s) + SO2(g)
6Cu(s) + SO2(g)
પ્રશ્ન 32.
સક્રિયતા શ્રેણી (Activity series)ની મધ્યમાં રહેલી ધાતુઓનું નિષ્કર્ષણ સમજાવો.
ઉત્તર:
સક્રિયતા શ્રેણીની મધ્યમાં રહેલી ધાતુઓ જેવી કે લોખંડ, ઝિક, સીસું, કૉપર વગેરે મધ્યમ પ્રતિક્રિયાત્મક (સક્રિય) હોય છે.
- આ ધાતુઓ સામાન્ય રીતે કુદરતમાં સલ્ફાઇડ અથવા કાર્બોનેટ સ્વરૂપે મળે છે.
- ધાતુને તેના સલ્ફાઈડ અથવા કાર્બોનેટમાંથી મેળવવા કરતાં તેના ઑક્સાઇડમાંથી મેળવવી વધુ સરળ હોય છે. તેથી રિડક્શન કરતાં પહેલાં સલ્ફાઈડ કે કાર્બોનેટ સ્વરૂપે રહેલ ધાતુને ઑક્સાઇડ સ્વરૂપમાં ફેરવવી જરૂરી છે.
- સલ્ફાઈડયુક્ત કાચી ધાતુને વધુ માત્રામાં હવાની હાજરીમાં સખત ગરમ કરતાં તે ધાતુ-ઑક્સાઇડમાં ફેરવાય છે. આ પદ્ધતિને ભંજન કહે છે.
- કાર્બોનેટયુક્ત કાચી ધાતુને મર્યાદિત માત્રામાં હવાની હાજરીમાં સખત ગરમ કરતાં તે ધાતુ-ઑક્સાઇડમાં ફેરવાય છે. આ પદ્ધતિને કૅલ્સિનેશન કહે છે.
- દા. ત., ઝિંકની અયસ્ક માટે ભૂજન અને કૅલ્ટિનેશનની પ્રક્રિયાઓ નીચે પ્રમાણે દર્શાવી શકાય:
ભૂજન:
2ZnS(s) + 3O2(g)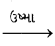 2ZnO (s) + 2SO2(g)
2ZnO (s) + 2SO2(g)
કૅલ્ટિનેશનઃ
ZnCO3(s) ZnO(s) + CO2(g)
ZnO(s) + CO2(g)
આ ધાતુ-ઑક્સાઇડનું કાર્બન (કોક) વડે રિડક્શન કરતાં ધાતુ મળે છે.
ZnO(s) + C(s) → Zn(s) + CO(g) - રિડક્શનકર્તા તરીકે કાર્બન (કોક) સિવાય ઘણી વખત વધુ સક્રિય ધાતુઓ જેવી કે સોડિયમ, કૅલ્શિયમ, ઍલ્યુમિનિયમ પણ વપરાય છે. તે નીચી સક્રિયતા ધરાવતી ધાતુઓને તેમનાં સંયોજનોમાંથી વિસ્થાપિત કરે છે.
દા. ત., મેંગેનીઝ ડાયૉક્સાઇડને ઍલ્યુમિનિયમના ભૂકા સાથે ગરમ કરવામાં આવે ત્યારે નીચે પ્રમાણે પ્રક્રિયા થાય છે:
3MnO2(s) + 4Al(s) → 3Mn(l) + 2Al2O3 + ઉષ્મા
પ્રશ્ન 33.
થર્મિટ પ્રક્રિયા (Thermit reaction) સમજાવો.
ઉત્તર:
વધુ સક્રિય ધાતુઓ, ઓછી સક્રિય ધાતુઓને તેમનાં સંયોજનમાંથી વિસ્થાપિત કરી શકે છે. આવી વિસ્થાપન પ્રક્રિયાઓ 3 ખૂબ જ વધુ ઉષ્માક્ષેપક હોવાથી મળતી ધાતુ પીગળેલી અવસ્થામાં મળે છે. આવી પ્રક્રિયાને થર્મિટ પ્રક્રિયા કહે છે.
દા. ત., આયર્ન (II) ઑક્સાઇડ(Fe2O3)ની ઍલ્યુમિનિયમ સાથેની પ્રક્રિયાથી મળતી પીગળેલી Fe ધાતુનો ઉપયોગ રેલવેના પાટા અથવા મશીનના તિરાડ પડેલા ભાગો જોડવામાં થાય છે.
Fe2O3(s) + 2Al(s) → 2Fe(0) + Al2O3(s) + ઉષ્મા

પ્રશ્ન 34.
સક્રિયતા શ્રેણીમાં ટોચ પર રહેલી ધાતુઓનું નિષ્કર્ષણ સમજાવો.
ઉત્તર:
સક્રિયતા શ્રેણીમાં ટોચ પર રહેલી ધાતુઓ ખૂબ જ સક્રિય હોય છે.
- આવી ધાતુઓનાં સંયોજનોનું કાર્બન વડે રિડક્શન કરી શકાતું નથી, કારણ કે આ ધાતુઓનું કાર્બન કરતાં ઑક્સિજન પ્રત્યે આકર્ષણ વધુ છે. આથી આવી ધાતુઓના નિષ્કર્ષણ માટે વિદ્યુતવિભાજનીય રિડક્શન પદ્ધતિ વપરાય છે.
- દા. ત., સોડિયમ, મેગ્નેશિયમ અને કેલ્શિયમને તેમના પિગાળેલા ક્લોરાઇડના વિદ્યુતવિભાજન દ્વારા મેળવવામાં આવે છે.
- વિદ્યુતવિભાજન દરમિયાન ધાતુઓ કૅથોડ (ઋણ વીજભારિત વિદ્યુતધ્રુવ) પાસે જમા થાય છે. જ્યારે ક્લોરિન વાયુ ઍનોડ (ધન વીજભારિત વિદ્યુતધ્રુવ) પાસે જમા થાય છે.
જેમ કે, કૅથોડ (-) : Na+ + e– → Na
ઍનોડ (+) : 2Cl– → Cl2 + 2e– - આ જ રીતે ઍલ્યુમિનિયમ ઑક્સાઇડ(Al909)ના વિદ્યુત- વિભાજનીય રિડક્શન દ્વારા ઍલ્યુમિનિયમ મેળવી શકાય છે.
![]()
પ્રશ્ન 35.
ધાતુઓના શુદ્ધીકરણ માટેની વિદ્યુતવિભાજનીય શુદ્ધીકરણ (Electrolytic Refining) પદ્ધતિ સમજાવો.
ઉત્તર:
કાચી ધાતુમાંથી મેળવેલ ધાતુ અશુદ્ધ હોય છે. આથી ધાતુનું શુદ્ધીકરણ કરવું જરૂરી છે.
- વિદ્યુતવિભાજનીય શુદ્ધીકરણ એ અશુદ્ધ ધાતુઓના શુદ્ધીકરણ માટે સૌથી વ્યાપક પ્રમાણમાં વપરાતી પદ્ધતિ છે.
- કૉપર, ઝિંક, ટિન, નિકલ, ચાંદી અને સોના જેવી ધાતુઓને શુદ્ધ ? કરવા માટે વિદ્યુતવિભાજનીય રિડક્શન કરવામાં આવે છે.
- જેમાં અશુદ્ધ ધાતુના સળિયાનો ઍનોડ અને શુદ્ધ ધાતુની પાતળી પટ્ટીનો કૅથોડ બનાવવામાં આવે છે.
- ધાતુક્ષારના દ્રાવણનો વિદ્યુતવિભાજય (Electroyte) તરીકે ઉપયોગ કરવામાં આવે છે.
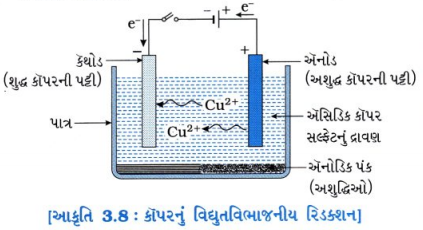
- આકૃતિ 3.8માં દર્શાવ્યા પ્રમાણે સાધનોની ગોઠવણી કરો.
- વિદ્યુતવિભાજ્યમાંથી વિદ્યુતપ્રવાહ પસાર કરતાં ઍનોડમાંથી અશુદ્ધ ધાતુ વિદ્યુતવિભાજ્યમાં ઓગળે છે અને વિદ્યુતવિભાજ્યમાંથી સમતુલ્ય માત્રામાં શુદ્ધ ધાતુ કૅથોડ પર જમા થાય છે.
દા. ત.,

– દ્રાવ્ય અશુદ્ધિઓ દ્રાવણમાં જાય છે; જ્યારે ગોલ્ડ, સિલ્વર, પ્લેટિનમ જેવી અદ્રાવ્ય અશુદ્ધિઓ પાત્રના તળિયે કાદવરૂપે જમા (નિક્ષેપિત) થાય છે, જેને ઍનોડ અંક (Anode mud) કહે છે.
પ્રશ્ન 36.
ક્ષારણ(Corrosion)નાં ઉદાહરણ આપો.
ઉત્તર:
ક્ષારણનાં ઉદાહરણ નીચે મુજબ છે :
- ચાંદીની વસ્તુઓને હવામાં ખુલ્લી રાખતાં થોડા સમય બાદ . તે કાળી પડી જાય છે. આમ થવાનું કારણ એ છે કે તે હવામાંના – સલ્ફર સાથે પ્રક્રિયા કરી સિલ્વર સલ્ફાઇડ(AgS)નું સ્તર બનાવે છે.
- કૉપર હવામાંના ભેજયુક્ત કાર્બન ડાયૉક્સાઇડ સાથે પ્રક્રિયા – કરે છે અને ધીરે ધીરે તેનો ચમકદાર કથ્થાઈ રંગ ગુમાવીને લીલું : સ્તર પ્રાપ્ત કરે છે. આ લીલો પદાર્થ કૉપર કાર્બોનેટ (CaCO3) છે.
- લોખંડને ભેજવાળી હવામાં લાંબો સમય ખુલ્લું રાખતાં તેની – પર કથ્થાઈ પદાર્થનો સ્તર જામે છે, જેને કાટ (Fe2O3• xH2O) કહે છે.
પ્રશ્ન 37.
પ્રવૃત્તિ 3.14 પરથી સમજાવો કે કેમ કસનળી Aમાં રાખેલ લોખંડની ખીલીને કાટ લાગે છે, જ્યારે કસનળી B અને Cમાં રાખેલ લોખંડની ખીલીને કાટ લાગતો નથી.
ઉત્તર:
પ્રવૃત્તિ 3.14 પરથી જોઈ શકાય છે કે કસનળી Aમાં રાખેલ લોખંડની ખીલી હવા અને પાણી બંનેના સંપર્કમાં હોવાથી તેને કાટ લાગે છે. જ્યારે કસનળી 8માં લોખંડની ખીલી માત્ર પાણીના સંપર્કમાં છે અને કસનળી Cમાં લોખંડની ખીલી શુષ્ક હવા અને નિર્જળ કૅલ્શિયમ ક્લોરાઈડના સંપર્કમાં છે. આથી કસનળી B અને Cમાં રાખેલ લોખંડની ખીલીને કાટ લાગતો નથી.
યાદ રાખો કાટ લાગવા માટે ધાતુ, હવા અને પાણી (ભુજ)ના સંપર્કમાં આવવી જરૂરી છે.
પ્રશ્ન 38.
ટૂંક નોંધ લખો : મિશ્રધાતુ
ઉત્તર:
મિશ્રધાતુ બનાવવાથી ધાતુના ઇચ્છિત ગુણધર્મોમાં સુધારા કરી શકાય છે.
દા. ત., લોખંડ સૌથી વધુ પ્રમાણમાં ઉપયોગમાં લેવાતી ધાતુ છે, પરંતુ તે ક્યારેય શુદ્ધ અવસ્થામાં વપરાતી નથી. આમ થવાનું કારણ એ ડે છે કે શુદ્ધ લોખંડ ખૂબ જ નરમ હોય છે અને ગરમ હોય ત્યારે તન્ય 3 હોય છે. પરંતુ જો તેમાં થોડા પ્રમાણમાં કાર્બન (આશરે 0.05 %) ઉમેરવામાં આવે, તો તે સખત અને મજબૂત બને છે.
- જ્યારે લોખંડને નિકલ અને ક્રોમિયમ સાથે મિશ્ર કરવામાં આવે ત્યારે સ્ટેનલેસ સ્ટીલ મળે છે, જે સખત હોય છે અને તેને કાટ લાગતો નથી.
આમ, લોખંડને બીજા કેટલાક પદાર્થો (ધાતુ) સાથે મિશ્ર કરવામાં આવે, તો તેના ગુણધર્મો બદલાય છે. - ટૂંકમાં, કોઈ પણ ધાતુમાં જો બીજા કોઈ પદાર્થ(ધાતુ કે અધાતુ)ને મિશ્ર કરવામાં આવે, તો બનતા પદાર્થના ગુણધર્મો બદલાય છે, જેને મિશ્રધાતુ કહે છે.
- આમ, મિશ્રધાતુ એ બે કે તેથી વધુ ધાતુઓ અથવા ધાતુ અને અધાતુનું સમાંગ (homogeneous) મિશ્રણ છે.
- મિશ્રધાતુ પ્રાથમિક ધાતુને પિગાળીને તેમાં નિશ્ચિત પ્રમાણમાં અન્ય ધાતુ કે અધાતુને ઓગાળીને બનાવવામાં આવે છે. ત્યારબાદ તેને ઓરડાના તાપમાને ઠંડી પાડવામાં આવે છે.
- મિશ્રધાતુ પૈકી એક ધાતુ મરક્યુરી હોય, તો તેવી મિશ્રધાતુને સંરસ (એમાલગ્ન) કહે છે.
દા. ત., Zn – Hg (ઝિક એમાલગ્ન) » મિશ્રધાતુની વિદ્યુતવાહકતા અને ગલનબિંદુ શુદ્ધ ધાતુઓ કરતાં ઓછા હોય છે. દા. ત., પિત્તળ (બ્રાસ) એ તાંબુ (Cu) અને ઝિકાZn)ની મિશ્રધાતુ છે. જ્યારે બ્રૉન્ગ એ તાંબુ (Cu) અને ટિન(Sn)ની મિશ્રધાતુ છે. જેમાં બ્રૉન્ગ એ વિદ્યુતનું સારું વાહક નથી, પરંતુ તાંબુ (Cu) એ વિદ્યુતનું સારું વાહક હોવાથી તેનો ઉપયોગ વિદ્યુતીય પરિપથ બનાવવા થાય છે. સોલ્ડર એ સીસું (PB) અને ટિન(Sn)ની મિશ્રધાતુ છે, જે નીચું ગલનબિંદુ ધરાવે છે. તેનો ઉપયોગ વિદ્યુતીય તારનું એકબીજા સાથે વેલ્ડિંગ (રણ) કરવા માટે થાય છે.
![]()
પ્રશ્ન 39.
શુદ્ધ સોનું અને 22 કેરેટ સોનામાં શો ફેર છે? કયા પ્રકારનું સોનું આભૂષણો બનાવવા માટે વપરાય છે?
ઉત્તર:
શુદ્ધ સોનું એ 24 કેરેટ સોનું છે, જે ખૂબ જ નરમ હોય છે. તેમાંથી આભૂષણો (ઘરેણાં) બનાવી શકાતાં નથી. જ્યારે 22 કેરેટ સોનું એ 22 ભાગ શુદ્ધ સોનું અને 2 ભાગ કૉપર અથવા ચાંદીનું મિશ્રણ છે, જે સખત હોય છે. પરિણામે 22 કેરેટ સોનું આભૂષણોબનાવવા માટે વપરાય છે.
હેતુલક્ષી પ્રશ્નોત્તર
પ્રશ્ન 1.
નીચેના પ્રશ્નોના ટૂંકમાં ઉત્તર આપોઃ
(1) ધાત્વીય ચમક એટલે શું?,
ઉત્તર:
ધાતુઓ તેમની શુદ્ધ અવસ્થામાં ચળકાટવાળી સપાટી ધરાવે છે. આ ગુણધર્મને ધાત્વીય ચમક કહે છે.
(2) Pvcનું પૂરું નામ લખો.
ઉત્તર:
Pvcનું પૂરું નામ પૉલિવિનાઈલ ક્લોરાઇડ છે.
(3) પ્રવાહી ધાતુ અને અધાતુનું ઉદાહરણ આપો.
ઉત્તર:
પ્રવાહી ધાતુ: મરક્યુરી (પારો-Hg) અને ગેલિયમ (Ga) પ્રવાહી અધાતુ: બ્રોમિન (Br)
(4) કઈ ધાતુઓને તમારી હથેળી પર રાખતાં તે પીગળી જાય છે?
ઉત્તર:
ગેલિયમ (Ga) અને સીઝિયમ (Cs) ધાતુ પીગળી જાય છે.
(5) ઉભયગુણી ઑક્સાઈડ કોને કહે છે?
ઉત્તર:
ધાતુના જે ઑક્સાઈડ ઍસિડ અને બેઇઝ બંને સાથેપ્રક્રિયા કરીને ક્ષાર અને પાણી આપે છે, તે ઑક્સાઈડને ઉભયગુણી ઑક્સાઈડ કહે છે. દા. ત., Al2O3, ZnO
(6) કઈ ધાતુઓ ઠંડા પાણી સાથે ઉગ્ર રીતે પ્રક્રિયા કરે છે?
ઉત્તર:
સોડિયમ અને પોટેશિયમ ધાતુઓ ઠંડા પાણી સાથે ઉગ્ર રીતે પ્રક્રિયા કરે છે.
(7) ઍક્વા રીજિયા દ્રાવણ એટલે શું?
ઉત્તર:
સાંદ્ર હાઈડ્રોક્લોરિક ઍસિડ અને સાંદ્ર નાઈટ્રિક ઍસિડનું કદથી 3: 1 પ્રમાણ ધરાવતા તાજા મિશ્રણને ઍક્વા રીજિયા દ્રાવણ કહે છે.
![]()
(8) નિર્જળ કૅલ્શિયમ ક્લોરાઈડ(CaCl2)નો એક ઉપયોગ લખો.
ઉત્તર:
તેનો ઉપયોગ સુકવણીકર્તા (શુદ્ધ) તરીકે થાય છે, કારણ કે તે હવામાંથી ભેજનું અધિશોષણ કરે છે. પરિણામે હવા શુષ્ક બને છે.
(9) પ્રતિક્રિયાત્મકતા (સક્રિયતા) શ્રેણી એટલે શું?
ઉત્તરઃ
જુદી જુદી ધાતુઓને તેમની સક્રિયતા (પ્રતિક્રિયાત્મકતા)ના ઘટતા ક્રમમાં ગોઠવતાં બનતી શ્રેણીને સક્રિયતા શ્રેણી કહે છે.
(10) નિષ્ક્રિય વાયુઓની રાસાયણિક ક્રિયાશીલતા શા માટે . અલ્પ છે?
ઉત્તર:
નિષ્ક્રિય વાયુઓની બાહ્યતમ કક્ષા ઇલેક્ટ્રૉનથી સંપૂર્ણ ભરેલી છે. પરિણામે તેમની સ્થિરતા વધે છે. આથી તે ખૂબ જ અલ્પ રાસાયણિક ક્રિયાશીલતા દર્શાવે છે.
(11) દ્રાવણમાંથી વિદ્યુતનું વહન શેના કારણે હોય છે?
ઉત્તર:
દ્રાવણમાંથી વિદ્યુતનું વહન વીજભારિત કણો(આયનો)ની ગતિશીલતાના કારણે હોય છે.
(12) પૃથ્વીના ભૂપૃષ્ઠમાંથી ધાતુઓ કયા સ્વરૂપે મળે છે?
ઉત્તર:
પૃથ્વીના ભૂપૃષ્ઠમાંથી ધાતુઓ ઑક્સાઈડ, સલ્ફાઈડ કે કાર્બોનેટ સ્વરૂપે મળે છે.
(13) અયસ્ક (કાચી ધાતુ)માંથી ગેંગને દૂર કરવા માટે વપરાતી પદ્ધતિઓનો આધાર શેના પર રહેલો છે?
ઉત્તર:
અયસ્ક (કાચી ધાતુ)માંથી ગેંગને દૂર કરવા માટે વપરાતી 5 પદ્ધતિઓનો આધાર ગેંગ અને કાચી ધાતુના ભૌતિક અથવા રાસાયણિક ગુણધર્મો વચ્ચે રહેલા તફાવત પર રહેલો છે.
(14) વિસ્થાપન પ્રક્રિયાઓ માટે કેવી અને કઈ ધાતુઓ રિડક્શનકર્તા તરીકે વપરાય છે?
ઉત્તર:
ખૂબ જ સક્રિય ધાતુઓ જેવી કે સોડિયમ, કૅલ્શિયમ અને ઍલ્યુમિનિયમ રિડક્શનકર્તા તરીકે વપરાય છે.
(15) કાર્બનનાં બે અપરરૂપોનાં નામ આપો.
ઉત્તરઃ
હીરો અને ગ્રેફાઈટ એ કાર્બનનો અપરરૂપો છે.
પ્રશ્ન 2.
એક શબ્દમાં ઉત્તર આપો :
(1) ધાતુને ટીપીને પાતળાં પતરાં બનાવી શકાય છે. આ ગુણધર્મને શું કહે છે?
ઉત્તરઃ
ટિપાઉપણું
(2) 1g સોનાને કેટલા km લંબાઈના તારમાં ફેરવી શકાય? .
ઉત્તરઃ
2 km
(3) ઉષ્માના નિર્બળ વાહકોનાં બે ઉદાહરણ આપો.
ઉત્તરઃ
સીસું અને પારો
![]()
(4) ફ્લોરિનની બાહ્યતમ કક્ષામાં કેટલા ઇલેક્ટ્રૉન હોય છે?
ઉત્તરઃ
7 ઈલેક્ટ્રૉન
(5) સોડિયમમાંથી સોડિયમ ધનાયન બને ત્યારે કઈ કક્ષામાંથી ઇલેક્ટ્રૉન દૂર થાય છે?
ઉત્તરઃ
M કક્ષા
(6) આયનીય સંયોજનોમાં રહેલા ધનાયનો અને સણાયનો કયા પ્રકારના બળથી જકડાઈ રહે છે?
ઉત્તરઃ
સ્થિર વિદ્યુત આકર્ષણ બળથી
(7) આયનીય સંયોજનોનાં ગલનબિંદુ અને ઉત્કલનબિંદુ કેવાં હોય છે?
ઉત્તરઃ
ઊંચા
(8) દરિયાનું પાણી મુખ્યત્વે કયા દ્રાવ્ય ક્ષારો ધરાવે છે?
ઉત્તરઃ
સોડિયમ ક્લોરાઇડ અને મૅગ્નેશિયમ ક્લોરાઈડ
(9) કઈ ધાતુઓ મુક્ત અવસ્થામાં મળે છે?
ઉત્તરઃ
સોનું, ચાંદી અને પ્લેટિનમ
(10) સિન્નાબારનું સૂત્ર લખો.
ઉત્તરઃ
HgS
(11) છરી વડે કાપી શકાય તેવી ધાતુનું નામ લખો.
ઉત્તરઃ
સોડિયમ (Na)
(12) સોનાને (ગોલ્ડને) ઓગાળવા માટે વપરાતા દ્રાવણનું નામ આપો.
ઉત્તર:
ઍક્વા રીજિયા
![]()
પ્રશ્ન 3.
વ્યાખ્યા આપો :
(1) વિસ્થાપન પ્રક્રિયા
ઉત્તરઃ
જે પ્રક્રિયામાં વધુ સક્રિય ધાતુ તેનાથી ઓછી સક્રિય ધાતુને હું તેના સંયોજનના દ્રાવણમાંથી કે પીગળેલ સ્વરૂપમાંથી વિસ્થાપિત કરે, તો તેવી પ્રક્રિયાને વિસ્થાપન પ્રક્રિયા કહે છે.
(2) વિદ્યુત સંયોજક સંયોજન
ઉત્તરઃ
ધાતુમાંથી અધાતુમાં ઇલેક્ટ્રૉનની આપ-લે દ્વારા નિર્માણ પામતાં સંયોજનોને વિદ્યુતસંયોજક સંયોજન કહે છે.
(3) કાચી ધાતુ (અયસ્ક)
ઉત્તર:
જે ખનિજમાં સારા પ્રમાણમાં નિશ્ચિત ધાતુ હોય અને હું તે ધાતુનું સરળતાથી નિષ્કર્ષણ કરી શકાતું હોય તેવી ખનિજને કાચી ધાતુ કહે છે.
(4) ઍનોડ પંક
ઉત્તરઃ
વિદ્યુતવિભાજનીય શુદ્ધીકરણ પ્રક્રિયામાં ગોલ્ડ, સિલ્વર, પ્લેટિનમ જેવી અદ્રાવ્ય અશુદ્ધિઓ પાત્રના તળિયે કાદવરૂપે જમા (નિક્ષેપિત) થાય છે, જેને ઍનોડ પંક કહે છે.
(5) ક્ષારણ
ઉત્તરઃ
પાણી, હવા અને ભેજના સંપર્કમાં રહેલી ધાતુને કાટ લાગે છે. આ કાટ લાગવાની ક્રિયાને ક્ષારણ કહે છે.
(6) મિશ્રધાતુ
ઉત્તર:
બે કે તેથી વધુ ધાતુઓ અથવા ધાતુ અને અધાતુના સમાગ મિશ્રણને મિશ્રધાતુ કહે છે.
પ્રશ્ન 4.
ખાલી જગ્યા પૂરોઃ
(1) ………………………. ચમકદાર અધાતુ છે.
ઉત્તરઃ
આયોડિન (I2)
(2) હીરો અને ગ્રેફાઈટ ……………………….ના અપરરૂપ છે.
ઉત્તરઃ
કાર્બન
(3) ધાતુઓ ………………….. ઑક્સાઈડ આપે છે.
ઉત્તરઃ
બેઝિક અથવા ઉભયગુણી
(4) કૉપર (II) ઑક્સાઈડ ……………………… રંગનો છે. _
ઉત્તરઃ
કાળા
![]()
(5) સોલ્ડર એ ………………….. અને ……………………… ની મિશ્રધાતુ છે.
ઉત્તરઃ
સીસું (Pb) અને ટિન (Sn)
(6) મિશ્રધાતુની વિદ્યુતવાહકતા અને ગલનબિંદુ શુદ્ધ ધાતુઓ કરતાં ………………………….. હોય છે.
ઉત્તરઃ
ઓછા
(7) સક્રિયતા શ્રેણીમાં તળિયે રહેલી ધાતુઓ સૌથી ………………….. સક્રિય છે.
ઉત્તરઃ
ઓછી
(8) ધાતુમાં રહેલી મોટી માત્રાની અશુદ્ધિઓ જેવી કે માટી, રેતી વગેરેને ……………………. કહે છે.
ઉત્તરઃ
ગેંગ
(9) ધાતુઓને તેમના સંયોજનમાંથી મેળવવાની પદ્ધતિ ……………………… છે.
ઉત્તરઃ
રિડક્શન
(10) મેંગેનીઝ ડાયૉક્સાઈડને ઍલ્યુમિનિયમના ભૂકા સાથે ગરમ કરતાં પ્રવાહી મેંગેનીઝ મળે છે. આ પ્રક્રિયાને ……………………… પ્રક્રિયા કહે છે.
ઉત્તર:
ઉર્મિટ
પ્રશ્ન 5.
નીચેનાં વિધાનો ખરાં છે કે ખોટાં તે જણાવોઃ
(1) બધી જ ધાતુઓની સખતાઈ સમાન હોય છે.
ઉત્તર:
ખોટું
(2) ચાંદી અને કૉપર ઉષ્માના ઉત્તમ વાહકો છે.
ઉત્તર:
ખરું
(3) બ્રોમિન વાયુ છે.
ઉત્તર:
ખોટું
(4) ગ્રેફાઇટ ઉષ્માનું અવાહક છે.
ઉત્તર:
ખોટું
(5) Li, Na અને ભને છરી વડે કાપી શકાય છે.
ઉત્તર:
ખરું
![]()
(6) અધાતુ તત્ત્વો પાણીમાં ઓગળે ત્યારે ઍસિડિક ઑક્સાઇડ ઉત્પન્ન કરે છે.
ઉત્તર:
ખરું
(7) મૅગ્નેશિયમ હવામાં ઝગારા મારતી વાદળી જ્યોત સાથે સળગે છે.
ઉત્તર:
ખોટું
(8) મૅગ્નેશિયમ એ સોડિયમ કરતાં ઓછી પ્રતિક્રિયાત્મક છે.
ઉત્તર:
ખરું
(9) એલ્યુમિનિયમ ધાતુ ઠંડા કે ગરમ પાણી સાથે પ્રક્રિયા કરતી નથી, પરંતુ તે બાષ્પ સાથે પ્રક્રિયા કરી ધાતુ-ઑક્સાઇડ અને હાઇડ્રોજન બનાવે છે.
ઉત્તર:
ખરું
(10) ઍક્વા રીજિયા દ્રાવણમાં સોનું કે પ્લેટિનમ ઓળગતા નથી.
ઉત્તર:
ખોટું
(11) પ્રતિક્રિયાત્મકતા Mg > Al > Znના ક્રમમાં ઘટે છે.
ઉત્તર:
ખરું
(12) કૉપર મંદ HCl સાથે પ્રક્રિયા કરે છે.
ઉત્તર:
ખોટું
(13) મેગ્નેશિયમ ક્લોરાઇડમાં બે આયનીય બંધ હોય છે.
ઉત્તર:
ખરું
(14) ઇલેક્ટ્રૉનની આપ-લે દ્વારા બનતાં સંયોજનો આયનીય સંયોજનો ઉપરાંત વિદ્યુતસંયોજક સંયોજનોનાં નામે પણ ઓળખાય છે.
ઉત્તર:
ખરું
(15) વિદ્યુતસંયોજક સંયોજનો કેરોસીન અને પેટ્રોલમાં દ્રાવ્ય હોય છે.
ઉત્તરઃ
ખોટું
પ્રશ્ન 6.
નીચે આપેલી પ્રક્રિયાઓ પૂર્ણ કરો:
(1) 2Cu + O2 →
ઉત્તરઃ
2CuO(s)
(2) 4Al + 3O2 →
ઉત્તરઃ
2Al2O3(s)
(3) Al2O3 + 6HCl →
ઉત્તરઃ
2AlCl3(aq) + 3H2O(l)
(4) Al2O3 + 2NaOH →
ઉત્તરઃ
2NaAlO2(aq) + H2O(l)
(5) K2O(s) + H2O(l) →
ઉત્તરઃ
2KOH(aq)
(6) Ca(s) + 2H2O →
ઉત્તરઃ
Ca(OH)2(aq) + H2(g)
![]()
( 7) 2HgS(s) + 3O2(g) → ![]()
ઉત્તરઃ
2HgO(s) + 2SO2(g)
(8) 2Cu2O + Cu2S ![]()
ઉત્તરઃ
6Cu(s) + SO2(g)
(9) ZnO(s) + C(s) →
ઉત્તરઃ
Zn(s) + CO(g)
(10) Fe2O3(s) + 2Al(s) ![]()
ઉત્તરઃ
2Fe(l) + Al2O3(s) + ઉષ્મા
(11) 2Pbs(s) + 3O2(g) →
ઉત્તરઃ
2PbO(s) + 2SO2(g)
(12) Cr2O3(s) + 2Al(s) ![]()
ઉત્તરઃ
2Cr(l) + Al2O3(s) + ઉષ્મા
(13) 3Fe(s) + 4H2O(g) →
ઉત્તરઃ
Fe3O4(s) + 4H2(g)
(14) CO(g) + H2O(g) →
ઉત્તરઃ
CO2(g) + H2(g)
(15) 3NO2(g) + H2O(l) →
ઉત્તરઃ
2HNO3(aq) + NO(g)
પ્રશ્ન 7.
નીચેના દરેક પ્રશ્ન માટે આપેલા વિકલ્પોમાંથી સાચો છે વિકલ્પ પસંદ કરી ઉત્તર લખોઃ
1. નીચેનામાંથી મિશ્રધાતુ કઈ છે?
A. બ્રાસ
B. બ્રૉન્ગ
C. સ્ટીલ
D. આપેલ તમામ
ઉત્તરઃ
D. આપેલ તમામ
![]()
2. લોહસ્તંભની ઊંચાઈ અને વજન અનુક્રમે કેટલું છે?
A. 8m, 6 ટન
B. 6 m, 8 ટન
C. 6 m, 6 ટન
D. 8m, 8 ટન
ઉત્તરઃ
A. 8m, 6 ટન
3. સૌથી વધુ ટીપી શકાય તેવી ધાતુ કઈ છે?
A સોનું
B. સીસું
C. A અને B બને
D. આપેલ પૈકી એક પણ નહિ ?
ઉત્તરઃ
A સોનું
4. ઉખાના ઉત્તમ વાહકો તરીકે કઈ ધાતુ ઉપયોગી નથી?
A. ચાંદી
B. કૉપર
C. સીસું
D. આપેલ તમામ
ઉત્તરઃ
C. સીસું
5. વિદ્યુત તાર ઉપર શેનું અસ્તર લગાવેલ હોય છે?
A. DDT
B. PVC
C. PTFE
D. PAN
ઉત્તરઃ
B. PVC
6. ઓરડાના તાપમાને કઈ ધાતુ પ્રવાહી સ્વરૂપમાં અસ્તિત્વ ધરાવે છે?
A. પારો
B. બ્રોમિન
C. સોડિયમ
D. કેલ્શિયમ
ઉત્તરઃ
A. પારો
7. કાર્બનનું કયું અપરરૂપ સૌથી સખત કુદરતી પદાર્થ તરીકે જાણીતું છે?
A. ગ્રેફાઇટ
B. હીરો
C. કોક
D. કાર્બન બ્લેક
ઉત્તરઃ
B. હીરો
8. મોટા ભાગના ધાતુ-ઑક્સાઇડ પાણીમાં કેવા હોય છે?
A. દ્રાવ્ય
B. અદ્રાવ્ય
C. અલ્પ દ્રાવ્ય
D. સુદ્રાવ્ય
ઉત્તરઃ
B. અદ્રાવ્ય
9. A ને હવાના સંપર્કમાં લાવતાં તેની ઉપર કોનું પડ લાગે છે? .
A. Al3O2
B. Al2O3
C. AlO
D. AlN
ઉત્તરઃ
B. Al2O3
10. HNOનું રિડકશન નીચેનામાંથી શેમાં થાય છે?
A. NO
B. NO2
C. N20
D. આપેલ તમામ
ઉત્તરઃ
D. આપેલ તમામ
11. નીચેના પૈકી કઈ પ્રક્રિયાને ભૂંજન કહે છે?
A. ZnCO3(s) ![]() ZnO(s) + CO2(g)
ZnO(s) + CO2(g)
B. 2ZnS(s) + 3O2(g) ![]() 2ZnO(s) + 2SO2(g)
2ZnO(s) + 2SO2(g)
C. ZnO(s) + C(s) ![]() Zn(s) + CO(g)
Zn(s) + CO(g)
D. Zn(s) + H2O(g) ![]() ZnO(s) + H2(g)
ZnO(s) + H2(g)
ઉત્તરઃ
B. 2ZnS(s) + 3O2(g) ![]() 2ZnO(s) + 2SO2(g)
2ZnO(s) + 2SO2(g)
12. કઈ પ્રક્રિયા દરમિયાન સામાન્ય સંજોગોમાં ડાયહાઇડ્રોજન વાયુ ઉત્પન્ન થતો નથી?
A. ધાતુ + મંદ સક્યુરિક ઍસિડ
B. ધાતુ + મંદ હાઇડ્રોક્લોરિક ઍસિડ
C. ધાતુ + મંદ નાઈટ્રિક ઍસિડ
D. ધાતુ + પાણી
ઉત્તરઃ
D. ધાતુ + પાણી
![]()
13. નીચેના પૈકી શામાં વિસ્થાપન પ્રક્રિયા શક્ય છે?
A. NaCl નું દ્રાવણ + તાંબાનો સિક્કો
B. MgCl2 નું દ્રાવણ + ઍલ્યુમિનિયમનો સિક્કો
C. FeSO4 નું દ્રાવણ + ચાંદીનો સિક્કો
D. AgNO3નું દ્રાવણ + તાંબાનો સિક્કો
ઉત્તરઃ
D. AgNO3નું દ્રાવણ + તાંબાનો સિક્કો
14. નીચેના પૈકી કઈ પ્રક્રિયા શક્ય નથી?
A. Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
B. Zn(s) + FeSO4(aq) → ZnSO4(aq) + Fe(s)
C. Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
D. Cu(s) + FeSO4(aq) → CuSO4(aq) + Fe(s)
ઉત્તરઃ
D. Cu(s) + FeSO4(aq) → CuSO4(aq) + Fe(s)
15. નીચેના પૈકી કયું વિધાન ખોટું છે?
A. લોખંડનું ક્ષારણ હવા અને પાણીના સંપર્કથી થાય છે.
B. ધાતુનાં ગલનબિંદુ અને ઉત્કલનબિંદુ નીચાં હોય છે.
C. કાર્બોનેટયુક્ત કાચી ધાતુને ધાતુ-ઑક્સાઇડમાં રૂપાંતર કરવાની , પદ્ધતિને કૅલ્સિનેશન કહે છે.
D. ઓછી સક્રિય ધાતુનું તેના ક્ષારના દ્રાવણમાંથી વધુ સક્રિય ધાતુ વડે વિસ્થાપન થાય છે.
ઉત્તર:
B. ધાતુનાં ગલનબિંદુ અને ઉત્કલનબિંદુ નીચાં હોય છે.
મૂલ્યો આધારિત પ્રજ્ઞોત્તર (Value Based Questions with Answers)
પ્રશ્ન 1.
અરવિંદે શાળાના સભાખંડમાં “ભારે ધાતુઓનો ઉપયોગ કેવી રીતે ઘટાડી શકાય” તે વિષય પર પ્રવચન આપ્યું. તેણે જણાવ્યું કે પારો ધરાવતું થરમૉમિટર જ્યારે તૂટે અને તેને નકામા કચરામાં ફેંકવામાં આવે ત્યારે કેવી રીતે તે જમીન અને જમીન તળના પાણીને પ્રદૂષિત કરે છે. વધુમાં તેણે દર્શાવ્યું કે કૅમિયમ અને લેડ કેવી રીતે આરોગ્ય માટે ખતરનાક સમસ્યાઓ સર્જી શકે છે.
- મોબાઇલની બૅટરીમાં રહેલી બે ભારે ધાતુનાં નામ આપો.
- જો આહારશૃંખલામાં મરક્યુરી પ્રવેશે ત્યારે તેના લીધે કયો રોગ થાય છે?
- ઉપરોક્ત કાર્યમાં અરવિંદના કયા ગુણો પ્રદર્શિત થાય છે?
ઉત્તર:
- મોબાઇલની બૅટરીમાં રહેલી બે ભારે ધાતુઓ લેડ અને કૅમિયમ છે.
- મરક્યુરીના લીધે મીનામાટા રોગ થાય છે.
- અહીં અરવિંદમાં સહકારની ભાવનાની શીખ, કુદરતની સંભાળ અને જવાબદાર નાગરિક તરીકેની વર્તણૂકના ગુણ પ્રદર્શિત થાય છે.
પ્રશ્ન 2.
એક ઝવેરી 22 કેરેટ સોનાના દાગીના બનાવે છે અને તેના ગ્રાહકો પાસેથી 24 કેરેટ સોનાનો ભાવ વસૂલે છે. તેનો વ્યવસાય આ વ્યવહારને લીધે વધે છે.
- આપણે શા માટે 24 કેરેટ સોનાના દાગીના બનાવી શકતા નથી?
- સોનાના દાગીનાની બનાવટમાં ઉમેરી શકાય તેવી બે ધાતુઓનાં નામ આપો.
- ઝવેરીની આ વર્તણૂકમાં તેનો કયો દુર્ગુણ જોવા મળે છે?
ઉત્તર:
- 24 કેરેટ સોનું ખૂબ જ નરમ હોય છે. આથી 24 કેરેટ સોનામાંથી બનાવેલા ઘગીનાનો આકાર દબાણને લીધે બદલાઈ જાય છે. આથી 24 કેરેટ સોનામાંથી દાગીના બનાવવા એ સલાહભર્યું નથી.
- સોનાને મજબૂત બનાવવા માટે તેમાં કૉપર અને સિલ્વર ઉમેરી શકાય છે.
- ઝવેરીની આ વર્તણૂકમાં તેનો વ્યવસાયવૃત્તિ પ્રત્યેનો લોભ જોવા મળે છે.
પ્રશ્ન 3.
નમને તેના મિત્રને સાઈકલ ચલાવતો જોયો. તેણે જોયું કે, સાઈકલના પેડલની ધાર પર કાટ લાગેલો. તેણે મિત્રને સલાહ આપી કે તે પેડલનું પુનઃસંધાન કરી અને તેના પર તૈલીરંગનું આવરણ લગાડે.
- લોખંડને શા માટે કાટ લાગે છે?
- કાટને અટકાવવાના બે ઉપાયો જણાવો.
- ઉપરોક્ત કાર્યમાં નમનનો કયો ગુણ જોવા મળે છે?
ઉત્તર:
- લોખંડ જ્યારે હવા અને ભેજના સંપર્કમાં આવે ત્યારે રાસાયણિક ફેરફારો થવાને લીધે કાટ લાગે છે.
- કાટને અટકાવવાના બે ઉપાયો
- લોખંડ પર રંગ કરો.
- લોખંડ પર ગ્રીઝ કે તેલ લગાવો.
- નમનમાં જાગરૂકતા, બુદ્ધિમત્તા અને મદદરૂપ સ્વભાવનો ગુણ જોવા મળે છે.
પ્રાયોગિક કૌશલ્યો આધારિત પ્રશ્નોત્તર (Practical Skill Based Questions with Answers)
પ્રશ્ન 1.
પ્રયોગશાળામાં સક્રિયતા શ્રેણીના પ્રયોગ દરમિયાન આવશ્યક એવાં , સલામતીનાં ચાર પગલાં જણાવો.
ઉત્તર:
- ધાતુઓ અથવા અન્ય રસાયણો ચામડીના સંપર્કમાં ન આવવા જોઈએ.
- પ્રયોગ દરમિયાન ઉદ્ભવતો ધુમાડો અથવા વાયુ શ્વસનમાં ન જવો જોઈએ.
- કોઈ પણ રસાયણ અથવા દ્રવ્યની સ્વાદ પરખ ના કરવી જોઈએ.
- રસાયણોનો ઉપયોગ કરતી વખતે સલામતી માટે ગોગલ્સ, હાથમોજાં અને એમનનો ઉપયોગ કરવો જોઈએ.
![]()
પ્રશ્ન 2.
તમે પ્રયોગશાળામાં આયર્ન સલ્ફટ, કૉપર સલ્ફટ અને બેરિયમ સલ્ફટને કેવી રીતે ઓળખશો?
ઉત્તર:
રંગ પરથી ઓળખી શકાય. જેમ કે, આયર્ન સલ્ફટ લીલા રંગનો, કૉપર સલ્ફટ વાદળી રંગનો અને બેરિયમ સલ્ફટ સફેદ રંગનો હોય છે.
પ્રશ્ન 3.
સફેદ રંગના ત્રણ ધાતુના ક્ષારોનાં નામ અને અણુસૂત્રો લખો.
ઉત્તરઃ
- ઝિંક સલ્ફટ (ZnSO4)
- મૅગ્નેશિયમ સલ્ફટ (MgSO4)
- ઍલ્યુમિનિયમ સલ્ફટ (Al2(SO4)3) ઉપરોક્ત ત્રણેય ધાતુક્ષારો સફેદ રંગના છે.
પ્રશ્ન 4.
એક વિદ્યાર્થી પ્રયોગશાળામાં પ્રયોગ કરતી વખતે કોપર સલ્લેટનું દ્રાવણ ભરેલી કસનળીમાં લોખંડની ચમચી મૂકી દે છે. તેણે બીજા દિવસે શું અવલોકન કર્યું?
ઉત્તર:
વિદ્યાર્થીએ બીજા દિવસે અવલોકન કર્યું કે કૉપર સલ્ફટના દ્રાવણનો વાદળી રંગ બદલાઈને લીલો થયો છે અને લોખંડની ચમચી જેટલી દ્રાવણમાં ડૂબેલી હતી, તેટલા ભાગ પર કથ્થાઈ રંગની ધાતુનું આવરણ લાગેલું જોયું.
![]()
પ્રશ્ન 5.
પ્રયોગશાળાના સહાયકે ત્રણ દ્રાવણો ઝિંક સલ્ફટ, મૅગ્નેશિયમ સલ્ફટ અને ઍલ્યુમિનિયમ સલ્ફટ બનાવ્યાં. પરંતુ દ્રાવણોની શીશી પર નામનિર્દેશ કરવાનું ભૂલી ગયો. આપ જે-તે દ્રાવણની શીશી પર ધાતુની સક્રિયતાના અભ્યાસ પરથી કેવી રીતે નામનિર્દેશ કરશો?
ઉત્તર:
ત્રણ શીશી લઈ, તેમાં બનાવેલ જુદાં જુદાં દ્રાવણ લો. મૅગ્નેશિયમ ધાતુનો નાનો ટુકડો તેમાં નાખો. જે શીશીમાં પ્રક્રિયા થતી નથી, તે દ્રાવણ મૅગ્નેશિયમ સલ્ફટ હશે. તે જ રીતે અન્ય બે દ્રાવણોની ઓળખ માટે, બંને દ્રાવણો બે જુદી જુદી શીશીમાં લઈ, તેમાં ઍલ્યુમિનિયમ ધાતુનો ટુકડો નાખો. જે શીશીમાં પ્રક્રિયા થતી નથી, તે ઍલ્યુમિનિયમ સલ્ફટ ધરાવે છે અને અન્ય શીશીમાં ઝિંક સલ્ફટ હશે. આમ, ધાતુની સક્રિયતાના અભ્યાસ પરથી શીશી પર નામનિર્દેશ કરી શકાય.
Memory Map