Gujarat Board GSEB Textbook Solutions Class 12 Chemistry Chapter 5 પૃષ્ઠ રસાયણ Textbook Questions and Answers.
Gujarat Board Textbook Solutions Class 12 Chemistry Chapter 5 પૃષ્ઠ રસાયણ
GSEB Class 12 Chemistry પૃષ્ઠ રસાયણ Text Book Questions and Answers
પ્રશ્ન 1.
અધિશોષણ અને અવશોષણ પર્યાયોના અર્થને વિભેદિત કરો. દરેકનું એક ઉદાહરણ આપો.
ઉત્તર:
આણ્વીય સ્પિસીઝનું ઘન અથવા પ્રવાહીના જથ્થા કરતાં તેની સપાટી પર વધારે એકઠા થવાને અધિશોષણ પર્યાયથી ઓળખાય છે. આ આણ્વીય સ્પિસીઝ અથવા પદાર્થ જે સપાટી પર સંકેન્દ્રિત થાય છે તેને અધિશોષિત કહે છે અને જે પદાર્થની સપાટી પર એકઠા થાય છે અને અધિશોષણ કરે છે તેને અધિશોષક કહે છે. ઉદાહરણ તરીકે, જ્યારે ચાકના ટુકડાને શાહીમાં ડૂબાડવામાં આવે તો તેની સપાટી શાહીનો રંગ જાળવી રાખે છે જે રંગીન પદાર્થના અધિશોષણને કારણે છે. જ્યારે દ્રાવક ચાકના ટુકડાની અંદર ઊંડે સુધી અવશોષણને લીધે પ્રસરી જાય છે. ચાકના ટુકડાને તોડતાં જણાય છે કે તે અંદરની બાજુએ સફેદ છે.
પ્રશ્ન 2.
ભૌતિક અધિશોષણ અને રાસાયણિક અધિશોષણ વચ્ચે શું તફાવતો છે ?
ઉત્તર:
| ભૌતિક અધિશોષણ | રાસાયણિક અધિશોષણ |
| (1) તે વાન ડર વાલ્સ બળોના કારણે ઉદ્ભવે છે. | (1) તે રાસાયણિક બંધ રચનાના કારણે ઉદ્ભવે છે. |
| (2) તે સ્વભાવે વિશિષ્ટ નથી. | (2) તે સ્વભાવે ખૂબ જ વિશિષ્ટ છે. |
| (3) તે સ્વભાવે પ્રતિવર્તી છે. | (3) તે સ્વભાવે અપ્રતિવર્તી છે. |
| (4) તે વાયુના સ્વભાવ પર આધાર રાખે છે. સહેલાઈથી પ્રવાહીકૃત કરી શકાતા વાયુઓ ઝડપથી અધિશોષિત થાય છે. | (4) તે પણ વાયુના સ્વભાવ પર આધાર રાખે છે જે વાયુઓ અધિશોષક સાથે પ્રક્રિયા કરી શકે છે તે રાસાયણિક અધિશોષણ દર્શાવે છે. |
| (5) આ કિસ્સામાં અધિશોષણની ઍન્થાલ્પી નીચી (20-40 kJ/mol-1) છે. | (5) આ કિસ્સામાં અધિશોષણની ઍન્થાલ્પી ઊંચી (80-240 kJ mol-1) છે. |
| (6) નીચું તાપમાન અધિશોષણ માટે ફાયદાકારક છે તે તાપમાનના વધારા સાથે ઘટે છે. | (6) ઊંચું તાપમાન અધિશોષણ માટે ફાયદાકારક છે. તે તાપમાનના વધારા સાથે વધે છે. |
| (7) કોઈ ખાસ ચોક્કસ સક્રિયકરણ ઊર્જાની જરૂર પડતી નથી. | (7) કેટલીક વખત ઊંચી સક્રિયકરણ ઊર્જાની જરૂર પડે છે. |
| (8) તે સપાટી ક્ષેત્રફળ પર આધાર રાખે છે. સપાટી ક્ષેત્રફળના વધારા સાથે વધે છે. | (8) તે પણ સપાટી ક્ષેત્રફળ પર આધાર રાખે છે. વળી, તે સપાટી ક્ષેત્રફળના વધારા સાથે વધે છે. |
| (9) ઊંચા દબાણે તે અધિશોષક સપાટી પર બહુ આણ્વિય સ્તરોમાં પરિણમે છે. | (9) તે એક આણ્વિય સ્તરમાં પરિણમે છે. |
![]()
પ્રશ્ન 3.
ઝીણો ભૂકા રૂપ પદાર્થ અધિશોષક તરીકે વધારે અસરકારક શા માટે હોય છે ? તેનું કારણ આપો.
ઉત્તર:
- અધિશોષણ ઉદ્ભવવાનું કારણ એ હકીકત છે તે અધિશોષકની સપાટી પરના કણો જથ્થામાં રહેલા કોની જેમ એકસરખા પર્યાવરણમાં હોતા નથી. અધિશોષકમાં કણો વચ્ચે લાગુ પડતું બળ એકબીજાથી સમતોલિત હોય છે પણ સપાટી પરના કણો બધી બાજુએથી તેમના પ્રકારના અણુઓ કે પરમાણુઓ વડે ઘેરાયેલા હોતા નથી અને તે અસમતોલિત અથવા અવશેષી (residual) આકર્ષણ બળો ધરાવે છે.
- અધિશોષકના આ બળો સપાટી પર અધિશોષિતના અણુઓને આકર્ષવા માટે જવાબદાર છે. આપેલ તાપમાન અને દબાણે અધિશોષકના એકમ દળની સપાટીના ક્ષેત્રફળના વધારા સાથે અધિશોષણ વધે છે.
- અધિશોષણનું અગત્યનું બીજું પરિબળ જે અધિશોષણને ખાસિયત આપે છે તે અધિશોષણ ઉષ્મા છે. અધિશોષણ દરમિયાન હંમેશાં સપાટીના અવશેષી બળો ઘટે છે એટલે કે પૃષ્ઠ ઊર્જામાં ઘટાડો થાય છે જે ઉષ્મા રૂપે દશ્યમાન થાય છે. એટલા માટે અધિશોષણ હંમેશાં ઉષ્માક્ષેપક પ્રક્રિયા છે. આમ, અધિશોષણ પ્રણાલીની ઍન્થાલ્પી અને ઍન્ડ્રૉપીમાં ઘટાડા સાથે સંકળાયેલ છે.
- કોઈ પણ પ્રક્રિયાને સ્વયંસ્ફુરિત થવા માટે ઉષ્માગતિશાસ્ત્રીય જરૂરિયાત છે કે આપેલ તાપમાન અને દબાણે ΔG ઋણ હોવી જોઈએ એટલે કે ગિબ્સ ઊર્જામાં ઘટાડો હોવો જોઈએ.
- ΔG = ΔH – TΔS સમીકરણ મુજબ, જો ΔHનું મૂલ્ય પૂરતા પ્રમાણમાં ઘણું ઋણ હોવું જોઈએ કે જેથી ΔG ઋણ બને કારણ કે
- TΔS ધન હોય છે.
- આમ, અધિશોષણ પ્રક્રિયામાં જે સ્વયંસ્ફુરિત છે તેમાં ધન છે. આ બે ફેરફારોનું સંયોગીકરણ ΔGને ઋણ બનાવે છે. જેમ અધિશોષણ આગળ વધે છે, તેમ ΔH ઓછી થતી જાય છે અને ઓછી ઋણ થતી જાય છે. અંતમાં ΔH, TΔS બરાબર થશે અને ΔG શૂન્ય થશે. આ અવસ્થાએ સંતુલન પ્રાપ્ત થશે.
પ્રશ્ન 4.
ઘન ઉપર વાયુના અધિશોષણને અસર કરતાં પરિબળો કયા છે ?
ઉત્તર:
- વાયુનો સ્વભાવ : સરળતાથી પ્રવાહીકરણ પામતા વાયુઓ જેવાં કે NH3 HCl એ વધારે પ્રમાણમાં અધિશોષિત થાય છે. જયારે કે શુદ્ધ વાયુઓ જેવા કે H2O2 ઓછા પ્રમાણમાં અધિશોષિત થાય છે, કારણ કે NH3 અને HClમાં H2 અને O2 કરતાં વધારે પ્રબળ વાન ડર વાલ્સ બળો રહેલા હોય છે, જે સહેલાઈથી પ્રવાહીકરણ પામવામાં મદદરૂપ હોય છે.
- ઘન પદાર્થની સપાટીનું ક્ષેત્રફળ : અધિશોષકની સપાટીનું ક્ષેત્રફળ જેટલું વધારે, તેટલો વધારે વાયુ તેની સપાટી પર અધિશોષિત થાય છે.
- તાપમાનની અસર : અધિશોષણ એ ઉષ્માક્ષેપક પ્રક્રિયા છે. આથી, લ-શૈટેલિયરના સિદ્ધાંત મુજબ તાપમાન વધારતાં અધિશોષણનું પ્રમાણ ઘટે છે.
- દબાણની અસર : અધિશોષણ એ પ્રતિવર્તી પ્રક્રિયા છે અને દબાણના વધારા સાથે વધે છે.
પ્રશ્ન 5.
અધિશોષણ સમતાપ વક્ર શું છે ? ક્રુન્ડલીચ અધિશોષણ સમતાપ વક્ર વર્ણવો.
ઉત્તર:
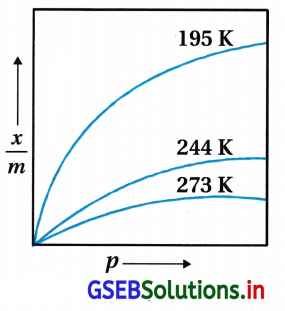
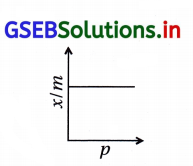
- ફ્રેન્ડલીચે, 1909માં કોઈ ખાસ તાપમાને ઘન અધિશોષકના એકમ દળ વડે અધિશોષિત થતાં વાયુ અને દબાણ વચ્ચેનો પ્રમાણસૂચક (empirical) સંબંધ આપ્યો. આ સંબંધ નીચેના સમીકરણથી અભિવ્યક્ત કરી શકાય :
\(\frac{x}{m}=k \cdot p^{\frac{1}{n}}\) (n>1) ………. (1) - જ્યાં x, p દબાણે અધિશોષકના m દળ પર અધિશોષિત વાયુનું દળ છે અને k તથા n અચળાંક છે જે કોઈ ખાસ તાપમાને અધિશોષક અને વાયુના સ્વભાવ પર આધાર રાખે છે. સામાન્ય રીતે આ સંબંધ વક્ર તરીકે રજૂ કરવામાં આવે છે. જ્યાં અધિશોષકના પ્રતિગ્રામે અધિશોષિત વાયુના દળનો દબાણ વિરુદ્ધ આલેખ દોરવામાં આવે છે. (જુઓ આકૃતિ) આ વક્રો સૂચવે છે કે ચોક્કસ દબાણે તાપમાનના વધારા સાથે ભૌતિક અધિશોષણમાં ઘટાડો થાય છે. આ વક્રો હંમેશાં ઊંચા દબાણે સંતૃપ્તતાને પહોંચતા જણાય છે.
- સમીકરણ-1નો ઘાતાંક લેતાં,
log \(\frac{x}{m}\) = log k + \(\frac{1}{n}\) log p …………… (2) - ફ્રેન્ડલીચની સમતાપ વક્રની યથાર્થતા Y-ધરી (કોટી) પર log\(\frac{x}{m}\) અને log p ને X-ધરી (યામ) પર લઈને ગ્રાફ દોરીને ખાતરી કરી શકાય છે. જો તે સીધી રેખા મળે તો ફ્રેન્ડલીચ સમીકરણ યથાર્થ છે નહિ તો નથી. સીધી રેખાનો ઢાળ \(\frac{1}{n}\) નું મૂલ્ય આપે છે. આકૃતિમાં Y-ધરી પર આંતર્ભેદ log નું મૂલ્ય આપે છે.
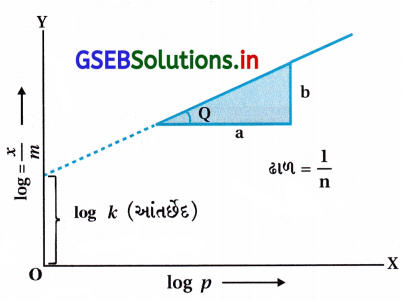
- ફ્રેન્ડલીચ સમતાપ વક્ર અધિશોષણની આશરા પડતી વર્તણૂક સમજાવે છે. \(\frac{1}{n}\) નું 0 અને 1ની વચ્ચે મૂલ્ય (સંભવિત વિસ્તાર 0.1થી 0.5) હોય છે. સમીકરણ-2 દબાણના સીમિત વિસ્તાર પૂરતું વાજબી જણાય છે.
- જ્યારે \(\frac{1}{n}\) = 0, ત્યારે \(\frac{x}{m}\) અચળાંક એટલે કે અધિશોષણ દબાણથી સ્વતંત્ર છે. જ્યારે \(\frac{1}{n}\) = 1, \(\frac{x}{m}\) = kp એટલે કે \(\frac{x}{m}\) ∝ p એટલે કે અધિશોષણ દબાણના સમપ્રમાણમાં છે.
- બંને શરતોને પ્રાયોગિક પરિણામો દ્વારા ટેકો મળેલ છે. પ્રાયોગિક સમતાપ રેખા હંમેશાં ઊંચા દબાણે સંતૃપ્તતાએ પહોંચે છે. આ ફ્રેન્ડલીચના અધિશોષણ સમતાપ રેખાથી સમજાવી શકાય નહીં. આથી તે ઊંચા દબાણે નિષ્ફળ નીવડે છે.
પ્રશ્ન 6.
અધિશોષકના સક્રિયકરણથી તમે શું સમજો છો ? તે કેવી રીતે મેળવી શકાય છે ?
ઉત્તર:
અધિશોષકના સક્રિયકરણથી અધિશોષકની અધિશોષણ ક્રિયા કરવાની ક્ષમતા વધારી શકાય છે. અધિશોષકને નીચેની પ્રક્રિયા દ્વારા વધારે સક્રિય કરી શકાય છે.
(i) અધિશોષકના સપાટીના ક્ષેત્રફળમાં વધારો કરવાથી અધિશોષણની માત્રા વધે છે. આમ કરવા માટે અધિશોષકને નાના નાના ટુકડા અથવા પાઉડર સ્વરૂપમાં ફેરવવામાં આવે છે.
(ii) કેટલીક વિશિષ્ટ પ્રક્રિયાઓ દ્વારા પણ અધિશોષકને સક્રિય કરી શકાય છે. દા.ત., લાકડામાંથી બનતા કોલસાને વધારે સક્રિય કરવા માટે તેને 650K થી 1330K તાપમાને હવામાં ગરમ કરવામાં આવે છે. આમ કરવાથી તેના પર અધિશોષિત થયેલા વાયુઓ દૂર થાય છે, અને નવા અધિશોષિતને દાખલ થવા માટે જગ્યા મળે છે.
![]()
પ્રશ્ન 7.
વિષમાંગ ઉદ્દીપનમાં અધિશોષણ શું ભાગ ભજવે છે ?
ઉત્તર:
- આ સિદ્ધાંત વિષમાંગ સંતુલનની ક્રિયાવિધિ સમજાવે છે. જુનો સિદ્ધાંત ઉદ્દીપનના અધિશોષણ સિદ્ધાંત તરીકે જાણીતો છે. જેમાં એમ ગણવામાં આવતું હતું કે વાયુમય અવસ્થા અથવા દ્રાવણમાંના પ્રક્રિયકો ઘન ઉદ્દીપકની સપાટી પર અધિશોષિત થાય છે.
- સપાટી પર પ્રક્રિયકોની સાંદ્રતામાં વધારો પ્રક્રિયાવેગ વધારે છે. અધિશોષણ ઉષ્માક્ષેપક પ્રક્રિયા હોવાથી અધિશોષણ ઉષ્માનો ઉપયોગ પ્રક્રિયાનો વેગ વધારવામાં થાય છે.
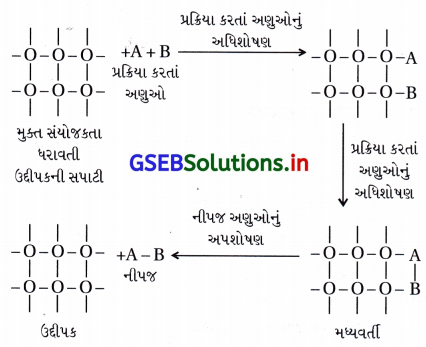
- આધુનિક અધિશોષણ સિદ્ધાંત મધ્યવર્તી સંયોજનના નિર્માણનો સિદ્ધાંત અને જુના અધિશોષણ સિદ્ધાંતનું સંયોગીકરણ છે. ઉદ્દીપિત સક્રિયતા ઉદ્દીપકની સપાટી પર સ્થાનીકૃત થાય છે. આ ક્રિયાવિધિ પાંચ સોપાનોનો સમાવેશ કરે છે :
(i) પ્રક્રિયકોનું ઉદ્દીપકની સપાટી તરફનું પ્રસરણ.
(ii) ઉદ્દીપકની સપાટી પર પ્રક્રિયક અણુઓનું અધિશોષણ
(iii) મધ્યવર્તી સંયોજનના નિર્માણ દ્વારા ઉદ્દીપકની સપાટી પર રાસાયણિક પ્રક્રિયાઓનું થવું.
(iv) ઉદ્દીપક સપાટી પરથી પ્રક્રિયા નીપજનું અપશોષણ અને તેને પરિણામે ફરીથી સપાટીની પ્રાપ્તિ જેથી વધુ પ્રક્રિયા થઈ શકે.
(v) પ્રક્રિયા નીપજનું ઉદ્દીપકની સપાટીથી દૂર પ્રસરણ થવું. - ઉદ્દીપકની સપાટી પર અંદરના જથ્થા કરતાં મુક્ત સંયોજકતાઓ અણુઓ હોય છે જે રાસાયણિક આકર્ષણ બળોને ગોઠવાઈ જવા માટે સ્થાન આપે છે. આવી સપાટીના સંપર્કમાં જ્યારે વાયુ આવે છે ત્યારે નિર્બળ રાસાયણિક સંયોગીકરણને કારણે એકસાથે ત્યાં ગોઠવાય છે. જો જુદા જુદા અણુઓ બાજુ બાજુમાં અધિશોષિત થયેલા હોય તો, તેઓ એકબીજા સાથે પ્રક્રિયા કરે જેને પરિણામે નવા અણુઓનું નિર્માણ થાય છે.
- આમ, રચાયેલાં અણુઓ સપાટી પરથી બાષ્પીભવન પામે જેથી તાજા પ્રક્રિયક અણુઓને સપાટી પૂરી પાડે.
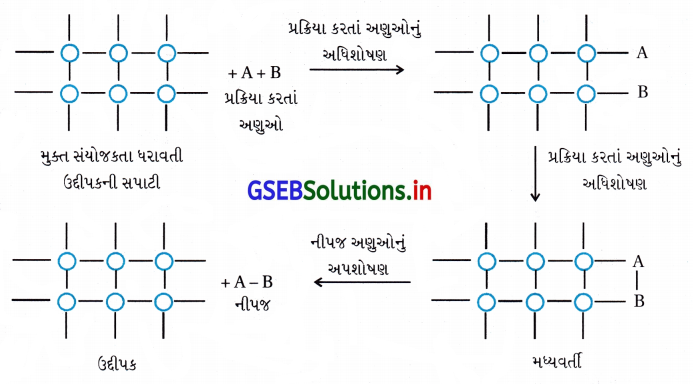
- આ સિદ્ધાંત સમજાવે છે કે પ્રક્રિયાને અંતે ઉદ્દીપકના દળમાં અને રાસાયણિક સંઘટનમાં ફેરફાર થતો નથી, અને તે અલ્પપ્રમાણમાં હોવા છતાં અસરકારક રહે છે. તેમ છતાં પણ આ સિદ્ધાંત ઉદ્દીપકીય પ્રવર્ધકો અને ઉદ્દીપકીય વિષના કાર્યને સમજાવી શકતા નથી.
પ્રશ્ન 8.
અધિશોષણ શા માટે હંમેશાં ઉષ્માક્ષેપક હોય છે ?
ઉત્તર:
- ‘અધિશોષણ હંમેશાં ઉષ્માક્ષેપક હોય છે.’ આ વિધાન નીચે પ્રમાણે બન્ને પદ્ધતિથી સમજાવી શકાય.
(i) અધિશોષણ ક્રિયાના કારણે અધિશોષકની સપાટી પરના અવશેષીય બળોના મૂલ્યમાં ઘટાડો થાય છે. આમ, કહી શકાય કે અધિશોષણ ઉષ્માક્ષેપક પ્રક્રિયા છે.
(ii) અધિશોષણ માટે હંમેશાં ΔHનું મૂલ્ય ઋણ મળે છે. જ્યારે વાયુમય અધિશોષિતનું ઘન અધિશોષક પર અધિશોષણ થાય, ત્યારે હંમેશાં વાયુની ઍન્ડ્રૉપીમાં ઘટાડો થાય છે. આથી, ΔS પણ ઋણ બને છે. આમ, આ પ્રક્રિયા સ્વયંસ્ફુરિત હોવાથી ΔG પણ ઋણ બને છે.
∴ ΔG = ΔH – TΔS - આમ, ΔS અને ΔH બન્ને ઋણ હોવાથી ΔG પણ ઋણ બન્ને છે, જે દર્શાવે છે કે અધિશોષણ હંમેશાં ઉષ્માક્ષેપક હોય છે.
પ્રશ્ન 9.
પરિક્ષેપન માધ્યમ અને પરિક્ષેપિત કલાની ભૌતિક અવસ્થાના આધારે કલિલમય દ્રાવણોનું વર્ગીકરણ કેવી રીતે કરવામાં આવે છે ?
ઉત્તર:
- કલિલનું વર્ગીકરણ નીચેનાં અભિલક્ષણોના આધારે કરવામાં આવે છે :
(i) પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમની ભૌતિક અવસ્થા
(ii) પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ વચ્ચેની પારસ્પરિક ક્રિયાના સ્વભાવ પર
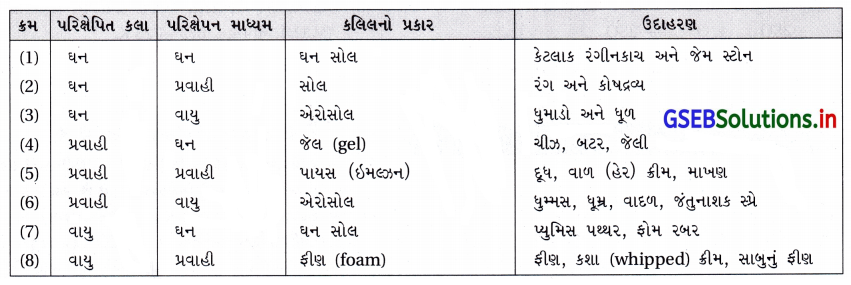
(iii) પરિક્ષેપિત કલાના કણોના પ્રકાર પર. - પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમની ભૌતિક અવસ્થા પર આધારિત વર્ગીકરણ : પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ ઘન, પ્રવાહી વાયુ છે તેના આધારે આઠ પ્રકારની કલિલ પ્રણાલી શક્ય છે. એક વાયુ બીજા વાયુ સાથે ભળે ત્યારે સમાંગ મિશ્રણ બનાવે છે અને તેથી તે કલિલયમ પ્રણાલી નથી.
- જુદા જુદા કલિલો અને તેમના વિશિષ્ટ નામ સાથેની યાદી નીચેના કોષ્ટકમાં આપેલી છે.
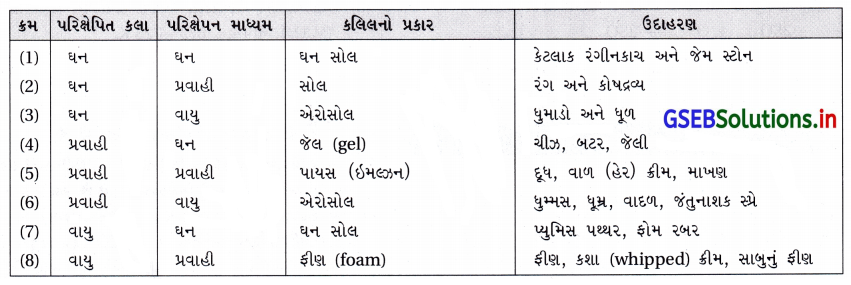
- ઘણી જાણીતી વ્યાપારિક પેદાશો અને કુદરતી વસ્તુઓ કલિલ છે. ઉદાહરણ તરીકે કશા (whipped) ક્રીમ ફીણ છે જે પ્રવાહીમાં પરિક્ષેપિત વાયુ છે.
- અગ્નિશામક ફીણ એરોપ્લેનના ઉતરાણ વખતના આપત્તિકાળ સમયે વપરાય છે તે પણ કલિલમય પ્રણાલી છે. મોટાભાગના જૈવીય દ્રવ જલીય સોલ છે. કોઈ વિશિષ્ટ કોષમાં પ્રોટીન, ન્યુક્લિક ઍસિડ કલિલમય કદના કણો છે જે આયન અને નાના અણુઓના જલીય દ્રાવણમાં પરિક્ષેપિત હોય છે.
- કોષ્ટકમાં આપેલ કલિલના જુદા જુદા પ્રકારમાંથી વધુ જાણીતા સોલ (પ્રવાહીમાં ઘન), જૅલ (ઘનમાં પ્રવાહી) અને પાયસ (ઇમલ્ડ્રન) (પ્રવાહીમાં પ્રવાહી) છે.
- પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ વચ્ચેની પારસ્પરિક પ્રક્રિયાના સ્વભાવ પર આધારિત વર્ગીકરણ : પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ વચ્ચે પારસ્પરિક ક્રિયાના સ્વભાવ પર આધારિત કલિલમય સોલ બે વિભાગમાં વિભાજિત કરેલા છે જે દ્રવઅનુરાગી (દ્રાવક આકર્ષિત) અને દ્રવિરાગી (દ્રાવક અપાકર્ષિત) જો પાણી પરિક્ષેપન માધ્યમ હોય તો વપરાતા પર્યાયો જળઅનુરાગી અને જળવિરાગી છે.
પેટાપ્રશ્ન : દ્રવઅનુરાગી અને દ્રવવિરાગી કલિલ વિશે માહિતી આપો.
ઉત્તર:
(i) દ્રવઅનુરાગી કલિલ : દ્રવઅનુરાગી શબ્દનો અર્થ થાય છે કે પ્રવાહી-ચાહક કલિલમય સોલ જે ગુંદર, જીલેટિન, સ્ટાર્ચ, રબર વગેરે જેવા પદાર્થોને યોગ્ય પ્રવાહી (પરિક્ષેપન માધ્યમ)માં મિશ્ર કરતાં ખૂબ જ સહેલાઈથી મળતા સોલને દ્રવઅનુરાગી સોલ કહે છે.
આ સોલની અગત્યની લાક્ષણિકતા એ છે કે જો પરિક્ષેપન માધ્યમને પરિક્ષેપિત કલામાંથી અલગ કરવામાં આવે, ત્યારે સોલ પરિક્ષેપન માધ્યમ સાથે ફરીવાર મિશ્ર કરીને પુનઃરચિત કરી શકાય છે. આથી જ આ સોલને પરિવર્તનીય સોલ કહેવામાં આવે છે. વળી, આ સોલ ઘણા જ સ્થાયી હોય છે અને સહેલાઈથી સ્કંદન પામતા નથી.
(ii) દ્રવવિરાગી કલિલ : દ્રવવિરાગી શબ્દનો અર્થ થાય છે પ્રવાહી- વિરાગી ધાતુઓ, તેના સલ્ફાઇડ વગેરે જેવા પદાર્થો જ્યારે પરિક્ષેપન માધ્યમમાં મિશ્ર કરવામાં આવે છે ત્યારે, કલિલમય સોલ બનાવતા નથી. તેમના કલિલમય સોલ વિશિષ્ટ પદ્ધતિઓ દ્વારા જ બનાવી શકાય છે. આવા સોલને દ્રવિરાગી સોલ કહે છે.
આ સોલ થોડા પ્રમાણમાં વિદ્યુતવિભાજ્ય ઉમેરતાં અથવા ગરમ કરતાં અથવા હલાવવાથી ઝડપથી અવક્ષેપિત થાય છે. આથી તેઓ સ્થાયી નથી.
વળી, એકવાર અવક્ષેપિત થયા પછી, ફરી પાછા પરત કલિલમય સોલ પરિક્ષેપન માધ્યમ ઉમેરવા છતાં પણ મેળવી શકાતા નથી. આથી, આ સોલને અપ્રતિવર્તીય સોલ કહે છે. દ્રવિરાગી સોલને સાચવવા કરવા માટે સ્થાયીકારક પ્રક્રિયકોની જરૂર પડે છે.
પેટાપ્રશ્ન : અવક્ષેપિત કલાના કણોના પ્રકાર પર આધારિત વર્ગીકરણ બહુઆણ્વીય, વિરાટ (બૃહદ) આણ્વીય અને સમુચ્ચયિત કલિલ જણાવો.
ઉત્તર:
પરિક્ષેપિત કલાના કણોના પ્રકાર પર આધારિત કલિલો બહુઆણ્વીય, વિરાટ આણ્વીય અને સમુચ્ચયત કલિલો તરીકે વર્ગીકૃત કરવામાં આવેલ છે.
(iii) બહુઆણ્વીય કલિલ : પદાર્થના નાના કણો અથવા વિપુલ પ્રમાણમાં અણુઓનું વિલયન કરતાં તેઓ એકબીજા સાથે અને કલિલકણોના કદ (1-1000 nm)ના માપના અણુઓ બનાવે છે. આ રીતે રચાતી સ્પિસીઝને બહુઆણ્વીય કલિલ કહે છે.
ઉદાહરણ તરીકે, ગોલ્ડ સોલ ઘણા પરમાણુ ધરાવતાં જુદાં જુદાં કદના કણો ધરાવે છે. સલ્ફર સોલ હજાર અથવા વધારે S8 સલ્ફર અણુઓના કણો ધરાવે છે.
(iv) વિરાટ આણ્વીય કલિલ : વિરાટ અણુઓ યોગ્ય દ્રાવકમાં દ્રાવણ બનાવે છે જેમાં વિરાટ અણુઓનું કદ કલિલમયના કદનાં ગાળામાં હોય છે. આવી પ્રણાલીને વિરાટ આણ્વીય કલિલ કહે છે. આ કલિલ ઘણા જ સ્થાયી હોય છે અને ઘણી બાબતોમાં સાચા દ્રાવણને મળતાં આવે છે. કુદરતી રીતે ઉદ્ભવતા વિરાટ અણુઓમાં સ્ટાર્ચ, સેલ્યુલોઝ, પ્રોટીન અને ઉત્સેચકનો સમાવેશ થાય છે અને માનવસર્જિત વિરાટ અણુઓમાં પૉલિથીન, નાયલૉન, પૉલિસ્ટાયરીન, સાંશ્લેષિત રબર વગેરે છે.
(v) સમુચ્ચયિત કલિલ (મિસેલ) : આ કેટલાક એવા પદાર્થો છે જે નિમ્ન સાંદ્રતાએ સામાન્ય પ્રબળ વિદ્યુતવિભાજ્ય તરીકે વર્તે છે, પરંતુ ઊંચી સાંદ્રતાએ સમુચ્ચયની રચનાને કારણે કલિલમય વર્તણૂક દર્શાવે છે.
આ રીતે રચાયેલા સમુચ્ચયિત કણોને મિસેલ કહેવામાં આવે છે. તેઓ સમુચ્ચયિત કલિલ તરીકે પણ ઓળખાય છે. મિસેલની રચના અમુક ખાસ તાપમાન કરતાં ઊંચા તાપમાને જ થાય છે. જેને ક્રાફ્ટ તાપમાન (Tk) કહે છે અને અમુક ખાસ સાંદ્રતાથી ઊંચી સાંદ્રતાએ જેને ક્રાંતિક મિસેલ સાંદ્રતા (CMC) કહેવામાં આવે છે.
મંદન કરતાં, આ કલિલ પરત વ્યક્તિગત આયનમાં ફેરવાય છે. પૃષ્ઠસક્રિય પદાર્થો જેવાં કે, સાબુ અને સાંશ્લેષિત ડિટર્જન્ટનો આ વર્ગમાં સમાવેશ થાય છે.
સાબુ માટે CMC 10-4 4થી 10-6 mol L-1 છે. આ કલિલ બન્ને દ્વવવિરાગી અને દ્રવઅનુરાગી ભાગો ધરાવે છે. મિસેલ 100 અણુ કે વધારે અણુઓ ધરાવે છે.
પ્રશ્ન 10.
ઘન ઉપર વાયુના અધિશોષણમાં દબાણ અને તાપમાનની અસરની ચર્ચા કરો.
ઉત્તર:
- દબાણની અસર : અધિશોષણ એ પ્રતિવર્તી પ્રક્રિયા છે અને દબાણના વધારા સાથે વધે છે.
- તાપમાનની અસર : અધિશોષણ એ ઉષ્માક્ષેપક પ્રક્રિયા છે. આથી, લ-શેટેલિયરના સિદ્ધાંત પ્રમાણે તાપમાન વધારતા અધિશોષણનું પ્રમાણ ઘટે છે.
![]()
પ્રશ્ન 11.
દ્રવઅનુરાગી (લાયોફિલિક) અને દ્રવવિરાગી (લાયોફોબિક) સોલ શું છે ? દરેક પ્રકારનું એક ઉદાહરણ આપો. જલવિરાગી સોલ શા માટે સહેલાઈથી સ્કંદન પામે છે ?
ઉત્તર:
(i) દ્રવઅનુરાગી કલિલ : દ્રવઅનુરાગી શબ્દનો અર્થ થાય છે કે પ્રવાહી-ચાહક કલિલમય સોલ જે ગુંદર, જીલેટિન, સ્ટાર્ચ, રબર વગેરે જેવા પદાર્થોને યોગ્ય પ્રવાહી (પરિક્ષેપન માધ્યમ)માં મિશ્ર કરતાં ખૂબ જ સહેલાઈથી મળતા સોલને દ્રવઅનુરાગી સોલ કહે છે.
આ સોલની અગત્યની લાક્ષણિકતા એ છે કે જો પરિક્ષેપન માધ્યમને પરિક્ષેપિત કલામાંથી અલગ કરવામાં આવે, ત્યારે સોલ પરિક્ષેપન માધ્યમ સાથે ફરીવાર મિશ્ર કરીને પુનઃરચિત કરી શકાય છે. આથી જ આ સોલને પરિવર્તનીય સોલ કહેવામાં આવે છે. વળી, આ સોલ ઘણા જ સ્થાયી હોય છે અને સહેલાઈથી સ્કંદન પામતા નથી.
(ii) દ્રવવિરાગી કલિલ : દ્રવવિરાગી શબ્દનો અર્થ થાય છે પ્રવાહી- વિરાગી ધાતુઓ, તેના સલ્ફાઇડ વગેરે જેવા પદાર્થો જ્યારે પરિક્ષેપન માધ્યમમાં મિશ્ર કરવામાં આવે છે ત્યારે, કલિલમય સોલ બનાવતા નથી. તેમના કલિલમય સોલ વિશિષ્ટ પદ્ધતિઓ દ્વારા જ બનાવી શકાય છે. આવા સોલને દ્રવિરાગી સોલ કહે છે.
આ સોલ થોડા પ્રમાણમાં વિદ્યુતવિભાજ્ય ઉમેરતાં અથવા ગરમ કરતાં અથવા હલાવવાથી ઝડપથી અવક્ષેપિત થાય છે. આથી તેઓ સ્થાયી નથી.
વળી, એકવાર અવક્ષેપિત થયા પછી, ફરી પાછા પરત કલિલમય સોલ પરિક્ષેપન માધ્યમ ઉમેરવા છતાં પણ મેળવી શકાતા નથી. આથી, આ સોલને અપ્રતિવર્તીય સોલ કહે છે. દ્રવિરાગી સોલને સાચવવા કરવા માટે સ્થાયીકારક પ્રક્રિયકોની જરૂર પડે છે.
પ્રશ્ન 12.
બહુઆણ્વીય અને વિરાટ આણ્વીય કલિલ વચ્ચે શું તફાવત છે ? દરેક પ્રકારનું એક ઉદાહરણ આપો. સમુચ્ચયિત કલિલ આ બન્ને પ્રકારના કલિલથી કઈ રીતે અલગ પડે છે ?
ઉત્તર:
પરિક્ષેપિત કલાના કણોના પ્રકાર પર આધારિત કલિલો બહુઆણ્વીય, વિરાટ આણ્વીય અને સમુચ્ચયત કલિલો તરીકે વર્ગીકૃત કરવામાં આવેલ છે.
(iii) બહુઆણ્વીય કલિલ : પદાર્થના નાના કણો અથવા વિપુલ પ્રમાણમાં અણુઓનું વિલયન કરતાં તેઓ એકબીજા સાથે અને કલિલકણોના કદ (1-1000 nm)ના માપના અણુઓ બનાવે છે. આ રીતે રચાતી સ્પિસીઝને બહુઆણ્વીય કલિલ કહે છે.
ઉદાહરણ તરીકે, ગોલ્ડ સોલ ઘણા પરમાણુ ધરાવતાં જુદાં જુદાં કદના કણો ધરાવે છે. સલ્ફર સોલ હજાર અથવા વધારે S8 સલ્ફર અણુઓના કણો ધરાવે છે.
(iv) વિરાટ આણ્વીય કલિલ : વિરાટ અણુઓ યોગ્ય દ્રાવકમાં દ્રાવણ બનાવે છે જેમાં વિરાટ અણુઓનું કદ કલિલમયના કદનાં ગાળામાં હોય છે. આવી પ્રણાલીને વિરાટ આણ્વીય કલિલ કહે છે. આ કલિલ ઘણા જ સ્થાયી હોય છે અને ઘણી બાબતોમાં સાચા દ્રાવણને મળતાં આવે છે. કુદરતી રીતે ઉદ્ભવતા વિરાટ અણુઓમાં સ્ટાર્ચ, સેલ્યુલોઝ, પ્રોટીન અને ઉત્સેચકનો સમાવેશ થાય છે અને માનવસર્જિત વિરાટ અણુઓમાં પૉલિથીન, નાયલૉન, પૉલિસ્ટાયરીન, સાંશ્લેષિત રબર વગેરે છે.
(v) સમુચ્ચયિત કલિલ (મિસેલ) : આ કેટલાક એવા પદાર્થો છે જે નિમ્ન સાંદ્રતાએ સામાન્ય પ્રબળ વિદ્યુતવિભાજ્ય તરીકે વર્તે છે, પરંતુ ઊંચી સાંદ્રતાએ સમુચ્ચયની રચનાને કારણે કલિલમય વર્તણૂક દર્શાવે છે.
આ રીતે રચાયેલા સમુચ્ચયિત કણોને મિસેલ કહેવામાં આવે છે. તેઓ સમુચ્ચયિત કલિલ તરીકે પણ ઓળખાય છે. મિસેલની રચના અમુક ખાસ તાપમાન કરતાં ઊંચા તાપમાને જ થાય છે. જેને ક્રાફ્ટ તાપમાન (Tk) કહે છે અને અમુક ખાસ સાંદ્રતાથી ઊંચી સાંદ્રતાએ જેને ક્રાંતિક મિસેલ સાંદ્રતા (CMC) કહેવામાં આવે છે.
મંદન કરતાં, આ કલિલ પરત વ્યક્તિગત આયનમાં ફેરવાય છે. પૃષ્ઠસક્રિય પદાર્થો જેવાં કે, સાબુ અને સાંશ્લેષિત ડિટર્જન્ટનો આ વર્ગમાં સમાવેશ થાય છે.
સાબુ માટે CMC 10-4 4થી 10-6 mol L-1 છે. આ કલિલ બન્ને દ્વવવિરાગી અને દ્રવઅનુરાગી ભાગો ધરાવે છે. મિસેલ 100 અણુ કે વધારે અણુઓ ધરાવે છે.
પ્રશ્ન 13.
ઉત્સેચકો શું છે ? ઉત્સેચક ઉદ્દીપનની ક્રિયાવિધિ ટૂંકમાં લખો.
ઉત્તર:
- ઉત્સેચકો જટિલ નાઇટ્રોજનયુક્ત કાર્બનિક સંયોજનો છે જે સજીવ વનસ્પતિ અને પ્રાણીઓ દ્વારા પેદા કરવામાં આવે છે. ખરેખર તો તેઓ ઉચ્ચ આણ્વીયદળ ધરાવતા પ્રોટીન અણુઓ છે અને પાણીમાં કલિલમય દ્રાવણ રચે છે. તે ઘણાં અસરકારક ઉદ્દીપકો છે. ઘણી બધી પ્રક્રિયાઓને ઉદ્દીપિત કરે છે . ખાસ કરીને જે પ્રક્રિયાઓ કુદરતી પ્રક્રિયાઓ જે જીવન પ્રક્રમને જાળવી રાખે છે. તે બધી ઉત્સેચક દ્વારા ઉદ્દીપિત થાય છે. આમ, ઉત્સેચકો જૈવરાસાયણિક ઉદ્દીપકો તરીકે ઓળખાય છે અને આ પરિઘટના જૈવરાસાયણિક ઉદ્દીપન તરીકે ઓળખાય છે.
- ઉત્સેચકોના કલિલમય કણોની સપાટી પર ઘણા છિદ્રો રહેલા હોય છે. આ છિદ્રો લાક્ષણિક આકારના હોય છે અને -NH2, -COOH, −SH, −OH વગેરે સક્રિય સમૂહ ધરાવતા હોય છે. ખરેખર તો આ ઉત્સેચક કણોની સપાટી પરના સક્રિય કેન્દ્રો હોય છે. પ્રક્રિયકના અણુઓ જેમને પૂરક આકાર હોય છે તે આ છિદ્રોમાં જેમ તાળામાં કૂંચી ગોઠવાય છે તેવી જ રીતે ગોઠવાય છે. સક્રિય સમૂહની હાજરીને કારણે સક્રિયકૃત સંકીર્ણ રચાય છે જે પછીથી વિઘટિત થાય છે અને નીપજો આપે છે.
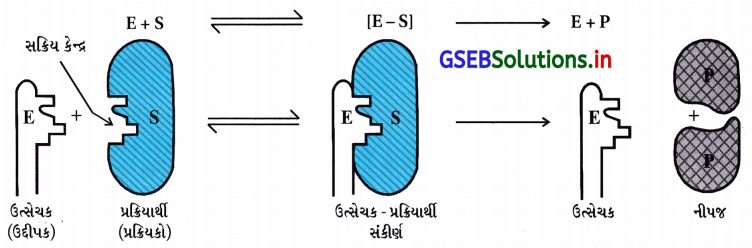
- આમ, ઉત્સેચક ઉદ્દીપિત પ્રક્રિયાઓને નીચેના બે તબક્કામાં આગળ વધતી પ્રક્રિયાઓ ગણી શકાય.
તબક્કો-1 : પ્રક્રિયાર્થી (અવસ્તર) સાથે ઉત્સેચકનું બંધન અને સક્રિયકૃત સંકીર્ણની રચના. E + S → ES≠
તબક્કો-2 : નીપજના નિર્માણ (બનાવટ)માં સક્રિયકૃત સંકીર્ણનું વિઘટન. ES≠ → E + P
પ્રશ્ન 14.
નીચેનાના આધારે કલિલનું વર્ગીકરણ કેવી રીતે કરવામાં આવે છે ?
(i) ઘટકોની ભૌતિક અવસ્થા
(ii) પરિક્ષેપિત કલાનો સ્વભાવ (પ્રકૃતિ)
(iii) પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ વચ્ચે પારસ્પરિક ક્રિયા
ઉત્તર:
- કલિલનું વર્ગીકરણ નીચેનાં અભિલક્ષણોના આધારે કરવામાં આવે છે :
(i) પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમની ભૌતિક અવસ્થા
(ii) પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ વચ્ચેની પારસ્પરિક ક્રિયાના સ્વભાવ પર
(iii) પરિક્ષેપિત કલાના કણોના પ્રકાર પર. - પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમની ભૌતિક અવસ્થા પર આધારિત વર્ગીકરણ : પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ ઘન, પ્રવાહી વાયુ છે તેના આધારે આઠ પ્રકારની કલિલ પ્રણાલી શક્ય છે. એક વાયુ બીજા વાયુ સાથે ભળે ત્યારે સમાંગ મિશ્રણ બનાવે છે અને તેથી તે કલિલયમ પ્રણાલી નથી.
- જુદા જુદા કલિલો અને તેમના વિશિષ્ટ નામ સાથેની યાદી નીચેના કોષ્ટકમાં આપેલી છે.
- ઘણી જાણીતી વ્યાપારિક પેદાશો અને કુદરતી વસ્તુઓ કલિલ છે. ઉદાહરણ તરીકે કશા (whipped) ક્રીમ ફીણ છે જે પ્રવાહીમાં પરિક્ષેપિત વાયુ છે.
- અગ્નિશામક ફીણ એરોપ્લેનના ઉતરાણ વખતના આપત્તિકાળ સમયે વપરાય છે તે પણ કલિલમય પ્રણાલી છે. મોટાભાગના જૈવીય દ્રવ જલીય સોલ છે. કોઈ વિશિષ્ટ કોષમાં પ્રોટીન, ન્યુક્લિક ઍસિડ કલિલમય કદના કણો છે જે આયન અને નાના અણુઓના જલીય દ્રાવણમાં પરિક્ષેપિત હોય છે.
- કોષ્ટકમાં આપેલ કલિલના જુદા જુદા પ્રકારમાંથી વધુ જાણીતા સોલ (પ્રવાહીમાં ઘન), જૅલ (ઘનમાં પ્રવાહી) અને પાયસ (ઇમલ્ડ્રન) (પ્રવાહીમાં પ્રવાહી) છે.
- પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ વચ્ચેની પારસ્પરિક પ્રક્રિયાના સ્વભાવ પર આધારિત વર્ગીકરણ : પરિક્ષેપિત કલા અને પરિક્ષેપન માધ્યમ વચ્ચે પારસ્પરિક ક્રિયાના સ્વભાવ પર આધારિત કલિલમય સોલ બે વિભાગમાં વિભાજિત કરેલા છે જે દ્રવઅનુરાગી (દ્રાવક આકર્ષિત) અને દ્રવિરાગી (દ્રાવક અપાકર્ષિત) જો પાણી પરિક્ષેપન માધ્યમ હોય તો વપરાતા પર્યાયો જળઅનુરાગી અને જળવિરાગી છે.
પેટાપ્રશ્ન : દ્રવઅનુરાગી અને દ્રવવિરાગી કલિલ વિશે માહિતી આપો.
ઉત્તર:
(i) દ્રવઅનુરાગી કલિલ : દ્રવઅનુરાગી શબ્દનો અર્થ થાય છે કે પ્રવાહી-ચાહક કલિલમય સોલ જે ગુંદર, જીલેટિન, સ્ટાર્ચ, રબર વગેરે જેવા પદાર્થોને યોગ્ય પ્રવાહી (પરિક્ષેપન માધ્યમ)માં મિશ્ર કરતાં ખૂબ જ સહેલાઈથી મળતા સોલને દ્રવઅનુરાગી સોલ કહે છે.
આ સોલની અગત્યની લાક્ષણિકતા એ છે કે જો પરિક્ષેપન માધ્યમને પરિક્ષેપિત કલામાંથી અલગ કરવામાં આવે, ત્યારે સોલ પરિક્ષેપન માધ્યમ સાથે ફરીવાર મિશ્ર કરીને પુનઃરચિત કરી શકાય છે. આથી જ આ સોલને પરિવર્તનીય સોલ કહેવામાં આવે છે. વળી, આ સોલ ઘણા જ સ્થાયી હોય છે અને સહેલાઈથી સ્કંદન પામતા નથી.
(ii) દ્રવવિરાગી કલિલ : દ્રવવિરાગી શબ્દનો અર્થ થાય છે પ્રવાહી- વિરાગી ધાતુઓ, તેના સલ્ફાઇડ વગેરે જેવા પદાર્થો જ્યારે પરિક્ષેપન માધ્યમમાં મિશ્ર કરવામાં આવે છે ત્યારે, કલિલમય સોલ બનાવતા નથી. તેમના કલિલમય સોલ વિશિષ્ટ પદ્ધતિઓ દ્વારા જ બનાવી શકાય છે. આવા સોલને દ્રવિરાગી સોલ કહે છે.
આ સોલ થોડા પ્રમાણમાં વિદ્યુતવિભાજ્ય ઉમેરતાં અથવા ગરમ કરતાં અથવા હલાવવાથી ઝડપથી અવક્ષેપિત થાય છે. આથી તેઓ સ્થાયી નથી.
વળી, એકવાર અવક્ષેપિત થયા પછી, ફરી પાછા પરત કલિલમય સોલ પરિક્ષેપન માધ્યમ ઉમેરવા છતાં પણ મેળવી શકાતા નથી. આથી, આ સોલને અપ્રતિવર્તીય સોલ કહે છે. દ્રવિરાગી સોલને સાચવવા કરવા માટે સ્થાયીકારક પ્રક્રિયકોની જરૂર પડે છે.
પેટાપ્રશ્ન : અવક્ષેપિત કલાના કણોના પ્રકાર પર આધારિત વર્ગીકરણ બહુઆણ્વીય, વિરાટ (બૃહદ) આણ્વીય અને સમુચ્ચયિત કલિલ જણાવો.
ઉત્તર:
પરિક્ષેપિત કલાના કણોના પ્રકાર પર આધારિત કલિલો બહુઆણ્વીય, વિરાટ આણ્વીય અને સમુચ્ચયત કલિલો તરીકે વર્ગીકૃત કરવામાં આવેલ છે.
(iii) બહુઆણ્વીય કલિલ : પદાર્થના નાના કણો અથવા વિપુલ પ્રમાણમાં અણુઓનું વિલયન કરતાં તેઓ એકબીજા સાથે અને કલિલકણોના કદ (1-1000 nm)ના માપના અણુઓ બનાવે છે. આ રીતે રચાતી સ્પિસીઝને બહુઆણ્વીય કલિલ કહે છે.
ઉદાહરણ તરીકે, ગોલ્ડ સોલ ઘણા પરમાણુ ધરાવતાં જુદાં જુદાં કદના કણો ધરાવે છે. સલ્ફર સોલ હજાર અથવા વધારે S8 સલ્ફર અણુઓના કણો ધરાવે છે.
(iv) વિરાટ આણ્વીય કલિલ : વિરાટ અણુઓ યોગ્ય દ્રાવકમાં દ્રાવણ બનાવે છે જેમાં વિરાટ અણુઓનું કદ કલિલમયના કદનાં ગાળામાં હોય છે. આવી પ્રણાલીને વિરાટ આણ્વીય કલિલ કહે છે. આ કલિલ ઘણા જ સ્થાયી હોય છે અને ઘણી બાબતોમાં સાચા દ્રાવણને મળતાં આવે છે. કુદરતી રીતે ઉદ્ભવતા વિરાટ અણુઓમાં સ્ટાર્ચ, સેલ્યુલોઝ, પ્રોટીન અને ઉત્સેચકનો સમાવેશ થાય છે અને માનવસર્જિત વિરાટ અણુઓમાં પૉલિથીન, નાયલૉન, પૉલિસ્ટાયરીન, સાંશ્લેષિત રબર વગેરે છે.
(v) સમુચ્ચયિત કલિલ (મિસેલ) : આ કેટલાક એવા પદાર્થો છે જે નિમ્ન સાંદ્રતાએ સામાન્ય પ્રબળ વિદ્યુતવિભાજ્ય તરીકે વર્તે છે, પરંતુ ઊંચી સાંદ્રતાએ સમુચ્ચયની રચનાને કારણે કલિલમય વર્તણૂક દર્શાવે છે.
આ રીતે રચાયેલા સમુચ્ચયિત કણોને મિસેલ કહેવામાં આવે છે. તેઓ સમુચ્ચયિત કલિલ તરીકે પણ ઓળખાય છે. મિસેલની રચના અમુક ખાસ તાપમાન કરતાં ઊંચા તાપમાને જ થાય છે. જેને ક્રાફ્ટ તાપમાન (Tk) કહે છે અને અમુક ખાસ સાંદ્રતાથી ઊંચી સાંદ્રતાએ જેને ક્રાંતિક મિસેલ સાંદ્રતા (CMC) કહેવામાં આવે છે.
મંદન કરતાં, આ કલિલ પરત વ્યક્તિગત આયનમાં ફેરવાય છે. પૃષ્ઠસક્રિય પદાર્થો જેવાં કે, સાબુ અને સાંશ્લેષિત ડિટર્જન્ટનો આ વર્ગમાં સમાવેશ થાય છે.
સાબુ માટે CMC 10-4 4થી 10-6 mol L-1 છે. આ કલિલ બન્ને દ્વવવિરાગી અને દ્રવઅનુરાગી ભાગો ધરાવે છે. મિસેલ 100 અણુ કે વધારે અણુઓ ધરાવે છે.
![]()
પ્રશ્ન 15.
શું અવલોકિત થાય છે તે સમજાવો.
(i) કલિલ સોલમાંથી પ્રકાશનું પુંજ (બીમ) (beam) પસાર કરવામાં આવે ત્યારે
(ii) જળયુક્ત ફેરિક ઑક્સાઇડ સોલમાં વિદ્યુતવિભાજ્ય NaCl ઉમેરવામાં આવે ત્યારે
(iii) કલિલમય સોલમાંથી વિધુતપ્રવાહ પસાર કરવામાં આવે ત્યારે
ઉત્તર:
(i) જ્યારે પ્રકાશનું પુંજ કલિલ સોલમાંથી પસાર કરવામાં આવે ત્યારે પ્રકાશનું વિખેરણ થાય છે. આ ક્રિયાને ટિંડોલ અસર કહે છે. પ્રકાશનું વિખેરણ થઈ પ્રકાશનો માર્ગ પ્રજવલ્લિત દેખાય છે.
(ii) જ્યારે જળયુક્ત ફેરિક ઑક્સાઇડ સોલમાં વિદ્યુતવિભાજ્ય NaCl ઉમેરવામાં આવે, ત્યારે NaClમાંથી Na+ અને Cl– આયનો છૂટાં પડે છે અને ધનભારયુક્ત ફેરિક ઑક્સાઇડના સોલનું સ્પંદન ઋણવીજભારિત Cl– આયનની હાજરીમાં થાય છે.
(iii) કલિલમય સોલ ધનવીજભારિત અથવા ઋણવીજભારિત હોય છે. પરિક્ષેપન માધ્યમ તેના કરતાં વિરુદ્ધ વીજભાર ધરાવે છે. આથી, તે સમગ્ર કલિલને તટસ્થ બનાવે છે. વિદ્યુતભારની હાજરીમાં કલિલકણો વિરુદ્ધ વીજભાર ધરાવતા વિદ્યુતધ્રુવ તરફ આકર્ષાય છે અને જ્યારે તેઓ વિદ્યુતધ્રુવના સંપર્કમાં આવે, ત્યારે તેઓ વીજભાર ગુમાવતા તેઓનું સ્પંદન થાય છે.
પ્રશ્ન 16.
પાયસ શું છે ? તેમના જુદા જુદા પ્રકારો કયા છે ? દરેક પ્રકારનું ઉદાહરણ આપો.
ઉત્તર:
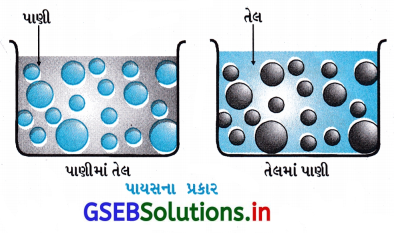
- આ પ્રવાહી-પ્રવાહી કલિલમય પ્રણાલી છે એટલે કે ઝીણા ભૂકા જેવા સૂક્ષ્મબિંદુનું બીજા પ્રવાહીમાં પરિક્ષેપન. બે અદ્રાવ્ય અથવા અંશતઃ દ્રાવ્ય પ્રવાહી લેવામાં આવે, તો એક પ્રવાહીનું બરછટ પરિક્ષેપન મળે છે તેને પાયસ (ઇમલ્શન) કહે છે.
- સામાન્ય રીતે, બેમાંથી એક પ્રવાહી પાણી હોય છે. પાયસના બે પ્રકાર છે. (i) પાણીમાં પરિક્ષેપિત તેલ (O/W પ્રકાર) અને (ii) તેલમાં પરિક્ષેપિત પાણી (W/O પ્રકાર).
- પ્રથમ પ્રણાલીમાં પાણી પરિક્ષેપન માધ્યમ તરીકે વર્તે છે. આ પ્રકારના પાયસના ઉદાહરણોમાં દૂધ અને લોપી (વેનિશિંગ) ક્રીમ છે. દૂધમાં પ્રવાહી ચરબી પાણીમાં પરિક્ષેપિત હોય છે. બીજી પ્રણાલીમાં, તેલ પરિક્ષેપન માધ્યમ તરીકે વર્તે છે. પ્રકારમાં સામાન્ય ઉદાહરણોમાં માખણ અને ક્રીમ છે.
પાણીમાં તેલનું પાયસ અસ્થાયી હોય છે અને કેટલીક વખત મૂકી રાખવાથી બે સ્તરમાં અલગ પડી જાય છે. પાયસના સ્થાયીકરણ માટે ત્રીજો ઘટક જેને પાયસીકારક કહેવામાં આવે છે તે સામાન્ય રીતે ઉમેરવામાં આવે છે.
- પાયસીકા૨ક નિલંબિત કણો અને માધ્યમ વચ્ચે અંતરાપૃષ્ઠીય ફિલ્મ રચે છે. O/W પાયસ માટે મુખ્ય પાયસીકારક પ્રોટીન, ગુંદર, કુદરતી અને કૃત્રિમ સાબુ વગેરે છે. જ્યારે W/O પાયસ માટે ચરબીયુક્ત ઍસિડના ધાત્વીયક્ષાર, લાંબી શૃંખલાવાળા આલ્કોહૉલ, દીપકાજલ (lampblack) વગેરે છે.
- પાયસને પરિક્ષેપન માધ્યમના કોઈ પણ જથ્થાથી મંદ કરી શકાય છે. બીજી બાજુ પરિક્ષેપિત પ્રવાહી જ્યારે મિશ્ર કરવામાં આવે છે ત્યારે તે અલગ સ્તર રચે છે. પાયસમાંના સૂક્ષ્મબિંદુ ઘણીવાર ઋણભારિત હોય છે અને તેમને વિદ્યુતવિભાજ્ય વડે અવક્ષેપિત કરી શકાય છે. તેઓ બ્રાઉનિયન ગતિ અને ટિંડોલ અસર પણ દર્શાવે છે, પાયસીકરણને તેના ઘટક પ્રવાહીમાં ગરમ કરીને, ઠંડું પાડીને અથવા સેન્દ્રિફ્યુઝ વગેરે કરીને તોડી શકાય છે.
પ્રશ્ન 17.
પાયસીકારક (ઇમલ્શીફાયર) પાયસને કેવી રીતે સ્થાયી બનાવે છે ? બે ઇમલ્શીફાયરના નામ આપો.
ઉત્તર:
પાયસના સ્થાયીકરણ માટે ત્રીજો ઘટક જેને પાયસીકારક કહેવામાં આવે છે, તે ઉમેરવામાં આવે છે. પાયસીકારક નિલંબિત કણો અને માધ્યમ વચ્ચે અંતરાપૃષ્ઠીય ફિલ્મ રચે છે. O/W પાયસ માટે મુખ્ય પાયસીકારક પ્રોટીન, ગુંદર, કુદરતી અને કૃત્રિમ સાબુ વગે૨ે છે, જ્યારે W/O પાયસ માટે ચરબીયુક્ત ઍસિડના ધાત્વીય ક્ષાર, લાંબી શૃંખલાવાળા આલ્કોહૉલ, દીપકાજલ વગેરે છે.
પ્રશ્ન 18.
સાબુની ક્રિયા પાયસીકરણ અને મિસેલ રચનાને કારણે છે, આલોચના કરો.
ઉત્તર:
- મિસેલ જળવિરાગી હાઇડ્રોકાર્બન-કેન્દ્રિય કોર(core)ની જેમ રહેલ છે. સાબુની સ્વચ્છીકરણ ક્રિયા હકીકતમાં એ છે કે સાબુના અણુઓ તેલના ટીપાં આસપાસ એવી મિસેલ રચના કરે છે જેથી સ્ટીઅરેટ આયનનો જળવિરાગી ભાગ તૈલીબિંદુમાં હોય છે અને જળઅનુરાગી ભાગ ગ્રીઝના બિંદુની બહાર કેશની જેમ પ્રક્ષેપિત હોય છે.
- ધ્રુવીય સમૂહ પાણી સાથે પારસ્પરિક ક્રિયા કરી શકે છે તેથી સ્ટીરેટ આયન વડે ઘેરાયેલ તૈલીબિંદુ પાણીમાં ખેંચાઈ આવે છે અને ગંદી સપાટી પરથી દૂર થાય છે. આથી, સાબુ પાયસીકરણમાં અને તેલ તથા ચરબીને ધોઈ નાંખવામાં મદદ કરે છે. ગોલિકાની આજુબાજુનું ઋણભારિત ઢાંકણ (sheath) તેમને એકઠા થઈને સમુચ્ચય બનાવવામાં રોકે છે.
પ્રશ્ન 19.
વિષમાંગ ઉદ્દીપનના ચાર ઉદાહરણો આપો.
ઉત્તર:
સમાંગ ઉદ્દીપન : જ્યારે પ્રક્રિયકો, નીપજો અને ઉદ્દીપક એક જ કલામાં હોય ત્યારે પ્રક્રમને સમાંગ ઉદ્દીપન કહેવામાં આવે છે. તેના કેટલાક ઉદાહરણો નીચે પ્રમાણે છે :
(i) લેડ ચેમ્બર વિધિમાં સલ્ફર ડાયૉક્સાઇડનું સલ્ફર ટ્રાયૉક્સાઇડમાં ઑક્સિજન સાથેનું ઉદ્દીપક નાઇટ્રોજનના ઑક્સાઇડની હાજરીમાં ઑક્સિડેશન.

પ્રક્રિયકો સલ્ફર ડાયૉક્સાઇડ અને ઑક્સિજન અને ઉદ્દીપક નાઇટ્રિક ઑક્સાઇડ બધા એક જ કલામાં છે.
(ii) HCl વડે પૂરા પાડવામાં આવતા ઉદ્દીપક H+ની હાજરીમાં મિથાઇલ એસિટેટનું જળવિભાજન.
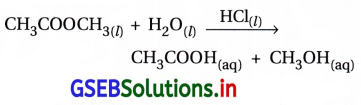
બંને પ્રક્રિયકો અને ઉદ્દીપક એક જ કલામાં છે.
(iii) સલ્ફયુરિક ઍસિડ દ્વારા પૂરા પાડવામાં આવતા H+ આયનથી ખાંડનું જળવિભાજન ઉદ્દીપિત થાય છે.
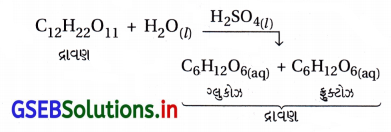
બંન પ્રક્રિયકો અને ઉદ્દીપક એક જ અવસ્થામાં છે.
વિષમાંગ ઉદ્દીપન : એવો ઉદ્દીપન પ્રક્રમ જેમાં પ્રક્રિયકો અને ઉદ્દીપક જુદી જુદી કલામાં હોય છે તો વિષમાંગ ઉદ્દીપન કહે છે. વિષમાંગ ઉદ્દીપનના કેટલાક ઉદાહરણો નીચે મુજબ છે :
(i) Ptની હાજરીમાં સલ્ફર ડાયૉક્સાઇડનું સલ્ફર ટ્રાયૉક્સાઇડમાં ઑક્સિડેશન

પ્રક્રિયક વાયુમય અવસ્થામાં છે. જ્યારે ઉદ્દીપક ઘન અવસ્થામાં છે.
(ii) હેબર વિધિમાં ઝીણા કરેલ આયર્નની હાજરીમાં ડાયનાઇટ્રોજન અને ડાયહાઇડ્રોજનનું સંયોગીકરણ.
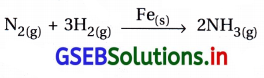
પ્રક્રિયકો વાયુમય અવસ્થામાં છે. જયારે ઉદ્દીપક ઘન અવસ્થામાં છે.
(iii) ઑસ્વાલ્ડ વિધિમાં પ્લેટિનમ ગૉજની હાજરીમાં એમોનિયાનું નાઇટ્રિક ઑક્સાઇડમાં ઑક્સિડેશન
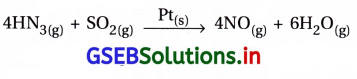
પ્રક્રિયકો વાયુમય અવસ્થામાં છે જ્યારે ઉદ્દીપક ઘન અવસ્થામાં છે.
(iv) ઝીણા કરેલા નિકલ ઉદ્દીપકની હાજરીમાં વનસ્પતિ તેલનું હાઇડ્રોજિનેશન,
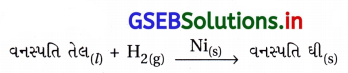
પ્રક્રિયકોમાંનો એક પ્રવાહી અવસ્થામાં અને બીજો વાયુમય અવસ્થામાં છે જ્યારે ઉદ્દીપક ઘન અવસ્થામાં છે.
![]()
પ્રશ્ન 20.
ઉદ્દીપનની સક્રિયતા અને વરણાત્મકતાથી તમે શું સમજો છો ?
ઉત્તર:
- ઘન ઉદ્દીપનની અગત્યની ખાસિયતો નીચે મુજબ છે :
(a) સક્રિયતા : ઉદ્દીપકની સક્રિયતા વિશેષ પ્રમાણમાં રાસાયણિક અધિશોષણની પ્રબળતા પર આધાર રાખે છે. પ્રક્રિયકો ઉદ્દીપક પર પ્રમાણમાં પ્રબળતાથી અધિશોષિત થવા જોઈએ જેથી તે સક્રિય બને. વળી, તે એટલી બધી પ્રબળતાથી અધિશોષિત ન થવાં જોઈએ. જેથી તેઓ ગતિશીલ રહે નહી અને બીજા પ્રક્રિયક ઉદ્દીપકની સપાટી પર અધિશોષિત થવા માટે જગ્યા ન હોય.

(b) વરણાત્મકતા : ઉદ્દીપકની વરણાત્મકતા એટલે કે જ્યારે સમાન પ્રક્રિયા પરિસ્થિતિમાં અનેક નીપજો શક્ય હોય ત્યારે તેની ચોક્કસ નીપજ ઉત્પન્ન કરવાની દિશામાં લઈ જવાની ક્ષમતા.
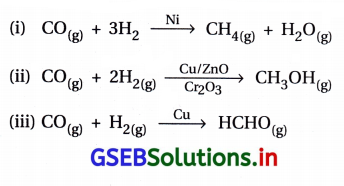
- સમાન પ્રક્રિયકો માટે જુદાં જુદાં ઉદ્દીપકોની વરણાત્મકતા જુદી- જુદી હોય છે. ઉદાહરણ તરીકે, H2 અને COથી શરૂઆત કરીને જો જુદાં જુદાં ઉદ્દીપકો વાપરીએ તો જુદી જુદી નીપજો મળે છે.
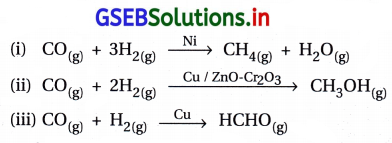
- આથી એ અવલોકન કરી શકાય કે ઉદ્દીપકીય પ્રક્રિયા સ્વભાવે ખૂબ જ વરણાત્મક છે. એટલે કે કોઈ આપેલ ઉદ્દીપક કોઈ ખાસ પ્રક્રિયા માટે વર્તે છે અને બધી પ્રક્રિયાઓ માટે નહિ. આનો અર્થ એમ થાય છે કે એક પદાર્થ કોઈ એક પ્રક્રિયામાં ઉદ્દીપક તરીકે વર્તે છે, તે અન્ય પ્રક્રિયાઓને ઉદ્દીપિત કરવામાં નિષ્ફળ નીવડે.
પ્રશ્ન 21.
ઝિયોલાઇટ વડે ઉદ્દીપનની કેટલીક ખાસિયતો વર્ણવો.
ઉત્તર:
- ઉદ્દીપકીય પ્રક્રિયાઓ જે ઉદ્દીપકની છિદ્ર રચના અને પ્રક્રિયક અને નીપજ અણુઓના કદ પર આધાર રાખે છે તેને આકાર વરણાત્મક ઉદીપન કહે છે.
- ઝિયોલાઇટ સારા આકાર વરણાત્મક ઉદ્દીપક છે કારણ કે તેમની રચના મધપૂડા જેવી હોય છે. તે ઍલ્યુમિનોસિલિકેટના સૂક્ષ્મ છિદ્રો જેમને ત્રિ-પરિમાણીય જાળીદાર રચના હોવાથી કેટલાક સિલિકોન પરમાણુ ઍલ્યુમિનિયમ પરમાણુ વડે વિસ્થાપિત થાય છે અને AI-O-Si માળખું આપે છે.
- ઝિયોલાઇટમાં ભાગ લેતી પ્રક્રિયાઓ પ્રક્રિયક અને નીપજ અણુઓના કદ અને આકાર ઉપરાંત ઝિયોલાઇટ છિદ્રો અને પોલાણ પર આધાર રાખે છે. તે કુદરતમાં મળી આવે છે તેમજ ઉદ્દીપકીય વરણાત્મકતા માટે સાંશ્લેષિત સ્વરૂપ પણ મળે છે.
- ઝિયોલાઇટના વિશાળ પાયા પર ઉદ્દીપક તરીકે ઉપયોગ પેટ્રોરસાયણ ઉદ્યોગમાં હાઇડ્રોકાર્બનના વિભંજન અને સમઘટીકરણ માટે થાય છે. પેટ્રોરસાયણ ઉદ્યોગમાં વપરાતો અગત્યનો ઝિયોલાઇટ ઉદ્દીપક ZSM-5 છે. તે આલ્કોહૉલનું સીધું જ ગૅસોલીન (પેટ્રોલ)માં નિર્જલીકરણ કરીને હાઇડ્રોકાર્બન સંયોજનોનું મિશ્રણ આપે છે.
પ્રશ્ન 22.
આકાર વરણાત્મક ઉદ્દીપન શું છે ?
ઉત્તર:
- જે ઉદ્દીપકીય પ્રક્રિયા ઉદ્દીપકની છિદ્ર રચના તથા પ્રક્રિયક અને નીપજ અણુઓના કદ પર આધાર રાખે તેવા ઉદ્દીપનને આકાર વરણાત્મક ઉદ્દીપન કહે છે. દા.ત., ઝિયોલાઇટ એ આકાર વરણાત્મક ઉદ્દીપક છે. ઝિયોલાઇટમાં રહેલા છિદ્રોનું કદ 260થી 740 pm હોય છે.
- અણુઓ કે જેનું કદ તેના કરતાં મોટું હોય તે ઝિયોલાઇટ સાથે પ્રક્રિયા આપતા નથી.
પ્રશ્ન 23.
નીચેના પર્યાયો સમજાવો :
(i) વિદ્યુતકણ સંચલન (ઇલેક્ટ્રોફોરેસીસ)
(ii) સ્કંદન
(iii) પારશ્લેષણ (ડાયાલીસિસ)
(iv) ટિંડોલ અસર
ઉત્તર:
(i) વિદ્યુતકણ સંચલન (ઇલેક્ટ્રૉફોરેસિસ) : કલિલમય કણો ૫૨ ભારનું અસ્તિત્વ વિદ્યુતકણ સંચલન પ્રયોગોથી સાબિત કરી શકાય છે. કલિલમય દ્રાવણમાં ડૂબાડેલા બે પ્લેટિનમ ધ્રુવો વચ્ચે વિદ્યુત પોર્ટેન્શિયલ પ્રયુક્ત કરવામાં આવે છે ત્યારે કલિલમય કણો એક અથવા બીજા ધ્રુવો તરફ ખસે છે. પ્રયુક્ત વિદ્યુત પોટૅન્શિયલ હેઠળ કલિલમય કણોના હેરફેરને વિદ્યુત કણ સંચલન કહે છે.
(ii) સ્કંદન : કલિલમય કણોનું બેસી જવાની (ઠરી જવાની) પ્રક્રિયા સોલનું સ્પંદન અથવા અવક્ષેપન કહેવાય છે.
(iii) પારશ્લેષણ (ડાયાલીસિસ) : પારશ્લેષણ અથવા ડાયાલિસીસ એ કલિલમય દ્રાવણના શુદ્ધીકરણ માટેની એક પદ્ધતિ છે. આ પદ્ધતિ ઓગાળેલા પદાર્થને કલિલમય દ્રાવણમાંથી દૂર કરવા માટે યોગ્ય પડદા દ્વારા પ્રસરણ કરવામાં આવે છે.
(iv) ટિંડોલ અસર : જો સમાંગ દ્રાવણને અંધારામાં મૂકી પ્રકાશની દિશામાં અવલોકન કરવામાં આવે તો તે સ્વચ્છ દેખાય છે અને જો તેને પ્રકાશના પુંજની દિશાના કાટખૂણેથી અવલોકન કરવામાં આવે તો તે સંપૂર્ણપણે કાળી દેખાય છે. આ અસરને ટિંડોલ અસર કહે છે.
પ્રશ્ન 24.
પાયસના ચાર ઉપયોગ જણાવો.
ઉત્તર:
(i) સાબુની સ્વચ્છીકરણ પ્રક્રિયા એ પાયસ બનવાના ગુણધર્મ પર આધારિત છે.
(ii) આંતરડામાં થતી પાચનક્રિયા પણ પાયસીકરણ પ્રક્રિયાને આભારી છે.
(iii) જંતુનાશક અને ચેપનાશકને પાણીમાં ઓગાળતા તે પાયસ બનાવે છે.
(iv) પાયસીકરણની પ્રક્રિયા દવાની બનાવટ માટે પણ ઉપયોગી છે.
પ્રશ્ન 25.
મિસેલ શુંઉત્તર: છે ? મિસેલ પ્રણાલીનું ઉદાહરણ આપો.
ઉત્તર:
આપણે સાબુના દ્રાવણનું ઉદાહરણ લઈએ. સાબુ ઉચ્ચ ફેટી ઍસિડના સોડિયમ અથવા પોટૅશિયમ ક્ષારના દ્રાવણ છે અને તેને RCOO– Na+ (જેમ કે, સોડિયમ સ્ટીઅરેટ CH3(CH2)16COO– Na+ દર્શાવી શકાય. જે ઘણા લાટા (bar) સાબુના સંઘટક તરીકે હોય છે).
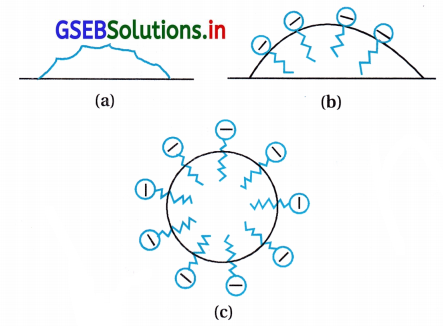
પાણીમાં ઓગાળવામાં આવે ત્યારે તે RCOO– અને Na+ આયનોમાં વિયોજિત થાય છે. RCOO– આયન બે ભાગ ધરાવે છે. લાંબી હાઇડ્રોકાર્બન શૃંખલા R (જેને અધ્રુવીય ‘પુચ્છ’ પણ કહે છે) જે જળવિરાગી (પાણી-અપાકર્ષણ) અને ધ્રુવીય સમૂહ (COO–) (જેને ધ્રુવીય આયનીય શીર્ષ કહેવામાં આવે છે) જે જળઅનુરાગી (પાણી આકર્ષિત) છે.
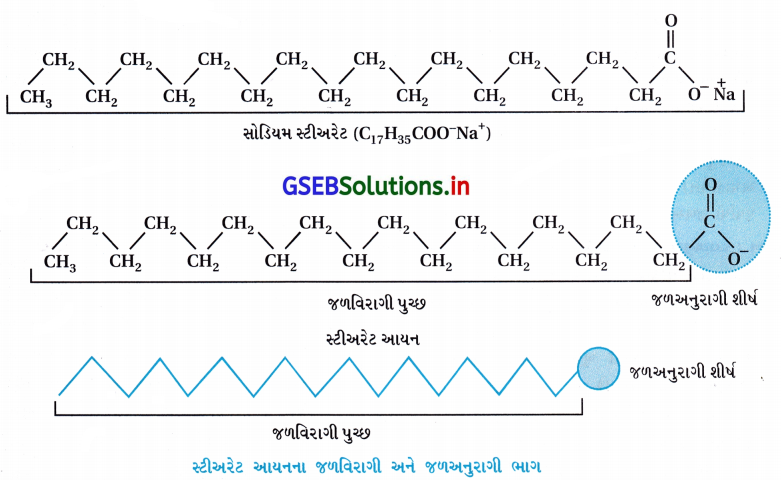
RCOO– આયન સપાટી પર તેમના પાણીમાં COO– સમૂહ સાથે હાજર હોય છે અને હાઇડ્રોકાર્બન શૃંખલા R તેનાથી દૂર રહેલ હોય છે અને સપાટી પર રહે છે. પરંતુ ક્રાંતિક મિસેલ સાંદ્રતાએ ઋણાયન દ્રાવણના જથ્થા તરફ ખેંચાયેલ રહે છે અને સમુચ્ચય થાય છે અને હાઇડ્રોકાર્બન શૃંખલા સાથે ગોળાકાર આકારના બને છે, શૃંખલા ગોળાના કેન્દ્ર તરફની દિશામાં હોય છે. જ્યારે COO– ભાગ ગોળાની બાહ્ય સપાટી પર રહેલા હોય છે. આ પ્રમાણે રચાતો સમુચ્ચય ‘આયનીય મિસેલ’ તરીકે ઓળખાય છે. આ મિસેલ આવા 100 જેટલા આયનો ધરાવે છે.
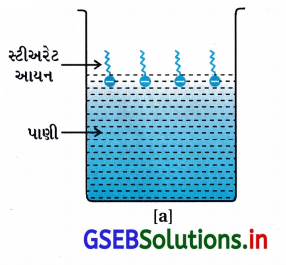
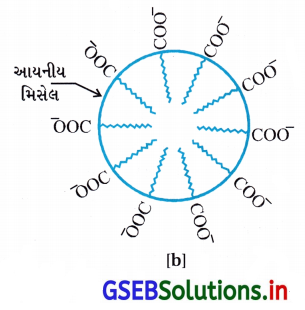
તે જ પ્રમાણે, પ્રક્ષાલકોની બાબતમાં જેમ કે, સોડિયમ લોરિલ સલ્ફેટ CH3(CH2)11SO–4 Na+ ધ્રુવીય સમૂહ- SO–4, લાંબી હાઇડ્રોકાર્બન શૃંખલા સાથે હોય છે. આથી, અહીંયાં થતી મિસેલ રચના સાબુમાં થતી રચના જેવી જ હોય છે.
![]()
પ્રશ્ન 26.
યોગ્ય ઉદાહરણો વડે નીચેના પર્યાયો સમજાવો.
(i) આલ્કોસોલ
(ii) એરોસોલ
(iii) હાઇડ્રોસોલ
ઉત્તર:
(i) આલ્કોસોલ : જે કલિલમય સોલમાં પરિક્ષેપન માધ્યમ આલ્કોહૉલ હોય, તો તેને આલ્કોસોલ કહે છે. આ સોલમાં પરિક્ષેપન કલા ઘન સ્વરૂપે હોય છે. દા.ત., સેલ્યુલોઝ નાઇટ્રેટનું ઇથાઇલ આલ્કોહૉલમાં બનાવેલ આલ્કોસોલ.
(ii) એરોસોલ : કલિલમય સોલ કે જેમાં પરિક્ષેપન માધ્યમ તરીકે વાયુ અને પરિક્ષેપન કલા તરીકે ઘન હોય, તેવા કલિલને એરોસોલ કહે છે. દા.ત., ધૂમાડો.
(iii) હાઇડ્રોસોલ: કલિલમય દ્રાવણ કે જેમાં પરિક્ષેપન માધ્યમ તરીકે પાણી અને પરિક્ષેપન કલા ઘન હોય, તો તેવા સોલને હાઇડ્રોસોલ કહે છે. દા.ત., સ્ટાર્ચનો સોલ, સોનાનો સોલ.
પ્રશ્ન 27.
“કલિલ પદાર્થ નથી પણ પદાર્થની અવસ્થા છે” આ નિવેદન પર આલોચના કરો.
ઉત્તર:
સામાન્ય ક્ષાર બેઝિન દ્રાવણમાં કલિલ તરીકે વર્તે છે. આથી, આપણે કહી શકીએ કે કલિલ પદાર્થ એ પદાર્થની કોઈ અલગ અવસ્થા હોતી નથી, જ્યારે ઘન પદાર્થનું કદ 1 nm થી 1000 nm જેટલું હોય, ત્યારે તે કલિલ તરીકે વર્તે છે. આમ, કહી શકાય કે, કલિલ એ પદાર્થ નહીં પણ પદાર્થની એક અવસ્થા છે જે તેના કદ પર આધારિત છે.
GSEB Class 12 Chemistry પૃષ્ઠ રસાયણ NCERT Exemplar Questions and Answers
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-I)
નીચેના પ્રશ્નોમાં એક જ વિકલ્પ સાચો છે.
પ્રશ્ન 1.
નીચેનામાંથી કયો પ્રક્રમ ભૌતિક કલાઓની અંતરાપૃષ્ઠ પર થતો નથી ?
(A) સ્ફટિકીકરણ
(B) વિષમાંગ ઉદ્દીપન
(C) સમાંગ ઉદ્દીપન
(D) ક્ષારણ
જવાબ
(C) સમાંગ ઉદ્દીપન
સમાંગ ઉદ્દીપન અંતરાપૃષ્ઠ પર થતું નથી. કારણ કે સમાંગ ઉદ્દીપન પ્રક્રિયામાં પ્રક્રિયક અને ઉદ્દીપક એકસરખી ભૌતિક અવસ્થામાં આવેલ હોવાથી તેમાં અંતરાપૃષ્ઠ જોવા મળતું નથી તથા તેઓ સમાંગ રીતે વહેંચાયેલા હોય છે.
પ્રશ્ન 2.
અધિશોષણ પ્રક્રમમાં સંતુલન સ્થિતિએ …………………..
(A) ΔH > 0
(B) ΔH = TΔS
(C) ΔH > TΔS
(D) ΔH < TΔS
જવાબ
(B) ΔH = TΔS
- આપણે જાણીએ છીએ કે સંતુલન સમયે,
ΔG = 0
ΔH – TΔS = 0
ΔΗ = TΔS - આમ, સંતુલન સમયે ઍન્થાલ્પી ફેરફાર એ તાપમાન અને ઍન્ડ્રૉપી ફેરફારના ગુણાકાર જેટલો હોય છે.
પ્રશ્ન 3.
નીચેનામાંથી કયું અંતરાપૃષ્ઠ પ્રાપ્ત કરી શકાતું નથી ?
(A) પ્રવાહી-પ્રવાહી
(B) ઘન-પ્રવાહી
(C) પ્રવાહી-વાયુ
(D) વાયુ-વાયુ
જવાબ
(D) વાયુ-વાયુ
વાયુ-વાયુ વચ્ચે અંતરાપૃષ્ઠ મળતું નથી. કારણ કે તેઓ કુદરતી રીતે એકબીજામાં સંપૂર્ણપણે મિશ્રિત થઈ જાય છે. દા.ત., હવામાં O2, N2, CO2 જેવા વાયુઓ મિશ્ર સ્વરૂપે રહેલા હોય છે.
પ્રશ્ન 4.
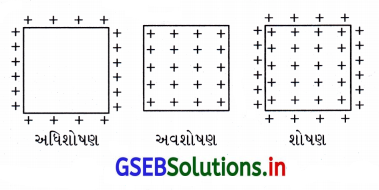
‘શોષણ’ શબ્દ …………………………. માટે વપરાય છે.
(A) અવશોષણ
(B) અધિશોષણ
(C) અવશોષણ અને અધિશોષણ બંને
(D) અપશોષણ
જવાબ
(C) અવશોષણ અને અધિશોષણ બંને
અધિશોષણ અને અવશોષણ એકસાથે પણ થઈ શકે છે. બંને ઘટનાઓનું વર્ણન કરવા માટે પર્યાય ‘શોષણ’ (sorption) વપરાય છે. જે આકૃતિ દ્વારા સમજી શકાય.
પ્રશ્ન 5.
…………………. સાથે વાયુના ભૌતિક અધિશોષણની માત્રા વધે છે.
(A) તાપમાનમાં વધારા
(B) તાપમાનમાં ઘટાડા
(C) અધિશોષકની સપાટીના ક્ષેત્રફળના ઘટાડા
(D) વાન્-ડર-વાલ્સ બળની પ્રબળતાના ઘટવા
જવાબ
(B) તાપમાનમાં ઘટાડા
વાયુના ભૌતિક અધિશોષણમાં તાપમાન ઘટાડતાં અધિશોષણમાં વધારો થાય છે. કારણ કે ભૌતિક અધિશોષણમાં ઘટક કણો અધિશોષકની સપાટી પર નિર્બળ વા-ડર-વાલ્સ પ્રકારના આકર્ષણ બળોથી જોડાયેલા હોય છે. આથી તાપમાન વધતાં તેઓ સહેલાઈથી અપશોષણ પામે છે.
પ્રશ્ન 6.
……………………. સાથે દ્રાવણ કલામાં અધિશોષિતના અધિશોષણની માત્રા વધે છે.
(A) દ્રાવણમાંના અધિશોષિતના જથ્થાના વધવા
(B) અધિશોષકની સપાટીના ક્ષેત્રફળના ઘટાડા
(C) દ્રાવણના તાપમાનમાં વધારા
(D) દ્રાવણમાં અધિશોષિતની માત્રાના ઘટવા
જવાબ
(A) દ્રાવણમાંના અધિશોષિતના જથ્થાના વધવા
દ્રાવણકલામાં અધિશોષિતના અધિશોષણની માત્રા દ્રાવણમાં અધિશોષિતના જથ્થામાં વધારા સાથે વધે છે.
![]()
પ્રશ્ન 7.
નીચેનામાંથી કયું અધિશોષણ પરિઘટના (phenomenon)ને લાગુ પડતું નથી ?
(A) ΔH > 0
(B) ΔG < 0
(C) ΔS < 0
(D) ΔH < 0 જવાબ (A) ΔH > 0
અધિશોષણ ઘટના માટે ΔH < 0 હોય છે. કારણ કે અધિશોષણ ઘટના માટે ઍન્થાલ્પી ફેરફાર હંમેશાં ઋણ હોય છે. અધિશોષણ ક્રિયા દરમિયાન અધિશોષકની સપાટી ઉપર અવશોષી બળોના મૂલ્યમાં ઘટાડો થાય છે. તેથી સપાટી પર ઊર્જામાં પણ ઘટાડો થાય છે. જે ઉષ્મા ઊર્જા સ્વરૂપે જોવા મળે છે. આમ, અધિશોષણ એ ઉષ્માક્ષેપક પ્રક્રિયા છે. જેના માટે ΔH < 0 મળે છે.
પ્રશ્ન 8.
નીચેનામાંથી કઈ પરિસ્થિતિ ભૌતિક અધિશોષણ માટે અનુકૂળ નથી ?
(A) ઊંચું દબાણ
(B) ΔH નું ઋણ મૂલ્ય
(C) અધિશોષિતનું ઊંચું ક્રાંતિક તાપમાન
(D) ઊંચું તાપમાન
જવાબ
(D) ઊંચું તાપમાન
ભૌતિક અધિશોષણ પ્રક્રિયા દરમિયાન અધિશોષિત અધિશોષકની સપાટી પર નિર્બળ વાન્-ડર-વાલ્સ પ્રકારના આકર્ષણ બળોથી જોડાયેલો રહે છે. તાપમાન વધતાં અધિશોષક અને અધિશોષિત વચ્ચે રહેલા આ આકર્ષણ બળ નિર્બળ બને છે અને તેઓ સહેલાઈથી અવશોષણ પામે છે.
પ્રશ્ન 9.
વાયુરૂપ ઘટકોનું ભૌતિક અધિશોષણ કોના દ્વારા રાસાયણિક અધિશોષણમાં પરિવર્તિત થાય છે ?
(A) તાપમાનમાં ઘટાડો
(B) તાપમાનમાં વધારો
(C) અધિશોષકની સપાટીના ક્ષેત્રફળના વધારા
(D) અધિશોષકની સપાટીના ક્ષેત્રફળના ઘટાડા
જવાબ
(B) તાપમાનમાં વધારો
તાપમાન વધારતાં વાયુમય ભૌતિક અધિશોષણનું રૂપાંતર રાસાયણિક અધિશોષણમાં થાય છે. કારણ કે તાપમાન વધારતાં અધિશોષક ઘટકોની સક્રિયકરણ ઊર્જામાં વધારો થાય છે. જે અધિશોષક અને અધિશોષિત વચ્ચે રાસાયણિક બંધ બનાવે છે. આમાં ભૌતિક અધિશોષણનું રાસાયણિક અધિશોષણમાં રૂપાંતર થાય છે.
પ્રશ્ન 10.
ભૌતિક અધિશોષણમાં અધિશોષક કોઈ ચોક્કસ વાયુ માટે લાક્ષણિકતા દર્શાવતું નથી. કારણ કે………………
(A) સંકળાયેલ વાન્-ડર-વાલ્સ આકર્ષણ સાર્વત્રિક હોય છે.
(B) સંકળાયેલ વાયુઓ આદર્શ વાયુની જેમ વર્તે છે.
(C) અધિશોષણની ઍન્થાલ્પી નીચી હોય છે.
(D) તે પ્રતિવર્તી પ્રક્રમ છે.
જવાબ
(A) સંકળાયેલ વાન્-ડર-વાલ્સ આકર્ષણ સાર્વત્રિક હોય છે.
ભૌતિક અધિશોષણ કોઈપણ વાયુઓ માટે વિશિષ્ટ રીતે દર્શાવી શકાતું નથી. કારણ કે તેમાં નિર્બળ વા-ડર-વાલ્સ પ્રકારના આકર્ષણ બળો આવેલા હોય છે. તેઓ સર્વત્ર રીતે છવાયેલા હોય છે. જે દર્શાવે છે કે કોઈ પણ અધિશોષક અને અધિશોષિત વચ્ચે આવેલા વાન્-ડર-વાલ્સ બળો બધા જ વાયુઓ માટે અચળ હોય છે.
પ્રશ્ન 11.
નીચેનામાંથી કયું અવશોષણનું ઉદાહરણ છે ?
(A) સિલિકા જૅલ પર પાણી
(B) કૅલ્શિયમ ક્લોરાઇડ પર પાણી
(C) સૂક્ષ્મ વિભાજિત નિકલ ૫૨ હાઇડ્રોજન
(D) ધાતુ સપાટી પર ઑક્સિજન
જવાબ
(B) કૅલ્શિયમ ક્લોરાઇડ પર પાણી
અવશોષણ એટલે સમગ્ર જથ્થામાં એકસરખી રીતે વિતરણ. કૅલ્શિયમ ક્લોરાઇડ ઉપર પાણી ઉમેરતાં પાણી સમગ્ર કૅલ્શિયમ ક્લોરાઇડમાં ઊંડાણ સુધી પ્રસરે છે, જે અવશોષણનું ઉદાહરણ છે.
પ્રશ્ન 12.
નીચે આપેલા આંકડાઓને આધારે દર્શાવો કે કયો વાયુ ચારકોલના નિશ્ચિત જથ્થા પર સૌથી ઓછો અધિશોષણ થાય છે ?

(A) CO2
(B) SO2
(C) CH4
(D) H2
જવાબ
(D) H2
ક્રાંતિક તાપમાનનું મૂલ્ય જેટલું ઓછું તેટલી અધિશોષણની માત્રા ઘટે છે. અહીં H2 વાયુનું ક્રાંતિક તાપમાન કે જે 33 K આપેલા પૈકી સૌથી ઓછું હોવાથી ચારકોલની સપાટી પર અધિશોષણ સૌથી ઓછું જોવા મળે છે.
![]()
પ્રશ્ન 13.
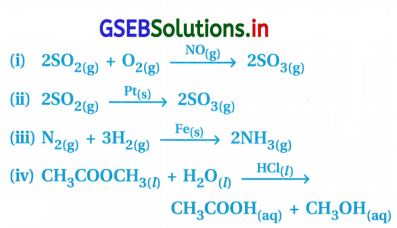
નીચેના પૈકી કઈ પ્રક્રિયામાં વિષમાંગ ઉદ્દીપન સંકળાયેલું છે ?
(A) (ii), (iii)
(B) (ii), (iii) અને (iv)
(C) (i), (ii) અને (iii)
(D) (iv)
જવાબ
(A) (ii), (iii)
પ્રક્રિયા (ii) અને (iii) માં પ્રક્રિયક, નીપજ તેમજ ઉદ્દીપક જુદી- જુદી ભૌતિક અવસ્થામાં આવેલા જોવા મળે છે. આથી આ પ્રક્રિયાઓને વિષમાંગ ઉદ્દીપન પ્રક્રિયા કહે છે.
પ્રશ્ન 14.
પાણીમાં સાબુની સાંદ્રતા વધુ હોય ત્યારે સાબુ ……………………….. ની જેમ વર્તે છે.
(A) આણ્વીય કલિલ
(B) સંગુણિત કલિલ
(C) વિરાટઆણ્વીય કલિલ
(D) દ્રવઅનુરાગી કલિલ
જવાબ
(B) સંગુણિત કલિલ
જ્યારે પાણીમાં સાબુની સાંદ્રતા ખૂબ વધારે હોય છે ત્યારે પાણીમાં રહેલા સાબુના કણો જોડાઈને સંગુણિત કલિલ બનાવે છે.
પ્રશ્ન 15.
નીચેનામાંથી કર્યું ટિંડલ અસર દર્શાવશે ?
(A) ક્રાંતિક મિસેલ સાંદ્રતાથી નીચે સાબુનું જલીય દ્રાવણ
(B) ક્રાંતિક મિસેલ સાંદ્રતાથી ઉપર સાબુનું જલીય દ્રાવણ
(C) સોડિયમ ક્લોરાઇડનું જલીય દ્રાવણ
(D) પાણીનું જલીય દ્રાવણ
જવાબ
(B) ક્રાંતિક મિસેલ સાંદ્રતાથી ઉપર સાબુનું જલીય દ્રાવણ
ક્રાંતિક મિસેલ સાંદ્રતા કરતાં ઊંચી સાંદ્રતાએ રહેલ સાબુનું જલીય દ્રાવણ કલિલમય દ્રાવણ બને છે. ટિંડલ અસર એ કલિલમય દ્રાવણની વિશિષ્ટ અસર છે જે આ દ્રાવણમાં જોવા મળે છે.
પ્રશ્ન 16.
કઈ પદ્ધતિ દ્વારા દ્રવવિરાગી સોલનું રક્ષણ કરી શકાય ?
(A) વિરુદ્ધ વીજભાર ધરાવતાં સોલના ઉમેરણ દ્વારા
(B) વિદ્યુતવિભાજ્યના ઉમેરણ દ્વારા
(C) વ્રવિરાગી સોલના ઉમેરણ દ્વારા
(D) ઉકાળીને
જવાબ
(C) દ્રવિરાગી સોલના ઉમેરણ દ્વારા
દ્રવિરાગી કલિલ સોલને સાચવવા માટે દ્રવઅનુરાગી સોલ ઉમેરવામાં આવે છે. દ્રવિરાગી કલિલને હલાવવાથી, ગરમ કરવાથી તથા થોડા પ્રમાણમાં જ વિદ્યુતવિભાજ્ય ઉમેરવાથી તેનું અવક્ષેપન થાય છે. આથી તેમને સ્થાયી બનાવવા સ્થાયીકારક તરીકે દ્રવઅનુરાગી કલિલ સોલ ઉમેરવામાં આવે છે.
પ્રશ્ન 17.
તાજા બનાવેલા અવક્ષેપ કેટલીક વખત …………………….. દ્વારા કલિલમાં રૂપાંતરિત થાય છે.
(A) સ્કંદન
(B) વિદ્યુતવિભાજન
(C) પ્રસરણ (diffusion)
(D) પેપ્ટીકરણ
જવાબ
(D) પેપ્ટીકરણ
તાજા બનાવેલા અવક્ષેપ કેટલીક વખત કલિલમય દ્રાવણમાં પેપ્ટીકરણ દ્વારા રૂપાંતર પામે છે. પેપ્ટીકરણ દ્વારા તાજા બનાવેલા અવક્ષેપને કલિલમય સોલમાં ફેરવવામાં આવે છે.
પ્રશ્ન 18.
નીચેના વિધુતવિભાજ્યોમાંથી AgI / Ag+ સોલ માટે કોનું સ્કંદન-મૂલ્ય વધુ હશે ?
(A) Na2S
(B) Na3PO4
(C) Na2SO4
(D) NaCl
જવાબ
(D) NaCl
હાર્ડી અને શુલ્કના નિયમ મુજબ ઋણ આયન પરનો વિદ્યુતભાર જેટલો વધારે તેટલી તેની સ્કંદનશક્તિ વધારે હોય છે.
| વિદ્યુતવિભાજ્ય | ઋણઆયન | ઋણ આયન પરનો વિદ્યુતભાર |
| Na2S | S2- | 2 |
| Na3PO4 | \(\mathrm{PO}_4^{3-}\) | 3 |
| Na2SO4 | SO2-4 | 2 |
| NaCl | Cl– | 1 |
અહીં, \(\mathrm{PO}_4^{3-}\) નો વીજભાર મહત્તમ હોવાથી તેની સ્કંદન ક્ષમતા મહત્તમ હોય છે.
![]()
પ્રશ્ન 19.
કલિલ પ્રણાલી કે જેમાં ઘન પદાર્થ વિક્ષેપિત કલા સ્વરૂપમાં અને વિક્ષેપન પ્રવાહી પદાર્થ માધ્યમ સ્વરૂપમાં હોય તેને ………………….. તરીકે વર્ગીકૃત થાય.
(A) ઘન સોલ
(B) જૅલ
(C) ઇમલ્શન (પાયસ)
(D) સોલ
જવાબ
(D) સોલ
સોલ એ પ્રકારના કલિલ છે કે જેમાં પરિક્ષેપિત કલા ઘન અને પરિક્ષેપન માધ્યમ પ્રવાહી હોય છે. દા.ત., રંગ અને કોષદ્રવ્ય.
પ્રશ્ન 20.
કલિલ દ્રાવણના સંખ્યાત્મક ગુણધર્મોનાં મૂલ્ય સમાન સાંદ્રતા ધરાવતાં સાચાં દ્રાવણોની સરખામણીમાં નાના હોય છે. કારણ કે કલિલ કણો ………………….
(A) વિસ્તૃત પૃષ્ઠ-ક્ષેત્રફળ દર્શાવે છે.
(B) વિક્ષેપન માધ્યમમાં નિલંબિત રહે છે.
(C) દ્રવઅનુરાગી કલિલ બનાવે છે.
(D) પ્રમાણમાં ઓછી સંખ્યામાં હોય છે.
જવાબ
(D) પ્રમાણમાં ઓછી સંખ્યામાં હોય છે.
કલિલકણોના સંખ્યાત્મક ગુણધર્મો સાચા દ્રાવણ કરતાં ભિન્ન હોય છે. કારણ કે એક સમાન સાંદ્રતા ધરાવતા કલિલસોલમાં સાચા દ્રાવણ કરતાં ઘટકકણોની સંખ્યા ઓછી હોય છે.
પ્રશ્ન 21.
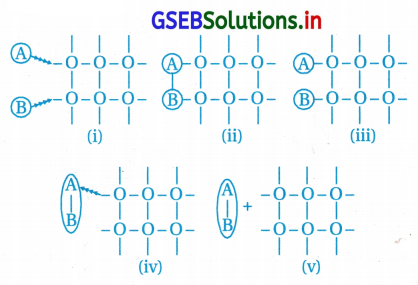
નીચેની આકૃતિઓને આધુનિક અધિશોષણ સિદ્ધાંત પ્રમાણે ઉદ્દીપનની ક્રિયાવિધિમાં સંકળાયેલા તબક્કાઓના સાચા ક્રમમાં ગોઠવો.
(A) i → ii → iii → iv → v
(B) i → iii → ii → iv → v
(C) i → iii → ii → v → iv
(D) i → ii → iii → v → iv
જવાબ
(B) i → iii→ ii → iv → v
દરેક આકૃતિ નીચે પ્રમાણેની પ્રક્રિયા દર્શાવે છે. i → iii(A) અને (B) પ્રક્રિયકનું સપાટી પર થતું અધિશોષણ.
iii → ii(A) અને (B) વચ્ચે આંતરક્રિયાથી બનતું મધ્યસ્થી
ii → iv, A B ને થતાં અવશોષણની શરૂઆત iv → v.
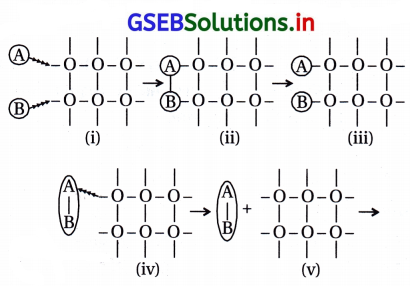
પ્રશ્ન 22.
નદી અને સમુદ્રના મળવાના સ્થાન પર મુખત્રિકોણ (delta) બનવા માટે નીચેનામાંથી કયો પ્રક્રમ જવાબદાર છે ?
(A) પાયસીકરણ
(B) કલિલનું નિર્માણ
(C) સ્કંદન
(D) પેપ્ટીકરણ
જવાબ
(C) સ્કંદન
નદીનું પાણી એ માટી તથા સમુદ્રના પાણીના મિશ્રણથી કલિલમય દ્રાવણ બનાવે છે. પાણીમાં વિવિધ વિદ્યુતવિભાજ્ય આવેલા હોય છે. જ્યારે નદીનું આ પાણી સમુદ્રના પાણીમાં મિશ્ર થાય છે ત્યારે પાણીમાં રહેલા વિદ્યુતવિભાજ્યનું સ્પંદન થઈ તેઓ મુખત્રિકોણ સ્વરૂપે જમા થાય છે.
પ્રશ્ન 23.
નીચેનામાંથી કયો આલેખ ફ્રેન્ડલીચ અધિશોષણ સમતાપી સાથે સંકળાયેલ છે ?
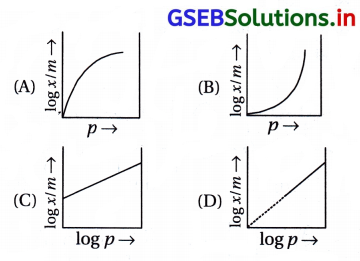
જવાબ
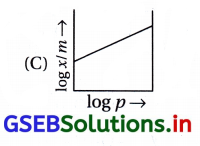
ફ્રેન્ડલીચ અધિશોષણ સમતાપી વક્ર મુજબ \(\frac{x}{m}=k p^{\frac{1}{n}}\)

સીધી રેખાના સમીકરણ સાથે સરખાવતાં અને log-\(\frac{x}{m}\) વિરુદ્ધ log p નો આલેખ દોરતાં સીધી રેખાના આંતરછેદનું મૂલ્ય log k જેટલું તથા ઢાળનું મૂલ્ય \(\frac{1}{n}\) જેટલું મળે છે.
પ્રશ્ન 24.
નીચેનામાંથી કયો પ્રક્રમ સોલ કણો પર વીજભારની હાજરી માટે જવાબદાર નથી ?
(A) સોલ કણો દ્વારા ઇલેક્ટ્રૉન ગ્રહણ
(B) દ્રાવણમાંથી આયનીય કણોનું અધિશોષણ
(C) હેલ્મહોલ્સ વીજભારિત બેવડાં આવરણોનું બનવું
(D) દ્રાવણમાંથી આયનીય કણોનું અવશોષણ
જવાબ
(D) દ્રાવણમાંથી આયનીય કણોનું અવશોષણ
![]()
પ્રશ્ન 25.
આકૃતિમાં દર્શાવલ પ્રક્રમ નીચેનામાંથી કઈ સંકલ્પનાને લાગુ પડે છે ?
(A) અવશોષણ
(B) અધિશોષણ
(C) સ્કંદન
(D) પાયસીકરણ
જવાબ
(B) અધિશોષણ
ઉપર આપેલી પ્રક્રિયા સક્રિય ચારકોલ વડે થતું અધિશોષણ દર્શાવતી પ્રક્રિયા છે.
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-II)
નીચેના પ્રશ્નોમાં બે કે વધારે વિકલ્પો સાચાં હોઈ શકે છે.
પ્રશ્ન 1.
નીચેનામાંથી કયા વિકલ્પો સાચાં છે ?
(A) બધાં જ તાપમાને સાબુ દ્વારા જલીય દ્રાવણ મિસેલ બનવું શક્ય છે.
(B) ચોક્કસ સાંદ્રતાથી ઉપ૨ની સાંદ્રતાએ સાબુ દ્વારા જલીય દ્રાવણ મિસેલ બને છે.
(C) સાબુના દ્રાવણનું મંદન કરતાં મિસેલ ફરીથી અલગ અલગ આયનોમાં ફેરવાય છે.
(D) સાબુનું દ્રાવણ બધી જ સાંદ્રતાએ સામાન્ય પ્રબળ વિદ્યુત- વિભાજ્યની જેમ વર્તન કરે છે.
જવાબ
(B), (C)
- મિસેલની રચના અમુક ખાસ સાંદ્રતાથી ઊંચી સાંદ્રતાએ જ જોવા મળે છે. તે સાંદ્રતાને ક્રાંતિક મિસેલ સાંદ્રતા કહે છે. દા.ત., સાબુ માટે ક્રાંતિક મિસેલ સાંદ્રતા 10-4 થી 10-3 mol L-1 હોય છે.
- સાબુના દ્રાવણને મંદ કરતાં તે સામાન્ય વિદ્યુતવિભાજ્ય તરીકે વર્તે છે અને સાબુ અને પાણી વચ્ચેના આંતરઆણ્વીય આકર્ષણ બળો ઘટે છે. આથી આ કલિલ પરત વ્યક્તિગત આયનમાં ફેરવાય છે.
પ્રશ્ન 2.
ઘન ઉદ્દીપક માટે નીચેનામાંથી કયા વિધાનો સાચાં છે ?
(A) સમાન પ્રક્રિયકો જુદા-જુદા ઉદ્દીપકોના ઉપયોગથી જુદી- જુદી નીપજો આપે છે.
(B) ઉદ્દીપક પ્રક્રિયાનો ΔH બદલતા નથી.
(C) પ્રક્રિયાઓના ઉદ્દીપન માટે મોટા જથ્થામાં ઉદ્દીપકની જરૂર હોય છે.
(D) ઘન ઉદ્દીપકની ઉદ્દીપન સક્રિયતા રાસાયણિક અધિશોષણની પ્રબળતા ઉપર આધારિત નથી.
જવાબ
(A), (B)
(A) સમાન પ્રક્રિયકો દ્વારા જુદી જુદી નીપજો મળી શકે છે. જો આ પ્રક્રિયાઓમાં જુદા જુદા ઉદ્દીપક વાપરવામાં આવે તો ઉદ્દીપકના આ ગુણધર્મને વરણાત્મક તરીકે ઓળખવામાં આવે છે. દા.ત., H2 અને CO પ્રક્રિયકો દ્વારા જુદા જુદા ઉદ્દીપક વાપરી નીચે મુજબ જુદી જુદી નીપજો મેળવી શકાય છે.
(B) ઉદ્દીપક પ્રક્રિયાના ΔHના મૂલ્યમાં કોઈ ફેરફાર કરતો નથી. કારણ કે ΔH એ નીપજ અને પ્રક્રિયકોની ઍન્થાલ્પીનો ફેરફાર દર્શાવે છે.
પ્રશ્ન 3.
ફ્રેન્ડલીચ અધિશોષણ સમતાપીને \(\frac{x}{m}\) = k . \(p^{\frac{1}{n}}\) સૂત્ર દ્વારા દર્શાવાય છે. આ સૂત્ર પરથી નીચેનામાંથી કયું તારણ કરી શકાય ?
(A) જ્યારે \(\frac{1}{n}\) = 0 હોય, ત્યારે અધિશોષણ દબાણથી સ્વતંત્ર હોય છે.
(B) જ્યારે \(\frac{1}{n}\) = 0 હોય, ત્યારે અધિશોષણ દબાણના સીધા જ સમપ્રમાણમાં હોય છે.
(C) જ્યારે n = 0 હોય, ત્યારે \(\frac{x}{m}\) વિરુદ્ધ p નો આલેખ X-અક્ષને સમાંતર હોય છે.
(D) જ્યારે n = હોય, ત્યારે \(\frac{x}{m}\) વિરુદ્ધ p નો આલેખ વક્ર હોય છે.
જવાબ
(A), (C)
- (A) ફ્રેન્ડલીચ અધિશોષણ સમતાપી મુજબ,
\(\frac{x}{m} \propto p^{\frac{1}{n}}\) ⇒ \(\frac{x}{m}=k p^{\frac{1}{n}}\)
જ્યારે \(\frac{1}{n}\) = 0 લેતાં ઉપરના સમીકરણ મુજબ,
\(\frac{x}{m}\) = kp0 = k
આમ, અધિશોષણ એ દબાણથી સ્વતંત્ર બને છે. - (C) જ્યારે n = 0 લેતાં ઉપરના સમીકરણ મુજબ
\(\frac{x}{m}=k p^{\frac{1}{0}}\) = kp∞ આમ, વિરુદ્ધ \(\frac{x}{m}\) નો આલેખ બાજુમાં દર્શાવ્યા મુજબ દોરી શકાય.
પ્રશ્ન 4.
સરળતાથી પ્રવાહીકરણ થઈ શકે તેવા વાયુઓની સરખામણીમાં H2 વાયુ સક્રિયકૃત ચારકોલ પર બહુ જ અલ્પપ્રમાણમાં …………………….. ને કારણે અધિશોષિત થાય છે.
(A) અતિ પ્રબળ વાન્-ડર-વાલ્સ આકર્ષણ બળો
(B) અતિ નિર્બળ વા-ડર-વાલ્સ આકર્ષણ બળો
(C) અતિ નીચા ક્રાંતિક તાપમાન
(D) અતિ ઊંચા ક્રાંતિક તાપમાન
જવાબ
(B), (C)
પ્રશ્ન 5.
નીચેનામાંથી કાં વિધાનો સાચાં છે ?
(A) બે વિરુદ્ધ વીજભાર ધરાવતા સોલને મિશ્ર કરતાં તેઓ એકબીજાના વીજભારોને તટસ્થ કરે છે અને કલિલને સ્થાયી બનાવે છે.
(B) કલિલ કણો પર સમાન અને એક જ પ્રકારનો વીજભાર કલિલને સ્થાયિતા આપે છે.
(C) પાયસને અસ્થાયી બનાવ્યા વગર તેમાં વિક્ષેપિત પ્રવાહીનો કોઈ પણ જથ્થો ઉમેરી શકાય છે.
(D) બ્રાઉનિયન ગતિ સોલને સ્થાયી બનાવે છે.
જવાબ
(B), (D)
એકસરખા મૂલ્યના અને સમાન ભારવાળા કણો કલિલમય સોલને સ્થાયી બનાવે છે. કારણ કે જ્યારે એકસમાન વીજભાર ધરાવતા કણો એકબીજાની નજીક આવે ત્યારે તેઓ વચ્ચે અપાકર્ષણ ઉદ્ભવે છે અને જે કલિલ કણોને એકબીજાની નજીક આવતાં રોકે છે.
![]()
પ્રશ્ન 6.
પાયસને ……………………. અને ……………….. દ્વારા તોડી શકાય નહિ.
(A) ગરમ કરવાની ક્રિયા
(B) વધુ માત્રામાં વિક્ષેપન માધ્યમ ઉમેરવાની ક્રિયા
(C) ઠારણની પ્રક્રિયા
(D) પાયસીકારકના ઉમેરણની ક્રિયા
જવાબ
(B), (D)
પાયસ એ પ્રવાહી-પ્રવાહી પ્રકારનું કલિલ છે. તેમાં વધારે પ્રમાણમાં જો પરિક્ષેપન માધ્યમ કે પાયસીકારક પદાર્થ ઉમેરીએ તો તે મંદ થાય છે પરંતુ તૂટતું નથી.
પ્રશ્ન 7.
નીચેનામાંથી કયો પદાર્થ ઋણવીજભારિત પાયસને અવક્ષેપિત કરશે ?
(A) KCl
(B) ગ્લુકોઝ
(C) યૂરિયા
(D) NaCl
જવાબ
(A), (D)
- પાયસમાં આવેલા ઘટકકણોમાં ઋણ વીજભાર હાજર હોય છે. તેનું અવક્ષેપન કરવા માટે KCl અને NaCl જેવા વિદ્યુત- વિભાજ્ય ઉમેરવામાં આવે છે.
- ગ્લુકોઝ અને યૂરિયાને પાણીમાં ઓગાળતાં તેઓ આયનો બનાવી” શકતા નથી. આથી તેઓને વિદ્યુત અવિભાજ્ય ઘટકો કહે છે તથા તેઓ કલિલનું અવક્ષેપન કરી શકતા નથી.
પ્રશ્ન 8.
નીચેના પૈકી કયા કલિલ સરળતાથી સ્કંદન પામી શકતા નથી ?
(A) દ્રવિરાગી કલિલ
(B) અપ્રતિવર્તી કલિલ
(C) પ્રતિવર્તી કલિલ
(D) દ્રવઅનુરાગી કલિલ
જવાબ
(C), (D)
દ્રવઅનુરાગી કલિલ કે જે પરિવર્તનીય કલિલ તરીકે જાણીતા છે. તેઓનું સ્પંદન સહેલાઈથી થતું નથી. તેમની સ્થાયિતા નીચેના બે પરિબળોના કારણે જોવા મળે છે :
(i) કલિલ કણો ઉપરના વીજભાર
(ii) કલિલ કણોના સૉલ્વેશન (સંયોગીકરણ) ગુણધર્મના કારણે
પ્રશ્ન 9.
વ્રવવિરાગી સોલમાં દ્રવઅનુરાગી સોલ ઉમેરતાં શું થશે ?
(A) દ્રવિરાગી સોલનું રક્ષણ થાય છે.
(B) દ્રવઅનુરાગી સોલનું રક્ષણ થાય છે.
(C) દ્રવિરાગી સોલ ઉપર દ્રવઅનુરાગી સોલનું આવરણ બને છે.
(D) દ્રવઅનુરાગી સોલ ઉપર દ્રવિરાગી સોલનું આવરણ બને છે.
જવાબ
(A), (C)
દ્રવિરાગી કલિલ સ્વભાવે સર્વત્ર અસ્થાયી હોય છે. જ્યારે દ્રવઅનુરાગી કલિલ દ્રવિરાગી કલિલમાં ઉમેરવામાં આવે ત્યારે દ્રવિરાગી સોલ સચવાય છે. કારણ કે દ્રવઅનુરાગી કલિલ દ્રવિરાગી કલિલ પર સ્તર બનાવે છે.
પ્રશ્ન 10.
જ્યારે એક કલિલ દ્રાવણ પર વિધુતીય ક્ષેત્ર લાગુ પાડવામાં આવે અને વિદ્યુતકણ સંચલનને અટકાવવામાં આવે ત્યારે કઈ પરિઘટના બને છે ?
(A) પ્રતિઅભિસરણ થાય છે.
(B) વિદ્યુતીય અભિસરણ થાય છે.
(C) વિક્ષેપન માધ્યમ ખસવાનું શરૂ કરે છે.
(D) વિક્ષેપન માધ્યમ સ્થિર થઈ જાય છે.
જવાબ
(B), (C)
વિદ્યુતકણ સંચલન એટલે કે કણોની હેરફેરને કેટલીક યોગ્ય રીતથી (means) રોકવામાં આવે છે ત્યારે, એવું અવલોકન કરવામાં આવે છે કે પરિક્ષેપન માધ્યમ વિદ્યુતીય ક્ષેત્રમાં ખસવાનું શરૂ કરે છે. આ પરિઘટનાને વિદ્યુતપરાસરણ (વિદ્યુતઅભિસરણ) કહેવામાં આવે છે.
પ્રશ્ન 11.
પ્રક્રિયામાં ઉદ્દીપક ……………………… પરિવર્તિત થાય છે.
(A) ભૌતિક રીતે
(B) ગુણાત્મક રીતે
(C) રાસાયણિક રીતે
(D) માત્રાત્મક રીતે
જવાબ
(A), (B)
પ્રક્રિયામાં ઉદ્દીપક દ્વારા ભૌતિક તેમજ ગુણાત્મક ફેરફાર થાય છે. જ્યારે માત્રાત્મક તેમજ રાસાયણિક ફેરફાર થઈ શકતા નથી.
![]()
પ્રશ્ન 12.
જ્યારે ચોકને શાહીમાં ડુબાડવામાં આવે છે ત્યારે નીચેનામાંથી કઈ પરિઘટના બને છે ?
(A) રંગીન પદાર્થનું અધિશોષણ
(B) દ્રાવકનું અધિશોષણ
(C) દ્રાવકનું અધિશોષણ અને અવશોષણ બંને
(D) દ્રાવકનું અવશોષણ
જવાબ
(A), (D)
જ્યારે ચૉકને શાહીમાં ડુબાડવામાં આવે ત્યારે અધિશોષણ અને અવશોષણ બંને થાય છે. ચૉકના ટુકડાની સપાટી પર રંગીન પદાર્થનું અધિશોષણ થાય છે. જ્યારે ચૉકના ટુકડાની અંદર ઊંડે સુધી દ્રાવકનું અવશોષણ થાય છે.
ટૂંક જવાબી પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
પૃષ્ઠ રસાયણના અભ્યાસમાં શા માટે પૃષ્ઠ ચોખ્ખી હોવી તે મહત્ત્વનું છે ?
ઉત્તર:
પૃષ્ઠ અભ્યાસને કાળજીપૂર્વક પૂર્ણ કરવા માટે સપાટીને સ્વચ્છ કરવામાં આવે છે. કારણ કે તે અધિશોષિત થતા કણોને અધિશોષણ પામવામાં મદદ કરે છે. દા.ત., જો કાચની સપાટી હવા વડે ઢંકાયેલી હોય તો અન્ય વાયુને અધિશોષણ માટે સપાટી પ્રાપ્ત થતી નથી. આમ, પૃષ્ઠ અભ્યાસને કાળજીપૂર્વક પૂર્ણ કરવા માટે સપાટીને સ્વચ્છ રાખવી જોઈએ.
પ્રશ્ન 2.
રાસાયણિક અધિશોષણને સક્રિયકૃત અધિશોષણ તરીકે શા માટે માનવામાં આવે છે ?
ઉત્તર:
રાસાયણિક અધિશોષણને સક્રિયકૃત અધિશોષણ કહે છે. કારણ કે તેમાં પ્રક્રિયક તથા અધિશોષિત કણ વચ્ચે રાસાયણિક બંધ બને છે અને આ બંધ બનવા માટે ઊંચી સક્રિયકરણ ઊર્જાની જરૂર પડે છે. આમ, તાપમાન વધારતાં તેની સક્રિયતા વધે છે.
પ્રશ્ન 3.
સાબુને પાણીમાં ભિન્ન સાંદ્રતાઓમાં દ્રાવ્ય કરતાં કયા પ્રકારનાં દ્રાવણ બને છે ?
ઉત્તર:
નીચી સાંદ્રતાએ સાબુ જલીય દ્રાવણમાં વિદ્યુતવિભાજ્ય તરીકે વર્તે છે. જ્યારે યોગ્ય સાંદ્રતા કે જે ક્રાંતિક મિસેલ સાંદ્રતા તરીકે ઓળખાય છે, તેનાથી ઊંચી સાંદ્રતાએ તે કલિલમય દ્રાવણ આપે છે. સાબુના દ્રાવણ માટે ક્રાંતિક મિસેલ સાંદ્રતાનું મૂલ્ય 10-4 થી 10-3 મોલ લિટર-1 જેટલું હોય છે.
પ્રશ્ન 4.
જ્યારે ગોલ્ડ સોલમાં જિલેટીન મિશ્ર કરવામાં આવે છે ત્યારે શું થાય છે ?
ઉત્તર:
ગોલ્ડ સોલ અપાકર્ષી સોલ હોય છે. તે દ્રવિરાગી હોવાથી સ્વભાવે અસ્થાયી હોય છે. તેમાં જિલેટીન ઉમેરવાથી તે સ્થાયી થાય છે. કારણ કે જિલેટીન દ્રવઅનુરાગી સોલ બનાવે છે, જે ગોલ્ડ સોલને સાચવે છે.
પ્રશ્ન 5.
વાદળો પર સિલ્વર આયોડાઇડના છંટકાવથી કૃત્રિમ વરસાદ ઉત્પન્ન કરવો કેવી રીતે સંભવ છે ?
ઉત્તર:
જ્યારે વિરુદ્ધ વીજભાર ધરાવતા વાદળો એકબીજા સાથે અથડાય ત્યારે કૃત્રિમ વર્ષા થઈ શકે છે. વાદળો સ્વભાવે કલિલ હોવાથી વિદ્યુતભાર ધરાવે છે. સિલ્વર આયોડાઇડના દ્રાવણનો છંટકાવ કરવાથી કલિલકણોનું સ્પંદન વરસાદરૂપે થાય છે.
![]()
પ્રશ્ન 6.
આઇસક્રીમમાં જિલેટીન કે જે એક પેપ્ટાઈડ છે, મિશ્ર કરવામાં આવે છે. તેની ભૂમિકા શી હોઈ શકે ?
ઉત્તર:
પાયસીકારક કે જે પાયસને સ્થાયી બનાવે છે. આ ગુણધર્મના લીધે પાયસીકારકને પાયસમાં ઉમેરવામાં આવે છે. પાયસીકારક એ પરિક્ષેપન માધ્યમ અને પરિક્ષેપન કલા વચ્ચે સ્તર બનાવે છે. આ સ્તર વડે તે પાયસને સ્થાયી બનાવે છે. અહીં, આઇસક્રીમ એ પાયસ છે અને જિલેટીન (પાયસીકારક) તેને સ્થાયી બનાવે છે.
પ્રશ્ન 7.
કોલોડિયન શું છે ?
ઉત્તર:
નાઇટ્રોસેલ્યુલોઝનું આલ્કોહૉલ અને ઈથરમાં બનાવેલા 4% દ્રાવણને કોલોડિયન (collodion) કહે છે.
પ્રશ્ન 8.
પાણીને શુદ્ધ કરવા માટે આપણે તેમાં ફટકડી (એલમ) શા માટે ઉમેરીએ છીએ ?
ઉત્તર:
પાણીને શુદ્ધ કરવા માટે તેમાં એલમ (ફટકડી) ઉમેરવામાં આવે છે. કારણ કે તે પાણીમાં રહેલી કલિલમય અશુદ્ધિઓનું સ્પંદન કરે છે. આ અશુદ્ધિઓ સ્કંદન પામી પાણીના તળિયે જમા થાય છે. જેને ગાળણ ક્રિયા દ્વારા દૂર કરવામાં આવે છે. આમ, એલમના આ કાર્ય માટે તેને પાણીમાં ઉમેરવામાં આવે છે.
પ્રશ્ન 9.
જ્યારે કલિલ દ્રાવણ પર વિધુતીય ક્ષેત્ર લાગુ પાડવામાં આવે ત્યારે શું થાય છે ?
ઉત્તર:
જ્યારે કલિલમય કણોને વિદ્યુતક્ષેત્રમાં રાખવામાં આવે ત્યારે કલિલમય કણો એકબીજાથી વિરુદ્ધ ભાર ધરાવતાં વિદ્યુતધ્રુવ તરફ ખસે છે. ધનભારયુક્ત કણ કૅથોડ તરફ જાય છે જ્યારે ઋણભારયુક્ત કણ ઍનોડ તરફ જાય છે. આ પ્રક્રિયાને વિદ્યુતકણ સંચલન પણ કહે છે.
પ્રશ્ન 10.
કલિલ વિક્ષેપનમાં બ્રાઉનિયન ગતિ કયા કારણે થાય છે ?
ઉત્તર:
- કલિલકણો જ્યારે કલિલસોલમાં વાંકીચૂંકી ગતિ કરે તો આ ગતિને બ્રાઉનિયન ગતિ તરીકે ઓળખવામાં આવે છે.
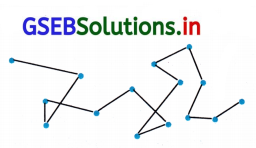
- બ્રાઉનિયન ગતિની સમજણનું કારણ એ છે કે પરિક્ષેપન માધ્યમમાં અણુઓ વડે કણો પરનો અસંતુલિત બૉમ્બમારો બ્રાઉનિયન ગતિને વિલોડન અસર હોય છે. જે કણોને ઠરવા દેતા નથી અને સોલની સ્થાયિતા માટે જવાબદાર છે.
પ્રશ્ન 11.
ગરમ પાણીના અધિક પ્રમાણમાં FeCl3 ઉમેરીને કલિલ બને છે. આ કલિલમાં NaCl વધુ પ્રમાણમાં ઉમેરતાં શું થાય છે ?
ઉત્તર:
ધન વીજભારિત આયન એ ઋણ વીજભારિત સોલનું કંદન કરે છે અને ઋણ વીજભારિત આયન ધન વીજભારિત સોલનું સ્કંદન કરે છે. વધારે FeCl3 ને પાણીમાં ઓગાળતાં ધન વીજભારિત જલીય ફેરિક ઑક્સાઇડનું સોલ મળે છે. તેમાં વધારે પ્રમાણમાં NaCl ઉમેરતાં Cl– આયન ધન વીજભારિત જલીય ફેરિક ઑક્સાઇડના સોલનું સ્પંદન કરે છે.
![]()
પ્રશ્ન 12.
પાયસીકારક પાયસને કઈ રીતે સ્થાયી બનાવે છે ?
ઉત્તર:
પાયસીકા૨ક એ પરિક્ષેપન કણ અને પરિક્ષેપન માધ્યમને અલગ પાડતું સ્તર રચે છે. આમ, આ સ્તર વડે તે પાયસને સ્થાયી કરે છે.
પ્રશ્ન 13.
કેટલીક દવાઓ કલિલ સ્વરૂપમાં શા માટે વધુ અસરકારક છે ?
ઉત્તર:
કેટલીક દવાઓ કલિલ સ્વરૂપમાં વધુ અસરકારક હોય છે.
કારણ કે તેમને વિશાળ સપાટીક્ષેત્ર હોય છે. આથી તેઓ શરીરમાં સહેલાઈથી પરિપાચન પામે છે.
પ્રશ્ન 14.
ચર્મશોધન (Tanning) પછી ચામડું કડક શા માટે થાય છે ?
ઉત્તર:
પ્રાણીઓના ચર્મ સ્વભાવે કલિલમય છે, જ્યારે ચર્મ જેમાં ધનભારિત કલિલમય કણો હોય છે. તેને ટેનિનમાં ડુબાડવામાં આવે છે ત્યારે પારસ્પરિક સ્પંદન થાય છે અને ચામડું કડક બને છે.
પ્રશ્ન 15.
કોઢેલ અવક્ષેપકમાં કલિલમય ધુમાડાનું અવક્ષેપન કેવી રીતે થાય છે ?
ઉત્તર:
ચીમનીમાંથી ધુમાડો બહાર આવે તે પહેલાં તેને એક ચેમ્બરમાંથી પસાર કરવામાં આવે છે. જેમાં ધુમાડા વડે વહન કરતાં વીજભારની વિરુદ્ધ ભાર ધરાવતી પ્લેટો હોય છે. જ્યારે ધુમાડાના કણો આ પ્લેટોના સંપર્કમાં આવે છે, ત્યારે તેમનો વીજભાર પ્લેટો પર ગુમાવે છે અને અવક્ષેપિત થાય છે. આમ, કણો ચેમ્બરના તળિયા પર ગોઠવાઈ જાય છે. આ અવક્ષેપને કોટ્રેલ અવક્ષેપક કહે છે.
પ્રશ્ન 16.
તમે એક પાયસમાં વિક્ષેપન માધ્યમ અને વિક્ષેપન કલાનો ભેદ કઈ રીતે કરશો ?
ઉત્તર:
વિક્ષેપન માધ્યમ અને વિક્ષેપન કલા વચ્ચે ભેદ કરવા માટે કોઈ પણ એકની સાંદ્રતા વધારી ફેરફાર નોંધી શકાય છે. જ્યારે કલિલમાં વિક્ષેપન માધ્યમ ઉમેરવામાં આવે ત્યારે કલિલ મંદ થાય છે પણ જ્યારે તેમાં વિક્ષેપન કલા ઉમેરવામાં આવે ત્યારે એક અલગ જ સ્તર ઉત્પન્ન થાય છે.
પ્રશ્ન 17.
હાર્ડી-શુઝના નિયમોને આધારે સમજાવો કે ફૉસ્ફેટની સ્કંદનશક્તિ ક્લોરાઇડની સરખામણીમાં ઊંચી શા માટે છે ?
ઉત્તર:
વિદ્યુતવિભાજ્યનું ઓછામાં ઓછું મૂલ્ય કે જે કલિલમય સોલનું અવક્ષેપન કરે છે તેને સ્કંદન મૂલ્ય કહેવામાં આવે છે. શુલ્ક અને હાર્ડીના નિયમ મુજબ ઉમેરેલા ઉર્ણીતકર્તા આયનની સંયોજકતા જેટલી વધારે તેટલી વધારે અવક્ષેપન કરવાની શક્તિ. ફૉસ્ફેટ આયનનો વીજભાર -3 છે. જ્યારે ક્લોરાઇડ આયનનો વીજભાર −1 છે. આમ, ફૉસ્ફેટનો વિદ્યુતભાર વધારે હોવાથી તેની સ્કંદનશક્તિ ક્લોરાઇડની સરખામણીમાં ઊંચી હોય છે.
![]()
પ્રશ્ન 18.
ભેજયુક્ત ફટકડી ઘસવાથી રક્તસ્રાવ શા માટે અટકી જાય છે ?
ઉત્તર:
લોહી આલ્બુમિનોઇડ પદાર્થનું કલિલમય દ્રાવણ છે. ફટકડી અને ફેરિક ક્લોરાઇડનો લોહીના સ્રાવને રોકવાની ક્રિયા લોહીના સ્પંદનના કારણે છે. જેથી લોહીનો ગઠ્ઠો રચાય છે અને તે લોહીને વધુ વહેતું રોકે છે.
પ્રશ્ન 19.
ગરમ પાણીમાં FeCl3 ઉમેરીને બનાવાયેલ Fe(OH)3 નો કલિલ શા માટે ધનવીજભારિત થાય છે ?
ઉત્તર:
કલિલ પરનો વિદ્યુતભાર એ કલિલમય માધ્યમમાં અધિશોષણ પામતાં આયન ઉપર આધારિત હોય છે. જ્યારે જલીય ફેરિક ઑક્સાઇડનું ઘનભારિત સોલ બને છે. ત્યારે તેમાં ધનભારિત Fe+3 આયનનું અધિશોષણ થાય છે. આમ, જ્યારે ગરમ પાણીમાં FeCl3 ઉમેરીને Fe(OH)3 નું કલિલ બનાવવામાં આવે તો તે કલિલ ધનભારયુક્ત બને છે.
પ્રશ્ન 20.
તાપમાન વધવાથી ભૌતિક અધિશોષણ અને રાસાયણિક અધિશોષણ શા માટે ભિન્ન વર્તણૂક દર્શાવે છે ?
ઉત્તર:
તાપમાનમાં વધારા સાથે ભૌતિક અધિશોષણ તેમજ રાસાયણિક અધિશોષણમાં જોવા મળતી ભિન્નતા તેમાં રહેલા કણોને જોડતા બળના સંદર્ભમાં સમજી શકાય છે. ભૌતિક અધિશોષણમાં નિર્બળ વાન્-ડર-વાલ્સ બળો આવેલા હોય છે. તાપમાન વધારતાં આ બળો વધારે નિર્બળ બને છે. જ્યારે રાસાયણિક અધિશોષણમાં રાસાયણિક બંધ આવેલા હોય છે. જેને ઊંચી સક્રિયકરણ ઊર્જાની જરૂર પડે છે. તેના માટે તાપમાનનો વધારો ફાયદાકારક હોય છે.
પ્રશ્ન 21.
જો ડાયાલિસીસ (પારશ્લેષણ) લાંબો સમય ચાલે તો શું થાય ?
ઉત્તર:
પારશ્લેષણ અથવા ડાયાલીસીસ લાંબા સમય સુધી કરવાથી કલિલમાંથી વિદ્યુતવિભાજ્ય કે જે કલિલને સ્થાયી રાખે છે તે દૂર થાય છે અને કલિલ અસ્થાયી બનતા તેનું સ્પંદન થાય છે.
પ્રશ્ન 22.
ઇઓસિન રંજકની હાજરીમાં સફેદ રંગના સિલ્વર હેલાઇડના અવક્ષેપ રંગીન શા માટે થાય છે ?
ઉત્તર:
સફેદ રંગના સિલ્વર હેલાઇડના અવક્ષેપને ઇઓસિનમાં નાખતાં ઇઓસિનનું સિલ્વર હેલાઇડની સપાટી પર અધિશોષણ થતાં તે રંગીન બને છે.
પ્રશ્ન 23.
કોલસાની ખાણોમાં ઉપયોગમાં લેવામાં આવતાં ગેસમાસ્કમાં સક્રિયકૃત ચારકોલની ભૂમિકા શું છે ?
ઉત્તર:
ગૅસમાસ્ક એ એક એવું ઉપકરણ છે કે જે સક્રિયકૃત ચારકોલનું બનેલું છે. તેનો સામાન્ય રીતે ઉપયોગ કોલસાની ખાણમાંથી નીકળતા ઝેરી વાયુઓને અધિશોષી લેવા માટે થાય છે, જેથી શ્વાસોચ્છ્વાસ માટે શુદ્ધ વાયુ મળી રહે.
પ્રશ્ન 24.
નદીના પાણી અને દરિયાના સંગમસ્થાન પર ડેલ્ટા કેવી રીતે બને છે ?
ઉત્તર:
નદીનું પાણી માટીનું કલિલમય દ્રાવણ છે. દરિયાનું પાણી સંખ્યાબંધ વિદ્યુતવિભાજ્ય ધરાવે છે. જ્યારે નદીનું પાણી દરિયાના પાણીને મળે છે ત્યારે દરિયાના પાણીમાં રહેલા વિદ્યુતવિભાજ્યો માટીના કલિલમય દ્રાવણનું સ્પંદન કરે છે. જેના પરિણામે નદીના પાણી અને દરિયાના સંગમસ્થાન પર ડેલ્ટા બને છે.
પ્રશ્ન 25.
એક એવું ઉદાહરણ આપો કે જેમાં તાપમાનના વધારા સાથે ભૌતિક અધિશોષણ રાસાયણિક અધિશોષણમાં રૂપાંતરિત થાય છે. આ પરિવર્તનનું કારણ આપો.
ઉત્તર:
ડાયહાઇડ્રોજન પ્રથમ નિકલ પર વાન્-ડર-વાલ્સ બળોથી અધિશોષિત થાય છે. ડાયહાઇડ્રોજનના અણુઓ પછી હાઇડ્રોજન પરમાણુમાં વિયોજિત થાય છે. જે સપાટી પર રાસાયણિક અધિશોષણ દ્વારા અધિશોષિત થાય છે.
![]()
પ્રશ્ન 26.
કોઈ પદાર્થ માટે એક સારા ઉદ્દીપકના સ્વરૂપમાં કાર્ય કરવા માટે અપશોષણ શા માટે મહત્ત્વનું હોય છે ?
ઉત્તર:
અપશોષણ ગુણધર્મ એ પદાર્થની સારા ઉદ્દીપક તરીકેની લાક્ષણિકતામાં ખૂબ જ મહત્ત્વનો છે. પ્રક્રિયા થયા પછી પદાર્થની સપાટી પર બનેલ નીપજ પદાર્થની સપાટી છોડે આ ક્રિયાને અપશોષણ કહે છે. અપશોષણ થયા પછી જ પ્રક્રિયકના બીજા અણુઓ ઉદ્દીપકની સપાટી પર જોડાઈ નીપજ આપી શકે છે. આમ, પદાર્થની સારા ઉદ્દીપક તરીકેની લાક્ષણિકતામાં અપશોષણ ગુણધર્મ મહત્ત્વનો છે.
પ્રશ્ન 27.
વિષમાંગ ઉદ્દીપનમાં પ્રસરણ (diffusion)ની ભૂમિકા શું છે ?
ઉત્તર:
વિષમાંગ ઉદ્દીપનમાં ઉદ્દીપકની સપાટી પર અધિશોષણ પામ્યા પછી વાયુઓનું પ્રસરણ થાય છે અને ત્યારબાદ નીપજ બન્યા પછી આ વાયુઓ ઉદ્દીપકની સપાટી પરથી પ્રસરણ પામી પ્રક્રિયકના નવા આવનારા અણુઓ માટે સંપર્કસપાટી ખાલી કરે છે જેથી, પ્રક્રિયા આગળ વધી શકે.
પ્રશ્ન 28.
ઘન ઉદ્દીપક વાયુમય અણુઓની જોડવાની પ્રક્રિયાના દરને કઈ રીતે વધારે છે ?
ઉત્તર:
જ્યારે વાયુમય અણુઓ ઘન ઉદ્દીપકની સપાટીના સંપર્કમાં આવે છે ત્યારે તેમની વચ્ચે નિર્બળ રાસાયણિક બંધ બને છે. આથી પ્રક્રિયકના અણુઓની સાંદ્રતામાં ઉદ્દીપકની સપાટી પર વધારો થાય છે.
આમ, તબક્કાવાર પ્રક્રિયકના અણુઓ ઉદ્દીપકની સપાટી પર શોષાય છે તથા નીપજના અણુઓ સપાટી પરથી દૂર થાય છે. વળી અધિશોષણ એ ઉષ્માક્ષેપક પ્રક્રિયા હોવાથી પ્રક્રિયાનો વેગ વધારે છે.
પ્રશ્ન 29.
તાવના સમયે શરીરના પાચન જેવાં જૈવકાર્યો પ્રભાવિત થાય છે ? આપનો જવાબ સ્પષ્ટ કરો.
ઉત્તર:
ઉત્સેચકીય સક્રિયતા માટે અનુકૂળ તાપમાન 298 થી 310 K છે. ઉત્સેચકો આ માત્રાથી વધુ કે ઓછી પરિસ્થિતિમાં સક્રિય રહી શકતા નથી. તાવ આવતા માનવશરીરનું તાપમાન 310 K કરતાં વધી જાય છે. આથી, ઉત્સેચકીય પ્રક્રિયાઓમાં ખલેલ પડે છે અને ઉત્સેચકની સક્રિયતા ઘટે છે.
જોડકાં પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
કોલમ – Iમાં દ્રાવણ બનાવવાની પદ્ધતિઓલ આપી છે. આ માહિતીને કૉલમ – II માં આપેલાં દ્રાવણોના પ્રકાર સાથે જોડો.
| કોલમ – I | કૉલમ – II |
| (A) ઠંડા પાણીમાંથી સલ્ફરની બાષ્પને પસાર કરવામાં આવે છે. | (1) સામાન્ય વિદ્યુત-વિભાજ્ય દ્રાવણ |
| (B) ક્રાંતિક મિસેલના સાંદ્રતાથી ઉપર સાબુને પાણીમાં મિશ્ર કરવામાં આવે છે. | (2) આણ્વીય કલિલ |
| (C) પાણી સાથે ઈંડાની સફેદીને ફીણવામાં આવે છે. | (3) સંગુણિત કલિલ |
| (D) ક્રાંતિક મિસેલ સાંદ્રતાથી નીચે સાબુને પાણીમાં મિશ્ર કરવામાં આવે છે. | (4) વિરાટ આણ્વીય કલિલ |
ઉત્તર:
| કોલમ – I | કૉલમ – II |
| (A) ઠંડા પાણીમાંથી સલ્ફરની બાષ્પને પસાર કરવામાં આવે છે. | (2) આણ્વીય કલિલ |
| (B) ક્રાંતિક મિસેલના સાંદ્રતાથી ઉપર સાબુને પાણીમાં મિશ્ર કરવામાં આવે છે. | (3) સંગુણિત કલિલ |
| (C) પાણી સાથે ઈંડાની સફેદીને ફીણવામાં આવે છે. | (4) વિરાટ આણ્વીય કલિલ |
| (D) ક્રાંતિક મિસેલ સાંદ્રતાથી નીચે સાબુને પાણીમાં મિશ્ર કરવામાં આવે છે. | (1) સામાન્ય વિદ્યુત-વિભાજ્ય દ્રાવણ |
![]()
પ્રશ્ન 2.
કોલમ – I માં આપેલાં વિધાનોને કૉલમ – II માં આપેલી પરિઘટના સાથે જોડો :
| કોલમ – I | કૉલમ – II |
| (A) વિક્ષેપન માધ્યમ વિધુતીય ક્ષેત્રમાં ગતિ કરે છે. | (1) (પરાસરણ) અભિસરણ |
| (B) દ્રાવકના અણુઓ અર્ધપારગમ્ય પડદામાંથી પસાર થઈ દ્રાવણ બાજુ જાય છે. | (2) વિદ્યુતકણ સંચાલન |
| (C) વીજભારિત કલિલ કણો વિધુતીય ક્ષેત્રની અસર હેઠળ વિરુદ્ધ વીજભાર ધરાવતાં વિધુતધ્રુવો તરફ ખસે છે. | (3) વિદ્યુત અભિસરણ (પરાસરણ) |
| (D) દ્રાવક અણુઓ અર્ધપારગમ્ય પડદામાંથી પસાર થઈ દ્રાવક બાજુ જાય છે. | (4) પ્રતિઅભિસરણ (પ્રતિપરાસરણ) |
ઉત્તર:
| કોલમ – I | કૉલમ – II |
| (A) વિક્ષેપન માધ્યમ વિધુતીય ક્ષેત્રમાં ગતિ કરે છે. | (3) વિદ્યુત અભિસરણ (પરાસરણ) |
| (B) દ્રાવકના અણુઓ અર્ધપારગમ્ય પડદામાંથી પસાર થઈ દ્રાવણ બાજુ જાય છે. | (4) પ્રતિઅભિસરણ (પ્રતિપરાસરણ) |
| (C) વીજભારિત કલિલ કણો વિધુતીય ક્ષેત્રની અસર હેઠળ વિરુદ્ધ વીજભાર ધરાવતાં વિધુતધ્રુવો તરફ ખસે છે. | (2) વિદ્યુતકણ સંચાલન |
| (D) દ્રાવક અણુઓ અર્ધપારગમ્ય પડદામાંથી પસાર થઈ દ્રાવક બાજુ જાય છે. | (1) (પરાસરણ) અભિસરણ |
પ્રશ્ન 3.
કોલમ – I માં અને કોલમ – II માં આપેલી માહિતીને જોડો :
| કોલમ – I | કૉલમ – II |
| (A) રક્ષિત કલિલ | (1) FeCl3 + NaOH |
| (B) પ્રવાહી-પ્રવાહી કલિલ | (2) દ્રવઅનુરાગી કલિલ |
| (C) ધનવીજભારિત કલિલ | (3) પાયસ |
| (D) ઋણવીજભારિત કલિલ | (4) FeCl3 + ગરમ પાણી |
ઉત્તર:
| કોલમ – I | કૉલમ – II |
| (A) રક્ષિત કલિલ | (2) દ્રવઅનુરાગી કલિલ |
| (B) પ્રવાહી-પ્રવાહી કલિલ | (3) પાયસ |
| (C) ધનવીજભારિત કલિલ | (4) FeCl3 + ગરમ પાણી |
| (D) ઋણવીજભારિત કલિલ | (1) FeCl3 + NaOH |
સવિસ્તર પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
વિષમાંગ ઉદ્દીપનમાં અધિશોષણની ભૂમિકા શી છે ?
ઉત્તર:
ઉદ્દીપક પ્રક્રિયામાં પ્રક્રિયાનો વેગ વધારવા વપરાય છે. વિષમાંગ ઉદ્દીપક પણ પ્રક્રિયાનો વેગ વધારે છે. વિષમાંગ ઉદ્દીપનમાં ઉદ્દીપક એ પ્રક્રિયકો અને નીપજો કરતાં જુદી ભૌતિક અવસ્થામાં હોય છે. વિષમાંગ ઉદ્દીપનમાં અધિશોષણનો ઉપયોગ નીચે મુજબ છે :
(i) પ્રક્રિયકોનું ઉદ્દીપકની સપાટી તરફ પ્રસરણ
(ii) ઉદ્દીપકની સપાટી પર પ્રક્રિયક અણુઓનું અધિશોષણ
(iii) મધ્યવર્તી સંયોજનના નિર્માણ દ્વારા ઉદ્દીપકની સપાટી પર રાસાયણિક પ્રક્રિયાનું થવું.
(iv) અપશોષણ
(v) પ્રક્રિયા નીપજનું ઉદ્દીપકની સપાટીથી દૂર પ્રસરણ થવું.
પ્રશ્ન 2.
રાસાયણિક પૃથક્કરણમાં અધિશોષણની ઉપયોગિતા શી છે ?
ઉત્તર:
રાસાયણિક વિશ્લેષણમાં અધિશોષણ ઘટના નીચે પ્રમાણેની છે :
(i) ક્રોમેટોગ્રાફિક વિશ્લેષણ : અધિશોષણ પરિઘટના પર આધારિત ક્રોમેટોગ્રાફિક વૈશ્લેષિક અને ઔદ્યોગિક ક્ષેત્રોમાં ઘણા અનુપ્રયોગો ધરાવે છે.
(ii) અધિશોષણ સૂચકો : કેટલાય અવક્ષેપ જેમ કે સિલ્વર હેલાઇડની સપાટીને ઇઓસીન, ફ્લોરેસીન વગેરે કેટલાય રંગકોને અધિશોષિત કરવાનો ગુણધર્મ હોય છે અને તેને કારણે અંતિમબિંદુએ લાક્ષણિક રંગ પેદા કરે છે.
(iii) ફીણ પ્લવન પદ્ધતિ : નિમ્ન કક્ષાની સલ્ફાઇડ અયસ્ક (કાચી ધાતુ)ને સિલિકાથી અને અન્ય કૃતિકામય દ્રવ્યથી અલગ કરીને આ પદ્ધતિથી સંકેન્દ્રિત કરવામાં આવે છે. આમાં પાઇન ઑઇલ અને ફીણ ઉત્પન્નકારક પ્રક્રિયકને વાપરવામાં આવે છે.
(iv) નિષ્ક્રિય વાયુઓનું અલગીકરણ : ચારકોલ વડે વાયુઓના અધિશોષણમાંના તફાવતના ફેરફારને કારણે ઉમદા વાયુઓના મિશ્રણને જુદાજુદા તાપમાને નાળિયેર-ચારકોલ પર અધિશોષણ દ્વારા અલગ કરી શકાય છે.
![]()
પ્રશ્ન 3.
સલ્ફાઇડ ખનીજના સંકેન્દ્રણ માટે વિશેષ રૂપમાં ઉપયોગમાં લેવામાં આવતી ફીણ પ્લવન પદ્ધતિમાં અધિશોષણની ભૂમિકા શી છે ?
ઉત્તર:
ફીણ પ્લવન પદ્ધતિમાં સલ્ફાઇડની કાચી ધાતુને પાઇન ઑઇલ અને પાણીમાં મિશ્ર કરવામાં આવે છે. સલ્ફાઇડ ધાતુના ટુકડા ફીણ ઉપર અધિશોષિત થઈ પાત્રમાં ઉપર તરે છે. જ્યારે અશુદ્ધિઓ પાત્રના તળિયે જમા થાય છે માટે અધિશોષણનું મહત્ત્વ ફીણ પ્લવન પદ્ધતિમાં નીચે મુજબ સમજી શકાય.
(i) સલ્ફાઇડ ખનીજ ઉપર પાઇન ઑઈલનું અધિશોષણ થવું.
(ii) પાયસ (ઇમલ્શન) બનવાની શરૂઆત થવી.
(iii) ખનીજકણો સાથે ફીણનું બનવું.
(iv) આકાર વરણાત્મક ઉદ્દીપન વડે આગળની પ્રક્રિયા થવી. સલ્ફાઇડ ખનીજના સંકેન્દ્રણ માટે જ આ પદ્ધતિનો ઉપયોગ અધિશોષણ ગુણધર્મના કારણે જ થાય છે.
પ્રશ્ન 4.
તમે આકાર વરણાત્મક ઉદ્દીપન દ્વારા શું સમજો છો ? ઝીઓલાઈટ સારો પ્રકારના આકાર વરણાત્મક ઉદ્દીપક શા માટે છે ?
ઉત્તર:
ઉદ્દીપકીય પ્રક્રિયાઓ જે ઉદ્દીપકની છિદ્ર રચના, પ્રક્રિયક અને નીપજ અણુઓના કદ પર આધાર રાખે છે તેને આકાર વરણાત્મક ઉદ્દીપન કહે છે. ઝિયોલાઇટ સારો આકાર વરણાત્મક ઉદ્દીપક છે કારણ કે તેમની રચના મધપૂડા જેવી હોય છે.
ઍલ્યુમિનોસિલિકેટના સૂક્ષ્મછિદ્રો જેમને ત્રિ-પરિમાણીય જાળીદાર રચના હોવાથી કેટલાક સિલિકોન પરમાણુ ઍલ્યુમિનિયમ પરમાણુ વડે વિસ્થાપિત થાય છે અને AI – O – Si માળખું આપે છે. ઝિયોલાઇટમાં ભાગ લેતી પ્રક્રિયાઓ પ્રક્રિયક અને નીપજ અણુઓ તથા ઝિયોલાઇટ છિદ્રો અને પોલાણ પર આધાર રાખે છે. તે કુદરતમાં મળી આવે છે. તેમજ ઉદ્દીપકીય વરણાત્મક માટે સાંશ્લેષિત સ્વરૂપ પણ મળે છે.
ઝિયોલાઇટ વિશાળ પાયા પર ઉદ્દીપક તરીકે ઉપયોગ પેટ્રોરસાયણ ઉદ્યોગમાં હાઇડ્રોકાર્બનના વિભંજન અને સમઘટીકરણ માટે થાય છે. પેટ્રોરસાયણ ઉદ્યોગમાં વપરાતો અગત્યનો ઝિયોલાઇટ ઉદ્દીપક ZSM-5 છે. તે આલ્કોહૉલનું સીધું જ ગૅસોલીન (પેટ્રોલ)માં તેમનું નિર્જલીકરણ કરીને હાઇડ્રોકાર્બન સંયોજનોનું મિશ્રણ આપે છે.