Gujarat Board GSEB Textbook Solutions Class 12 Chemistry Chapter 7 p-વિભાગનાં તત્ત્વો Textbook Questions and Answers.
Gujarat Board Textbook Solutions Class 12 Chemistry Chapter 7 p-વિભાગનાં તત્ત્વો
GSEB Class 12 Chemistry p-વિભાગનાં તત્ત્વો Text Book Questions and Answers
પ્રશ્ન 1.
સમૂહ 15ના તત્ત્વોની સામાન્ય લાક્ષણિકતાઓને તેમની ઇલેક્ટ્રૉનીય રચના, ઑક્સિડેશન અવસ્થા, પરમાણ્વીય કદ, આયનીકરણ એન્થાલ્પી અને વિદ્યુતઋણતાના સંદર્ભમાં ચર્ચો.
ઉત્તર:
સમૂહ 15ના તત્ત્વોની સામાન્ય લાક્ષણિકતાઓ :
ઇલેક્ટ્રૉનીય રચના : સમૂહ 15ના દરેક તત્ત્વોની બાહ્યતમ કક્ષામાં s ઇલેક્ટ્રૉન હોય છે. આથી, તેમની સામાન્ય ઇલેક્ટ્રૉનીય રચના ns2np5 હોય છે.
ઑક્સિડેશન અવસ્થા : સમૂહ 16ના તત્ત્વોની બાહ્યતમ કક્ષામાં પાંચ ઇલેક્ટ્રૉન હોવાથી તેઓને અષ્ટક રચના પૂર્ણ કરવા 3 ઇલેક્ટ્રૉનની જરૂર પડે છે. નાઇટ્રોજન તત્ત્વ કદમાં નાનું હોવાથી તથા તેના પરમાણુકેન્દ્ર અને બાહ્યતમ કક્ષા વચ્ચેનું અંતર ઓછું હોવાથી તે ત્રણ ઇલેક્ટ્રૉન મેળવીને અષ્ટક રચના પૂર્ણ કરી શકે છે. આથી, નાઇટ્રોજન સિવાયના સમૂહ 15ના તત્ત્વો -3 ઑક્સિડેશન અવસ્થા ધરાવે છે. નાઇટ્રોજન અને ફૉસ્ફરસ -3 ઉપરાંત -1 અને -2 ઑક્સિડેશન અવસ્થા પણ ધરાવે છે. આ સમૂહના દરેક તત્ત્વો +3 અને +5 ઑક્સિડેશન અવસ્થા ધરાવે છે. જોકે સમૂહમાં ઉપરથી નીચે તરફ જતાં +5 ઑક્સિડેશન અવસ્થાની સ્થાયિતા ઘટતી જાય છે, જ્યારે +3 ઑક્સિડેશન અવસ્થાની સ્થાયિતા વધતી જાય છે. આ નિષ્ક્રિયયુગ્મ અસરને લીધે ઉદ્ભવે છે.
આયનીકરણ ઍન્થાલ્પી અને વિદ્યુતઋણતા : સમૂહમાં ઉપરથી નીચેની તરફ જતાં આયનીકરણ ઍન્થાલ્પી ઘટતી જાય છે, કારણ કે સમૂહમાં ઉપરથી નીચેની તરફ જતાં પરમાણ્વીય કદમાં વધારો થાય છે. સમૂહમાં ઉપરથી નીચેની તરફ જતાં વિદ્યુત- ઋણતા પણ ઘટતી જાય છે, કારણ કે પરમાણ્વીય કદ વધે છે.
પરમાણુ કદ : સમૂહમાં ઉપ૨થી નીચેની તરફ જતાં પરમાણુકદ વધે છે. કોશની સંખ્યા વધવાના કારણે પરમાણ્વીય કદમાં વધારો થાય છે.
પ્રશ્ન 2.
નાઇટ્રોજનની પ્રતિક્રિયાત્મકતા શા માટે ફોસ્ફરસથી જુદી પડે છે ?
ઉત્તર:
નાઇટ્રોજન એ રાસાયણિક રીતે ઓછો ક્રિયાશીલ છે, કારણ કે N2 અણુની સ્થાયિતા વધારે હોય છે. N2 અણુમાં બે નાઇટ્રોજન પરમાણુ ત્રિ-બંધ બનાવે છે. ત્રિ-બંધની બંધક્ષમતા ખૂબ જ ઊંચી હોય છે, જેને તોડવી ખૂબ જ મુશ્કેલ છે. કારણ કે નાઇટ્રોજનનું કદ નાનું હોવાથી તે pπ – pπ બંધ રચે છે. ફૉસ્ફરસ આ ગુણધર્મ દર્શાવી શકતો નથી. આથી, ફૉસ્ફરસ એ નાઇટ્રોજન કરતાં વધારે ક્રિયાશીલ છે.
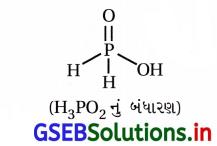
![]()
પ્રશ્ન 3.
સમૂહ 15ના તત્ત્વોની રાસાયણિક પ્રતિક્રિયાત્મકતાના વલણોની ચર્ચા કરો.
ઉત્તર:
- હાઇડ્રોજન પ્રત્યે પ્રતિક્રિયાત્મકતા : સમૂહ 15ના બધાં તત્ત્વો EH3 પ્રકારના હાઇડ્રાઇડ સંયોજનો બનાવે છે, જ્યાં E = N, P, As, Sb અથવા Bi. આ હાઇડ્રાઇડ સંયોજનો તેમના ગુણધર્મોમાં નિયમિત ક્રમણ દર્શાવે છે.
- સમૂહમાં NH3 થી BiH‚ તરફ જતાં હાઇડ્રાઇડ સંયોજનોની સ્થાયિતા ઘટે છે પણ NH3 થી BiH3 તરફ જતાં રિડક્શનકર્તા તરીકેનો ગુણધર્મ વધે. બધાં હાઇડ્રાઇડ સંયોજનો પૈકી એમોનિયા એકમાત્ર મંદ રિડક્શનકર્તા છે જ્યારે BiH3 સૌથી વધુ પ્રબળ રિડક્શનકર્તા છે.

- નાઇટ્રોજનની ઊંચી વિદ્યુતઋણતા અને નાના કદના કારણે NH3 ઘન તેમજ પ્રવાહી અવસ્થામાં હાઇડ્રોજન બંધ બનાવે છે, આ કારણે NH3નું ગલનબિંદુ અને ઉત્કલનબિંદુ PH3 કરતાં ઊંચું હોય છે.
- સમૂહ 15 ના તત્ત્વોના હાઇડ્રાઇડ સંયોજનોના ગુણધર્મો કોષ્ટક મુજબ દર્શાવેલ છે.
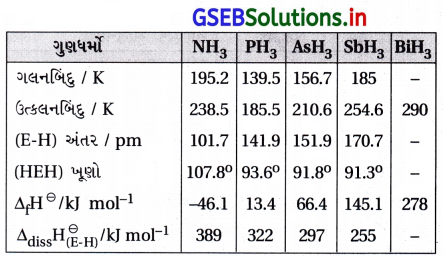
- ઑક્સિજન પ્રત્યે પ્રતિક્રિયાત્મકતા : આ બધાં તત્ત્વો બે પ્રકારના ઑક્સાઇડ સંયોજનો E2O3 અને E2O5 બનાવે છે.
- તત્ત્વની ઊંચી ઑક્સિડેશન અવસ્થાવાળાના ઑક્સાઇડ, નીચી ઑક્સિડેશન અવસ્થાવાળા ઑક્સાઇડ કરતાં વધારે ઍસિડિક હોય છે.

- એક જ સમૂહમાંના ઑક્સાઇડનો નીચે જતાં બેઝિક ગુણ વધે અને ઍસિડિક ગુણ ઘટે છે. દા.ત., E2O3 પ્રકારના ઑક્સાઇડ નાઇટ્રોજન, ફૉસ્ફરસ : ઍસિડિક
આર્સેનિક, એન્ટિમની : ઊભયધર્મી અને બિસ્મથ : બેઝિક - હેલોજન સંયોજનો પ્રત્યે પ્રતિક્રિયાત્મકતા : આ તત્ત્વો હેલાઇડ સંયોજનોની બે શ્રેણીઓ EX3 અને EX5 બનાવવા માટે પ્રક્રિયા કરે છે.
- N માં d-કક્ષકોની હાજરી નથી જેથી તે પેન્ટાહેલાઇડ EX5 બનાવતો નથી.
- ટ્રાયહેલાઇડના કરતાં પેન્ટાહેલાઇડ વધારે સહસંયોજક છે. આમ, થવાનું કારણ પેન્ટાહેલાઇડ સંયોજનોમાં +5 ઑક્સિડેશન અવસ્થા હોય છે, જ્યારે ટ્રાયહેલાઇડ સંયોજનોમાં +3 ઑક્સિડેશન અવસ્થા હોય છે. જોકે +3 ઑક્સિડેશન અવસ્થા ધરાવતા તત્ત્વો કરતાં +5 ઑક્સિડેશન અવસ્થા ધરાવતા તત્ત્વોની ધ્રુવણક્ષમતા વધારે હોય છે. તેથી પેન્ટાહેલાઇડ સંયોજનોમાં સહસંયોજક લક્ષણ વધુ હોય છે.
- N તત્ત્વ સિવાયનાં બધાં જ તત્ત્વોના ટ્રાયહેલાઇડ સંયોજનો સ્થાયી છે, જોકે Nનો એક ટ્રાયહેલાઇડ NF3 સ્થાયી છે.
- BiF3 સિવાય બધા જ ટ્રાયહેલાઇડ સંયોજનો સહસંયોજક છે.
- ધાતુતત્ત્વો સાથેની પ્રક્રિયાની ચર્ચા 15 મા સમૂહનાં તત્ત્વો, ધાતુતત્ત્વોની સાથે નીચેનાં સંયોજનો બનાવે છે :
| તત્ત્વ | સંયોજન | નામ |
| N | Ca3N2 | કૅલ્શિયમ નાઇટ્રાઇડ |
| P | Ca3P2 | કૅલ્શિયમ ફૉસ્ફાઇડ |
| As | Na3As | સોડિયમ આર્સેનાઇડ |
| Sb | Zn3Sb2 | ઝિંક ઍન્ટિમોનાઇડ |
| Bi | Mg3Bi2 | મૅગ્નેશિયમ બિસ્મુથાઇડ |
આ બધામાં N, P As, Sb અને Bi ની ઑક્સિડેશન અવસ્થા (-૩) છે.
પ્રશ્ન 4.
NH3 હાઇડ્રોજન બંધ બનાવે છે, પરંતુ PH3 હાઇડ્રોજનબંધ બનાવતો નથી. ચર્ચા કરો.
ઉત્તર:
હાઇડ્રોજન બંધ હંમેશાં ઊંચાં વિદ્યુતઋણ પરમાણુ અને હાઇડ્રોજન પરમાણુની વચ્ચે બને છે. સમૂહમાં ઉપરથી નીચેની તરફ જતાં વિદ્યુતઋણતા ઘટવાના કારણે નાઇટ્રોજન એ ફૉસ્ફરસ કરતાં વધુ વિદ્યુતઋણ છે. આથી, PH3માં હાઇડ્રોજન બંધ બનવાની ક્ષમતા એ NH3 કરતાં ખૂબ જ ઓછી હોય છે.
પ્રશ્ન 5.
પ્રયોગશાળામાં નાઇટ્રોજન કેવી તે બનાવાય છે ? તેમાં સમાયેલી પ્રક્રિયાના રાસાયણિક સમીકરણો લખો.
ઉત્તર:
ડાયનાઇટ્રોજન વાયુ બનાવવાની મુખ્ય ત્રણ રીતો છે જે નીચે મુજબ છે :
વ્યાપારી ધોરણે N2 :
- હવાના પ્રવાહીકરણ અને પછી વિભાગીય નિસ્યંદન કરીને ડાયનાઇટ્રોજન વાયુ બનાવાય છે.

- પ્રવાહી ઑક્સિજનનું ઉત્કલનબિંદુ વધારે (90 K) હોવાથી તે પાત્રમાં રહી જાય છે.
પ્રયોગશાળામાં ડાયનાઇટ્રોજન વાયુ બનાવવાની રીત :

- આ પ્રક્રિયા થાય ત્યારે થોડા પ્રમાણમાં બનતી અશુદ્ધિઓ NO અને HNO3 ને પોટૅશિયમ ડાયક્રોમેટ (K2Cr2O7) ધરાવતા જલીય સલ્ફ્યુરિક ઍસિડમાંથી પસાર કરીને દૂર કરવામાં આવે છે.
- એમોનિયમ ડાયક્રોમેટ (NH4)2Cr2O7 નું ઉષ્મીય વિઘટન કરીને પણ ડાયનાઇટ્રોજન વાયુ બનાવી શકાય છે.

અતિશુદ્ધ ડાયનાઇટ્રોજન : સોડિયમ અથવા બેરિયમ એઝાઇડના ઉષ્મીય વિઘટનથી અતિશુદ્ધ ડાયનાઇટ્રોજન મળે છે.

ઉપયોગો :
(i) એમોનિયા અને નાઇટ્રોજન ધરાવતા અન્ય ઔદ્યોગિક રસાયણોના ઉત્પાદનમાં થાય છે. દા.ત., કૅલ્શિયમ સાયનેમાઇડ.
(ii) જ્યાં નિષ્ક્રિય વાતાવરણની જરૂરિયાત હોય ત્યાં તેનો ઉપયોગ થાય છે.
(iii) પ્રવાહી ડાયનાઇટ્રોજનનો ઉપયોગ પ્રશીતક તરીકે જૈવિક પદાર્થો અને ખાદ્યપદાર્થોની જાળવણી માટે તથા ક્રાયોસર્જરીમાં થાય છે.
(iv) હવામાંનો નિષ્ક્રિય નાઇટ્રોજન, ડાયઑક્સિજનની ક્રિયાશીલતા ઘટાડે છે, જેથી તે શ્વાસોચ્છ્વાસમાં ઉપયોગી બને છે.
(v) વિદ્યુતગોળામાં, નાઇટ્રિક ઍસિડની બનાવટમાં અને ક્રાયોસર્જરીમાં થાય છે.
પેટાપ્રશ્ન : ડાયનાઇટ્રોજન વાયુના ભૌતિક તેમજ રાસાયણિક ગુણધર્મો લખો.
ઉત્તર:
ભૌતિક ગુણધર્મો :
- ડાયનાઇટ્રોજન રંગવિહીન, વાસવિહીન, સ્વાદવિહીન અને બિનઝેરી વાયુ છે.
- તેનાં પરમાણુ બે સ્થાયી સમઘટકો : 14N અને 15N ધરાવે છે.
- તે પાણીમાં ઘણી ઓછી દ્રાવ્યતા (273K તાપમાને અને 1 બાર દબાણે 23.2 cm3 પ્રતિ લિટર પાણી) અને નીચા ઠારબિંદુ અને ઉત્કલનબિંદુ ધરાવે છે.
- N = N બંધની ઊંચી બંધન ઍન્થાલ્પીના કારણે ડાયનાઇટ્રોજન ઓરડાના તાપમાને વધુ નિષ્ક્રિય હોય છે. તાપમાનમાં વધારો કરતા પ્રતિક્રિયાત્મકતામાં ઝડપી વધારો થાય છે.
રાસાયણિક ગુણધર્મો : નાઇટ્રોજન વાયુ કેટલીક ધાતુઓ સાથે જોડાઈને મુખ્યત્વે આયનીય નાઇટ્રાઇડ સંયોજનો અને અધાતુઓ સાથે જોડાઈને સહસંયોજક નાઇટ્રાઇડ સંયોજનો આપે છે.

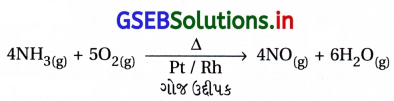
હેબર પ્રક્રમ : ડાયનાઇટ્રોજન વાયુની આશરે 773 K તાપમાને, 200 બાર દબાણે FeO ઉદ્દીપકની હાજરીમાં હાઇડ્રોજન સાથે પ્રક્રિયા કરીને એમોનિયા બનાવે છે.
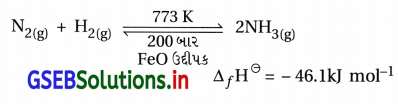
ડાયઑક્સિજન સાથે પ્રક્રિયા : ડાયનાઇટ્રોજન માત્ર ઊંચા તાપમાને (આશરે 2000 K) ડાયઑક્સિજન સાથે સંયોજાઈને નાઇટ્રિક ઑક્સાઇડ, NO બનાવે છે.

![]()
પ્રશ્ન 6.
ઔધોગિક રીતે એમોનિયાનું ઉત્પાદન કેવી રીતે થાય છે ?
ઉત્તર:
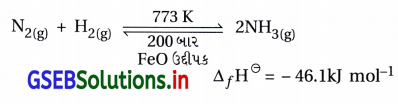
- ઔદ્યોગિક રીતે એમોનિયાનું ઉત્પાદન હેબર પ્રક્રમથી થાય છે.
- હેબર પ્રક્રમ : ડાયનાઇટ્રોજન વાયુની આશરે 773 K તાપમાને, 200 બાર દબાણે, FeO ઉદ્દીપકની હાજરીમાં હાઇડ્રોજન સાથે પ્રક્રિયા કરીને એમોનિયા બનાવે છે.
પ્રશ્ન 7.
ઉદાહરણ આપીને સમજાવો કે કોપર ધાતુ HNO3 સાથે પ્રક્રિયા કરીને વિવિધ નીપજ કેવી રીતે આપે છે ?
ઉત્તર:
સાંદ્ર નાઇટ્રિક ઍસિડ (HNO3) એ પ્રબળ ઑક્સિડેશનકર્તા છે. તે ઘણી ધાતુઓના ઑક્સિડેશનમાં વપરાય છે. ઑક્સિડેશન દ્વારા મળતી નીપજ એ ઍસિડની સાંદ્રતા તાપમાન અને ઑક્સિડેશન પામતા પદાર્થ પર આધારિત છે.
3Cu + 8HNO3(મંદ) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3(સાંદ્ર) → Cu(NO3)2 + 2NO2 + 2H2O
પ્રશ્ન 8.
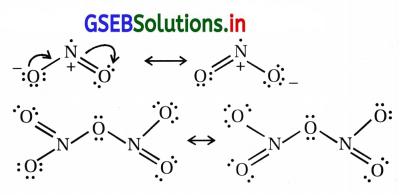
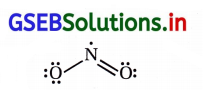
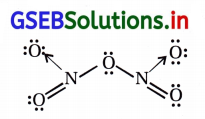
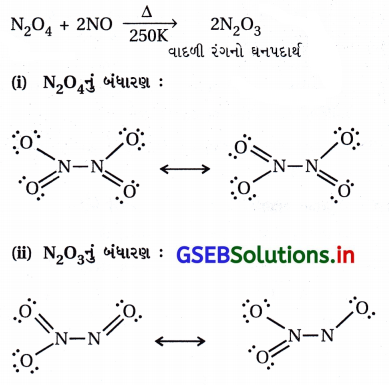
NO2 અને N2O5ના સસ્પંદન બંધારણો લખો.
ઉત્તર:
પ્રશ્ન 9.
HNH ખૂણાનું મૂલ્ય HPH, HAsH અને HSbH ખૂણાઓના મૂલ્ય કરતાં વધુ હોય છે. શા માટે ? [સંકેત : NH3 માં sp3 સંકરણના આધારે અને હાઇડ્રોજન તથા સમૂહના તત્ત્વો વચ્ચે માત્ર s-p બંધનના આધારે સમજાવી શકાય છે.]
ઉત્તર:
હાઇડ્રાઇડ NH3, PH3, AsH3 અને SbH3 માં H-M-H બંધકોણ અનુક્રમે 107°, 92°, 91° અને 90° હોય છે. બંધકોણનો આ ક્રમ મધ્યસ્થ પરમાણુની વિદ્યુતઋણતાના સંદર્ભમાં સમજાવી શકાય છે. નાઇટ્રોજનની વિદ્યુતઋણતામાં વધારો હોવાથી તેની આસપાસ ઇલેક્ટ્રૉન ઘનતા વધારે હોય છે. આથી, નાઇટ્રોજનની આસપાસ ઇલેક્ટ્રૉનની જોડ વચ્ચે અપાકર્ષણ વધારે હોવાથી તેમાં મહત્તમ બંધકોણ મળે છે. આપણે જાણીએ છીએ કે સમૂહમાં ઉપરથી નીચેની તરફ જતાં વિદ્યુતઋણતા ક્રમશઃ ઘટતી જાય છે, જેથી આ ક્રમ જોવા મળે છે.
પ્રશ્ન 10.
R3P = O અસ્તિત્વ ધરાવે છે, પરંતુ R3N = 0 શા માટે અસ્તિત્વ ધરાવતું નથી ?
(R = અલ્કાઇલ સમૂહ)
ઉત્તર:
નાઇટ્રોજનમાં d-કક્ષકની ઊણપ હોય છે, જે નાઇટ્રોજનને 4 કરતાં વધુ સવર્ણાંક ધરાવતા રોકે છે. આથી, R3N = O અસ્તિત્વ ધરાવતું નથી.
પ્રશ્ન 11.
સમજાવો કે NH3 બેઝિક છે, જ્યારે BiH3 માત્ર નિર્બળ બેઇઝ છે.
ઉત્તર:
નાઇટ્રોજનના નાના કદના કારણે અબંધકારક ઇલેક્ટ્રૉનયુગ્મ એ નાની કક્ષામાં સંગ્રહાય છે. જે દર્શાવે છે કે એકમ કદ દીઠ વીજભાર ઘનતા ઊંચી હોય છે. સમૂહમાં ઉપરથી નીચેની તરફ જતા મધ્યસ્થ પરમાણુનું કદ વધે છે અને લાંબા વિસ્તાર સુધી વીજભારના વહેંચવાથી ઇલેક્ટ્રૉનની ઘનતા ઘટે છે. આથી, સમૂહ 15ના હાઇડ્રાઇડની ઇલેક્ટ્રૉન દાન કરવાની ક્ષમતા સમૂહમાં ઉપરથી નીચે તરફ જતાં ઘટે છે.
પ્રશ્ન 12.
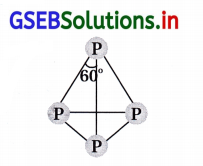
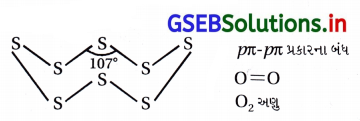
નાઇટ્રોજન દ્વિપરમાણ્વીય અણુ તરીકે અને ફોસ્ફરસ P4 તરીકે અસ્તિત્વ ધરાવે છે. શા માટે ?
ઉત્તર:
નાઇટ્રોજનનું કદ નાનું હોવાના કારણે તે pπ-pπ બંધ બનાવવાની વૃત્તિ ધરાવે છે. આથી નાઇટ્રોજન ખૂબ જ સ્થાયી અણુ N2 બનાવે છે. સમૂહમાં ઉપરથી નીચેની તરફ pπ-pπ બંધ બનવાની વૃત્તિમાં ઘટાડો થાય છે. આથી, ફૉસ્ફરસ P4 તરીકે અસ્તિત્વ ધરાવે છે.
પ્રશ્ન 13.
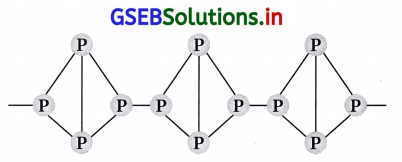
સફેદ ફોસ્ફરસ અને લાલ ફૉસ્ફરસના ગુણધર્મો વચ્ચેનો મુખ્ય તફાવત લખો.
ઉત્તર:
| સફેદ ફૉસ્ફરસ | લાલ ફૉસ્ફરસ |
| તે નરમ અને પોચો ઘન પદાર્થ છે. | તે સખત અને સ્ફટિકમય ઘન પદાર્થ છે. |
| તે ઝેરી પદાર્થ છે. | તે બિનઝેરી પદાર્થ છે. |
| તે પાણીમાં અદ્રાવ્ય છે અને CS2માં દ્રાવ્ય છે. | તે પાણી અને CS2 બન્નેમાં અદ્રાવ્ય છે. |
| તેનું હવાની હાજરીમાં સ્વયંદહન થાય છે. | તે ઓછો ક્રિયાશીલ છે. |
| તે P<sub>4</sub> અણુ તરીકે અસ્તિત્વ પામે છે. | તે P4 અણુની સાંકળ સ્વરૂપે અસ્તિત્વ પામે છે. |
 |
 |
![]()
પ્રશ્ન 14.
ફૉસ્ફરસ કરતાં નાઇટ્રોજન શા માટે ઓછો કેટેનેશન ગુણધર્મ દર્શાવે છે ?
ઉત્તર:
કૅટેનેશન ગુણધર્મ ફૉસ્ફરસમાં નાઇટ્રોજન કરતાં વધારે જોવા મળે છે, કારણ કે N–N એકબંધ એ PP એક બંધની સરખામણીમાં નિર્બળ હોય છે. નાઇટ્રોજન પરમાણુ નાનો હોવાથી બે નાઇટ્રોજન પરમાણુની ઇલેક્ટ્રૉન ઘનતા વચ્ચે અપાકર્ષણ થાય છે, જેથી N–N એકબંધ નિર્બળ બને છે.
પ્રશ્ન 15.
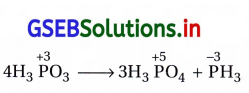
H3PO3ની વિષમીકરણ પ્રક્રિયા લખો.
ઉત્તર:
ઓર્થોફૉસ્ફરસમાં ઍસિડને ગરમ કરવાથી વિષમીકરણ પ્રક્રિયા થઈ ઓર્થોફૉસ્ફોરિક ઍસિડ અને ફોર્ફિન મળે છે. દરેક સંયોજનમાં ફૉસ્ફરસનો ઑક્સિડેશનઆંક નીચે દર્શાવ્યા મુજબ છે.
પ્રશ્ન 16.
શું PCl5 ઑક્સિડેશનકર્તા તરીકે અને રિડક્શનકર્તા તરીકે પણ વર્તી શકે છે ? વાજબીપણું જણાવો.
ઉત્તર:
PCl5 માત્ર ઑક્સિડેશનકર્તા તરીકે જ વર્તે છે. ફૉસ્ફરસની મહત્તમ ઑક્સિડેશન અવસ્થા +5 છે. PC15માં ફૉસ્ફરસ તેની મહત્તમ ઑક્સિડેશન અવસ્થા (+5) ધરાવે છે, છતાં તે તેની ઑક્સિડેશન અવસ્થા ઘટાડી શકે છે અને ઑક્સિડેશનકર્તા તરીકે વર્તે છે.
પ્રશ્ન 17.
O, S, Se, Te અને Poને તેમની ઇલેક્ટ્રોનીય રચના, ઑક્સિડેશન અવસ્થા અને હાઇડ્રાઇડ નિર્માણના સંદર્ભમાં આવર્તકોષ્ટકમાં એક જ સમૂહમાં સ્થાન આપવાનું વાજબીપણું ચર્ચો.
ઉત્તર:
- સમૂહ 16ના તત્ત્વોને ચાલ્કોજન તરીકે ઓળખવામાં આવે છે.
- ઇલેક્ટ્રૉન રચના : સમૂહ 16ના તત્ત્વોની બાહ્યતમ કક્ષામાં 6 ઇલેક્ટ્રૉન હોવાથી તેની ઇલેક્ટ્રૉન રચના ns2np4 થશે.
જ્યાં n = 2, 3, 4, 5, 6 - ઑક્સિડેશન અવસ્થા : સમૂહ 16ના તત્ત્વોની બાહ્યતમ કક્ષામાં 6 ઇલેક્ટ્રૉન હોવાથી તેઓ -2 ઑક્સિડેશન અવસ્થા ધરાવે છે. છતાં, માત્ર ઑક્સિજન જ તેની વિદ્યુતઋણતા ઊંચી હોવાના કારણે –2 ઑક્સિડેશન અવસ્થા ધરાવે છે. આ ઉપરાંત તે
- 1(H2O2), O(O2) તથા +2(OF2) ઑક્સિડેશન અવસ્થા પણ દર્શાવે છે. છતાં, −2 ઑક્સિડેશન અવસ્થાની સ્થાયિતા સમૂહમાં ઉપરથી નીચે તરફ જતાં વિદ્યુતઋણતા ઘટવાથી ઘટતી જાય છે. સમૂહમાંનો ભારે તત્ત્વ +2, +4 અને +6 ઑક્સિડેશન અવસ્થા ધરાવે છે, કારણ કે તે d-કક્ષક ધરાવે છે.
- હાઇડ્રાઇડનું નિર્માણ : આ સમૂહના તત્ત્વોના હાઇડ્રાઇડ H2E સ્વરૂપે અસ્તિત્વ પામે છે, જ્યાં E2O, Se, S, Te, Po. ઑક્સિજન અને સલ્ફર પણ H2E2 પ્રકારના હાઇડ્રાઇડ બનાવે છે. આ હાઇડ્રાઇડ સ્વભાવે અસ્થાયી હોય છે.
પ્રશ્ન 18.
ડાયઑક્સિજન વાયુ છે પરંતુ સલ્ફર ઘન છે. શા માટે ?
ઉત્તર:
ઑક્સિજન એ સલ્ફર કરતાં કદમાં નાનું હોય છે. કદ નાનું હોવાથી તે pπ-pπ બંધ રચીને O2 અણુ બનાવે છે. આ ઉપરાંત ઑક્સિજનનું આંતરઆણ્વીય બળ એ નિર્બળ વાન્ ડર વાલ્સ આકર્ષણ બળ છે, જેથી O2 વાયુ સ્વરૂપ ધરાવે છે. ઑક્સિજનના બીજા બળો નિર્બળ વાન્ ડર વાલ્સ બળો છે, જેથી O2 વાયુરૂપે છે. બીજી બાજુ સલ્ફર pπ-Pπ બંધ રચી શકતો નથી, પરંતુ તે પ્રબળ સહસંયોજક બંધ વડે વળેલું બંધારણ ધરાવે છે. આથી તે ઘન તરીકે વર્તે છે.
પ્રશ્ન 19.
0 → 0– અને 0 → 02- માટે ઇલેક્ટ્રોનપ્રાપ્તિ ઍન્થાલ્પીના મૂલ્યો અનુક્રમે −141 અને 702 Jmol-1 જાણ્યા બાદ તમે કેવી રીતે સમજાવશો કે 02- પિસીઝ ધરાવતા ઑક્સાઇડ સંયોજનો વધુ બને છે, નહીં કે 0- સ્વિસીઝવાળા. (સંકેત ઃ સંયોજનોના નિર્માણમાં વૅટિસ ઊર્જા અવયવને ધ્યાનમાં રાખવો.)
ઉત્તર:
આયોનિક સંયોજનોની સ્થાયિતા તેમની ફૅટાઇસ ઍન્થાલ્પી પર આધારિત હોય છે. સંયોજનની ફૅટાઇસ ઍન્થાલ્પીનું મૂલ્ય જેટલું વધારે હોય તેટલો વધારે તે સ્થાયી હોય છે. લૅટાઇસ ઍન્થાલ્પીનું મૂલ્ય આયનના વિદ્યુતભારના સમપ્રમાણમાં હોય છે. જ્યારે ધાતુ આયન ઑક્સિજન સાથે સંયોજાય છે, ત્યારે લૅટાઇસ ઍન્થાલ્પીમાં O2- આયન સંકળાયેલ હોય છે. O2- આયનની લૅટાઇસ ઍન્થાલ્પી O– આયન કરતાં ઘણી વધારે હોય છે. આમ, ઑક્સાઇડ કે જેની પાસે O2- આયન સંકળાયેલો હોય, તે O– આયન કરતાં વધારે સ્થાયી હોય છે. આથી, કહી શકાય કે O– આયન કરતાં O2- આયન સહેલાઈથી બને છે.
![]()
પ્રશ્ન 20.
કયા વાયુવિલયો ઓઝોનનું ક્ષયન કરે છે ?
ઉત્તર:
ફ્રિઓન અથવા ક્લોરોફ્લોરો કાર્બન (CFCs) ઓઝોનને નુકસાનકર્તા એરોસોલ છે. પારજાંબલી કિરણોની હાજરીમાં સ્તર CFCના અણુઓ છૂટા પાડીને ક્લોરિન મુક્તમૂલક બનાવે છે, જે ઓઝોનનું ઑક્સિજનમાં રૂપાંતર થવા માટે જવાબદાર છે.
પ્રશ્ન 21.
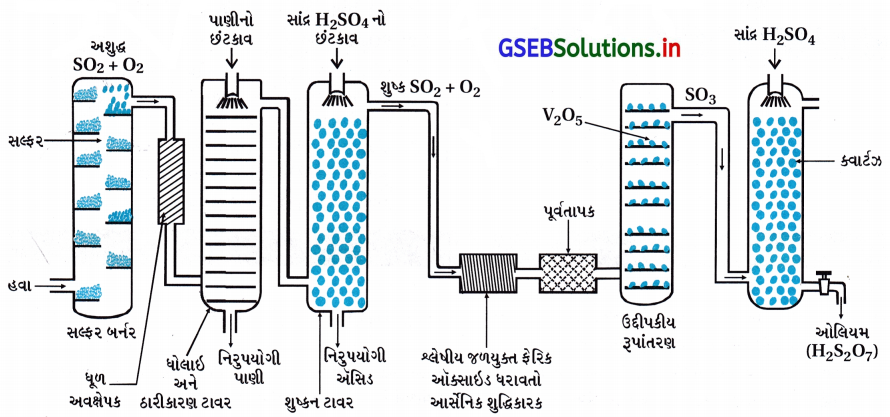
સંપર્ક પ્રક્રમ દ્વારા H2SO4ના ઉત્પાદનનું વર્ણન કરો.
ઉત્તર:
- સલ્ફ્યુરિક ઍસિડનું ઉત્પાદન સંપર્ક પ્રક્રમ દ્વારા કરવામાં આવે છે, જેમાં ત્રણ તબક્કાઓ સમાયેલા હોય છે. (i) સલ્ફર અથવા સલ્ફાઇડ અયસ્કોને બાળીને SO2 ઉત્પન્ન કરવો. (ii) ઉદ્દીપક (V2O5)ની હાજરીમાં ઑક્સિજન સાથેની પ્રક્રિયા દ્વારા SO2 નું SO3માં રૂપાંતર (iii) H2SO4માં SO3 ના અવશોષણથી ઓલિયમ (H2S2O7) બનવું.
- સલ્ફ્યુરિક ઍસિડના ઉત્પાદનનું ક્રમદર્શી રેખાચિત્ર આકૃતિમાં દર્શાવેલ છે. ઉત્પન્ન થયેલા SO2 ને ધૂળના ક્શો અને આર્સેનિક સંયોજનો જેવી અશુદ્ધિઓને દૂર કરીને શુદ્ધ કરવામાં આવે છે.
- H2SO4ના ઉત્પાદનમાં V2O5(ઉદ્દીપક)ની હાજરીમાં SO2 સાથેની O2 ની ઉદ્દીપકીય ઑક્સિડેશન પ્રક્રિયાથી SO3નું બનવું તે મુખ્ય તબક્કો છે.

- આ પ્રક્રિયા ઉષ્માક્ષેપક, પ્રતિવર્તી છે અને પુરોગામી પ્રક્રિયા કદમાં ઘટાડો કરે છે, તેથી મહત્તમ નીપજ મેળવવા માટે નીચું તાપમાન અને ઊંચું દબાણ સાનુકૂળ પરિસ્થિતિઓ છે. પરંતુ તાપમાન બહુ નીચું ન જવું જોઈએ નહીં તો પ્રક્રિયાવેગ ઘટી જશે.
- વ્યવહારમાં આ પ્લાન્ટનું સંચાલન 2 બાર દબાણે અને 720 K તાપમાને કરવામાં આવે છે. ઉદ્દીપકીય રૂપાંતર દ્વારા પ્રાપ્ત SO3 વાયુને સાંદ્ર H2SO4માં અવશોષવામાં આવે છે જે ઓલિયમ ઉત્પન્ન કરે છે. ઓલિયમનું પાણી વડે મંદન જરૂરી સાંદ્રતાવાળો H2SO4 આપે છે. ઉદ્યોગમાં આ પ્રક્રમને સતત ચાલુ રાખવા માટે અને ખર્ચને ઘટાડવા માટે પણ આ બે તબક્કાઓને એકસાથે કરવામાં આવે છે. સંપર્ક પ્રક્રમ દ્વારા મળતો સલ્ફ્યુરિક ઍસિડ 96-98 % શુદ્ધ હોય છે.
SO3 + H2SO4 → H2S2O7 (ઓલિયમ)
પ્રશ્ન 22.
SO2 કેવી રીતે હવા પ્રદૂષક છે ?
ઉત્તર:
વાયુ પર્યાવરણને ઘણી રીતે નુકસાન પહોંચાડે છે.
(i) તે પાણી સાથે સંયોજાઈને સલ્ફયુરિક ઍસિડ બનાવે છે. જે ઍસિડ વર્ષાનું કારણ છે. ઍસિડ વર્ષા થવાથી જમીન, છોડ, મકાનોને નુકસાન પહોંચે છે.
(ii) ઉપરાંત ખૂબ જ ઓછી સાંદ્રતાવાળો SO2ને અસર કરે છે. તેનાથી ગળા અને આંખને નુકસાન પહોંચે છે તથા તેના લીધે શ્વાસોચ્છ્વાસમાં પણ તકલીફ પડે છે.
(iii) તે છોડવાઓ માટે ખૂબ જ નુકસાનકર્તા છે. જો છોડને SO2 યુક્ત વાતાવરણમાં રાખવામાં આવે તો તેમના પાંદડાં લાંબા સમયે રંગ ગુમાવે છે. તેને ‘ક્લોરોસિસ’ તરીકે ઓળખવામાં આવે છે. આમ થવાનું કારણ, SO2ની હાજરીના લીધે ક્લોરોફિલના બંધારણમાં થતી ખરાબ અસર છે.
પ્રશ્ન 23.
હેલોજન સંયોજનો શા માટે પ્રબળ ઑક્સિડેશનકર્તાઓ છે ?
ઉત્તર:
હેલોજનની સામાન્ય ઇલેક્ટ્રૉન રચના np5 છે, જ્યાં n = 2 – 6. આથી, હેલોજનને અષ્ટકરચના પૂર્ણ કરવા 1 e– ની જરૂર પડે છે, જેથી તે સ્થાયી અષ્ટકરચના પ્રાપ્ત કરી શકે. આ ઉપરાંત હેલોજન તત્ત્વો ઊંચી વિદ્યુતઋણતા તથા ઊંચી ઋણ ઇલેક્ટ્રૉનપ્રાપ્તિ ઍન્થાલ્પી ધરાવે છે. આથી, તેમની પાસે ઇલેક્ટ્રૉન મેળવવા માટેની પ્રબળ વૃત્તિ હોય છે. આથી, તેઓ પ્રબળ ઑક્સિડેશનકર્તા તરીકે વર્તે છે.
પ્રશ્ન 24.
ફ્લોરિન શા માટે માત્ર એક જ ઑક્સોઍસિડ HOF બનાવે છે ?
ઉત્તર:
ફ્લોરિન માત્ર એક જ ઑક્સોઍસિડ HOF બનાવે છે. કારણ કે તેની વિદ્યુતઋણતા ઊંચી છે. આ ઉપરાંત નાનું કદ અને તેમાં d-કક્ષકની ગેરહાજરી પણ જવાબદાર છે.
પ્રશ્ન 25.
સમજાવો કે શા માટે લગભગ સમાન વિદ્યુતઋણતા હોવા છતાં નાઇટ્રોજન, હાઇડ્રોજન સાથે બંધ બનાવે છે જ્યારે ક્લોરિન બનાવતો નથી ?
ઉત્તર:
ક્લોરિન અને ઑક્સિજન લગભગ સમાન વિદ્યુતઋણતા ધરાવે છે, પરંતુ ક્લોરિન ભાગ્યે જ હાઇડ્રોજન બંધ બનાવે છે. ક્લોરિનની સાપેક્ષમાં ઑક્સિજનનું કદ નાનું હોવાથી તે એકમ કદ દીઠ ઊંચી ઇલેક્ટ્રૉન ઘનતા ધરાવે છે.
![]()
પ્રશ્ન 26.
ClO2ના બે ઉપયોગો લખો.
ઉત્તર:
ClO2ના ઉપયોગો :
(i) તે પાણીના શુદ્ધીકરણમાં વપરાય છે.
(ii) તે બ્લીચિંગ એજન્ટ તરીકે ઉપયોગી છે.
પ્રશ્ન 27.
હેલોજન તત્ત્વો શા માટે રંગીન હોય છે ?
ઉત્તર:
લગભગ બધા જ હેલોજન તત્ત્વો રંગીન હોય છે. કારણ કે હેલોજન તત્ત્વો દશ્યમાન વિભાગમાંથી કિરણોનું શોષણ કરે છે. જે બાહ્યતમ કક્ષાના ઇલેક્ટ્રૉનની ઉચ્ચતમ કક્ષામાં વહન કરવા પર અસર કરે છે. આથી, આ વહન કરાવવા માટે દરેક હેલોજન તત્ત્વને જુદી જુદી ઊર્જાની જરૂર પડે છે, જેથી દરેક હેલોજન તત્ત્વ જુદો જુદો રંગ દર્શાવે છે. જેમ કે,
F2-પીળો, O2-લીલાશ પડતો પીળો, Br2-લાલ, I2-જાંબલી
પ્રશ્ન 28.
F2 અને Cl2ની પાણી સાથેની પ્રક્રિયાઓ લખો.
ઉત્તર:

(ii) 2F2(g) + 2H2O → O2(g) + 4HF(aq)
પ્રશ્ન 29.
તમે HCl માંથી Cl2 અને Cl2માંથી HCl કેવી રીતે બનાવશો ? માત્ર પ્રક્રિયાઓ લખો.
ઉત્તર:
(i) HClમાંથી Cl2 ડેકનિધિ દ્વારા બનાવી શકાય.
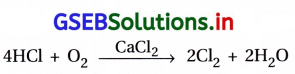
(ii) Cl2માંથી HCl એ Cl2ની પાણી સાથેની પ્રક્રિયાથી બનાવી શકાય.

પ્રશ્ન 30.
એન. બાર્ટલેટ Xe તથા PtF6 વચ્ચે પ્રક્રિયા કરાવવા શા માટે પ્રેરિત થયા ?
ઉત્તર:
નીલ બાર્ટલેટે શરૂઆતમાં ઑક્સિજન અને PtF6 વચ્ચે પ્રક્રિયા કરી. તેના પરિણામ સ્વરૂપ તેને O2+[PtF6] લાલ રંગનું સંયોજન બનાવ્યું. ત્યારબાદ તેને જાણવા મળ્યું કે ઑક્સિજન અને ઝેનોનની પ્રાથમિક આયનીકરણ ઍન્થાલ્પી લગભગ સમાન છે. આથી, તેને ઝેનોન (Xe) અને PtF6 સાથે પ્રક્રિયા કરી. આ પ્રક્રિયામાં સફળ થઈ તેને લાલ રંગનું સંયોજન Xe+[PtF6]–બનાવ્યો. આમ, એન. બાર્ટલેટ Xe તથા PtF6 વચ્ચે પ્રક્રિયા કરાવવા પ્રેરિત થયા.
પ્રશ્ન 31.
નીચે દર્શાવેલા સંયોજનોમાં ફોસ્ફરસની ઑક્સિડેશન અવસ્થાઓ શું હશે ?
(i) H3PO3
(ii) PCl3
(iii) Ca3P2
(iv) Na3PO4
(v) POF3
ઉત્તર:
ધારો કે, Pની ઑક્સિડેશન અવસ્થા x છે.
(i) H3PO3
3 + x + 3(-2) = 0
∴ 3 + x – 6 = 0
∴ x = +3
(ii) PC3
x + 3(-1) = 0
∴ x – 3 = 0
∴ x = +3
(iii) Ca3P2
3(+2) + 2x = 0
∴ 6 + 2x = 0
∴ 2x = – 6
∴ x = – 3
(iv) Na3PO4
3(+1) + x + 4(-2) = 0
∴ 3 + x – 8 = 0
∴ x – 5 = 0
∴ x = +5
(v) POF3
x + (-2) + 3 (-1) = 0
∴ x – 5 = 0
∴ x = +5
![]()
પ્રશ્ન 32.
નીચેની પ્રક્રિયાઓ માટે સમતોલિત સમીકરણ લખો.
(i) MnO2ની હાજરીમાં NaClને સલ્ફયુરિક એસિડ સાથે ગરમ કરવામાં આવે છે.
(ii) NaIના પાણીમાં બનાવેલા દ્રાવણમાં ક્લોરિન વાયુ પસાર કરવામાં આવે છે.
ઉત્તર:
(i) 4NaCl + MnO2 + 4H2SO4 → MnCl2 + 4NaHCO4 + 2H2O + Cl2
(ii) Cl2 + 2NaI → 2NaCl + I2
પ્રશ્ન 33.
ઝેનોન ફ્લોરાઇડ સંયોજનો XeF2, XeF4 અને XeF6 કેવી રીતે મેળવાય છે ?
ઉત્તર:
Xe અને F2ની સીધી પ્રક્રિયાથી XeF2, XeF4 અને XeF6 મેળવી શકાય છે.

પ્રશ્ન 34.
કયા તટસ્થ અણુ સાથે ClO– સમઇલેક્ટ્રોનીય છે ? શું તે અણુ લુઇસ બેઇઝ છે ?
ઉત્તર:
- ClO– એ CIF સાથે સમઇલેક્ટ્રૉનીય છે. બંને સંયોજનોમાં કુલ 26 ઇલેક્ટ્રૉન નીચે પ્રમાણે આવેલા છે.
ClO– = 17 + 8 + 1 = 26
CIF = 17 +9 = 26 - CIF લુઇસ બેઇઝ તરીકે વર્તે છે, કારણ તે F પાસેથી ઇલેક્ટ્રૉન મેળવી ClF3 બનાવે છે.
પ્રશ્ન 35.
XeO3 અને XeOF4 કેવી રીતે બનાવાય છે ?
ઉત્તર:
(i) XeO3 નીચેની બે રીતે બનાવી શકાય :
6XeF4 + 12H2O → 4XeO3 + 24HF + 2Xe
XeF6 + 3H2O → XeO3 + 6HF
(ii) XeOF4 ને XeF માંથી બનાવી શકાય.
XeF6 + H2O → XeOF4 + 2HF
પ્રશ્ન 36.
નીચે દર્શાવેલા દરેક જૂથ (set)ને સૂચવેલ ગુણધર્મ મુજબ ક્રમમાં ગોઠવો :
(i) F2, Cl2, Br2, I2 – બંધવિયોજન ઍન્થાલ્પીના ચઢતા ક્રમમાં
(ii) HE HCl, HBr, HI – એસિડ પ્રબળતાના ચઢતા ક્રમમાં
(iii) NH, PH, AsH, SbH, BiH – બેઝિક પ્રબળતાના ચઢતા ક્રમમાં
ઉત્તર:
(i) સમૂહમાંથી ઉપરથી નીચેની તરફ જતાં પરમાણ્વીય કદ વધવાની સાથે બંધવિયોજન ઍન્થાલ્પી ઘટે છે. છતાં F2ની બંધવિયોજન ઍન્થાલ્પી Cl2 અને Br2 કરતાં ઓછી છે. આમ થવાનું કારણ F2 નું નાનું કદ છે. આથી, બંધવિયોજન ઍન્થાલ્પીનો ચઢતો ક્રમ (હેલોજન માટે) નીચે મુજબ છે :
I2 < F2 < Br2 < Cl2
(ii) HF < HCl < HBr < HI
H-X અણુઓની બંધનઊર્જા પરમાણ્વીય કદ વધવાની સાથે ઘટતી જાય છે. જ્યાં X = F, Cl, Br, I. આથી, H-I બંધ સૌથી નબળો છે, HI એ સૌથી પ્રબળ ઍસિડ છે.’
(iii) BiH3 < SbH3 < AsH3 < PH3 < NH3
નાઇટ્રોજનથી બિસ્મથ તરફ જતાં, પરમાણુનું કદ વધવાની સાથે પરમાણુ પરની ઇલેક્ટ્રૉન ઘનતા ઘટે છે.
પ્રશ્ન 37.
નીચેના પૈકી કયું સંયોજન અસ્તિત્વ ધરાવતું નથી ?
(i) XeOF4
(ii) NeF2
(iii) XeF2
(iv) XeF6
ઉત્તર:
NeF2 અસ્તિત્વ ધરાવતું નથી.
પ્રશ્ન 38.
એવા ઉમદા વાયુ સ્પિસીઝના સૂત્ર આપો અને બંધારણને વર્ણવો કે જે નીચેની સ્વિસીઝ સાથે સમબંધારણીય હોય,
(i) \(\mathrm{ICl}_4^{-}\)
(ii) \(\mathrm{IBr}_2^{-}\)
(iii) \(\mathrm{BrO}_3^{-}\)
ઉત્તર:
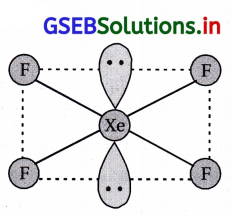
(i) XeF4 અને \(\mathrm{ICl}_4^{-}\) સાથે સમબંધારણીય છે અને તે સમચતુલકીય બંધારણ ધરાવે છે.
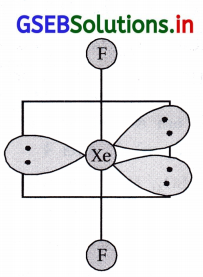
(ii) XeF2 એ \(\mathrm{IBr}_2^{-}\) સાથે સમબંધારણીય છે અને તે રેખીય બંધારણ ધરાવે છે.
(iii) XeO3 એ \(\mathrm{BrO}_3^{-}\) સાથે સમબંધારણીય છે અને પિરામિડલ બંધારણ ધરાવે છે.
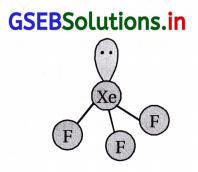
![]()
પ્રશ્ન 39.
ઉમદા વાયુઓ શા માટે પ્રમાણમાં મોટા આણ્વીયકદ ધરાવે છે ?
ઉત્તર:
- ઉમદા વાયુઓ અણુ રચી શકતા નથી. કારણ કે નિષ્ક્રિય વાયુ માટે તેમની આણ્વીય ત્રિજ્યા એ વાન્ડર વાલ્સ ત્રિજ્યા જેટલી જ હોય છે, જ્યારે બીજી તરફ બીજા પરમાણુઓની પરમાણ્વીય ત્રિજ્યા એ તેમની સહસંયોજક ત્રિજ્યા જેટલી હોય છે.
- વ્યાખ્યા મુજબ વાન્ડર વાલ્સ ત્રિજ્યા સહસંયોજક ત્રિજ્યા કરતાં વધારે હોય છે. આ કારણથી એક જ આવર્તમાં રહેલા તત્ત્વો કરતાં નિષ્ક્રિય વાયુના કદ સરખામણીમાં ઘણા મોટા હોય છે.
પ્રશ્ન 40.
નિયોન અને આર્ગોન વાયુના ઉપયોગોની યાદી બનાવો.
ઉત્તર:
નિયોનના ઉપયોગો :
(i) વીવિભાર નળીઓમાં
(ii) પ્રદર્શન હેતુ માટે પ્રસ્ફુરક બલ્બમાં
(iii) નિયોન બલ્બનો ઉપયોગ વાનસ્પતિય બગીચાઓમાં અને ગ્રીનહાઉસમાં થાય છે.
આર્ગોનના ઉપયોગો :
(i) ઊંચા તાપમાને ધાતુ પ્રક્રમોમાં નિષ્ક્રિય વાતાવરણ પૂરું પાડવામાં
(ii) વિદ્યુતબલ્બોમાં
(iii) પ્રયોગશાળામાં હવા સંવેદનશીલ પદાર્થોના વ્યવસ્થાપનમાં
GSEB Class 12 Chemistry p-વિભાગનાં તત્ત્વો NCERT Exemplar Questions and Answers
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-I)
પ્રશ્ન 1.
ક્લોરાઇડ ક્ષારમાં સાંદ્ર H2SO4 ઉમેરતાં રંગહીન વાયુ ઉત્પન્ન થાય છે જ્યારે આયોડાઇડ ક્ષારમાં ઉમેરતાં જાંબલી રંગનો વાયુ મળે છે. કારણ કે
(A) H2SO4, HIનું I2 માં રિડક્શન કરે છે.
(B) HI જાંબલી રંગ ધરાવે છે.
(C) HI નું ઑક્સિડેશન I2 માં થાય છે.
(D) HI નું પરિવર્તન HIO3 માં થાય છે.
જવાબ
(C) HI નું ઑક્સિડેશન I2 માં થાય છે.
હાઇડ્રોજન આયોડાઇડ (HI) એ H2SO4 કરતાં વધારે પ્રબળ ઑક્સિડેશનકર્તા છે. આથી, તે H2SO4નું SO2માં રિડક્શન કરે છે અને HIનું ઑક્સિડેશન થઈ I2 મળે છે. I2નો રંગ જાંબલી હોય છે. આમ, HIમાં સાંદ્ર H2SO4નો ઉમેરો કરવાથી HIનું ઑક્સિડેશન થઈ I2 મળે છે.

પ્રશ્ન 2.
ગુણાત્મક વિશ્લેષણમાં જ્યારે મંદ HCl વડે ઍસિડિક કરેલ જલીય દ્રાવણમાં H2S પસાર કરવામાં આવે, તો કાળા રંગના અવક્ષેપ મળે છે. આ અવક્ષેપને મંદ HNO3 ઉમેરી, ઉકાળીને પ્રક્રિયા કરતાં એ વાદળી રંગનું દ્રાવણ બનાવે છે. આ દ્રાવણમાં એમોનિયાનું જલીય દ્રાવણ વધુ પ્રમાણમાં ઉમેરવામાં આવે તો ………………… મળે છે.
(A) Cu(OH)2 નાઘેરા વાદળી રંગના અવક્ષેપ
(B) [Cu(NH3)4]2+ના ઘેરા વાદળી રંગનું દ્રાવણ
(C) Cu(NO3)2 નું ઘેરા વાદળી રંગનું દ્રાવણ
(D) Cu(OH)2 . Cu(NO3)2નું ઘેરા વાદળી રંગનું દ્રાવણ
જવાબ
(B) [Cu(NH3)4]2+ના ઘેરા વાદળી રંગનું દ્રાવણ
- ગુણાત્મક વિશ્લેષણ દરમિયાન મંદ HCl વડે ઍસિડિક કરેલા ક્ષારના જલીય દ્રાવણ પરથી H2S વાયુ પસાર કરતાં CuSના કાળા અવક્ષેપ મળે છે.

- CuSને મંદ HNO3 સાથે ઊકાળતાં દ્રાવણ વાદળી રંગનું બને છે ત્યારે નીચે મુજબની પ્રક્રિયા થાય છે :
3CuS + 8NHO3 → 3Cu(NO3)2 + 2NO + 3S + 4H2O
S + 2NHO3 → H2SO4 + NO
2Cu2+ + SO2-4 + 2NH3 + 2H2O →
Cu(OH)2 · CuSO4 + 2NH4OH

પ્રશ્ન 3.
સાયક્લોટ્રાયમેટાફોસ્ફોરિક એસિડના અણુમાં કેટલા એકલ અને દ્વિબંધ હોય છે ?
(A) 3 દ્વિબંધ, 9 એકલ બંધ
(B) 6 દ્વિબંધ, 6 એકલ બંધ
(C) 3 દ્વિબંધ, 12 એકલ બંધ
(D) 0 દ્વિબંધ, 12 એકલ બંધ
જવાબ
(C) 3 દ્વિબંધ, 12 એકલ બંધ
સાયક્લોટ્રાયમેટાફૉસ્ફોરિક ઍસિડના અણુમાં 3 દ્વિબંધ અને 12 એકલ બંધ હોય છે, જે આકૃતિમાં બતાવ્યા મુજબ છે :
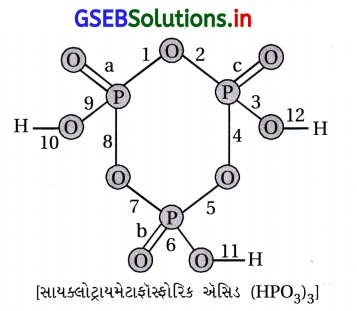
a, b, c એમ ત્રણ π બંધ છે તથા 1થી 12 એમ 12 એકલંબધ σ બંધ છે.
પ્રશ્ન 4.
નીચેનામાંથી કયાં તત્ત્વોમાં pπ-dπ બંધન ધરાવે છે ?
(A) કાર્બન
(B) નાઇટ્રોજન
(C) ફૉસ્ફરસ
(D) બોરોન
જવાબ
(C) ફૉસ્ફરસ
આપેલા તમામ તત્ત્વો કાર્બન, નાઇટ્રોજન, ફૉસ્ફરસ અને બોરોન પૈકી માત્ર ફૉસ્ફરસ પાસે ખાલી રહેલી d-કક્ષક હાજર છે. આથી માત્ર ફૉસ્ફરસ જ pπ-dπ પ્રકારના બંધ બનાવી શકે છે.
પ્રશ્ન 5.
નીચે આપેલાં આયનોની જોડમાં કઈ જોડ સમઇલેક્ટ્રૉનીય અને સમબંધારણીય હોય છે ?
(A) \(\mathrm{CO}_3^{2-}, \mathrm{NO}_3^{-1}\)
(B) \(\mathrm{ClO}_3^{-}, \mathrm{CO}_3^{2-}\)
(C) \(\mathrm{SO}_3^{2-}, \mathrm{NO}_3^{-}\)
(D) \(\mathrm{ClO}_3^{-}, \mathrm{SO}_3^{2-}\)
જવાબ
(A) \(\mathrm{CO}_3^{2-}, \mathrm{NO}_3^{-1}\)
સરખા ઇલેક્ટ્રૉન ધરાવતા સંયોજનોને સમઇલેક્ટ્રૉનીય સંયોજનો કહે છે.
\(\mathrm{CO}_3^{2-}\) માટે
કુલ ઇલેક્ટ્રૉનની સંખ્યા
= 6 + (8 × 3) + 2
= 6 + 24+ 2
= 32
\(\mathrm{NO}_3^{-1}\) માટે
કુલ ઇલેક્ટ્રૉનની સંખ્યા
= 7+ (8 × 3) + 1
= 7 + 24 + 1
= 32
આમ, \(\mathrm{CO}_3^{2-}\) અને \(\mathrm{NO}_3^{-1}\) સમઇલેક્ટ્રૉનીય છે. આ બન્ને આયનોનું માળખું (આકાર) પણ સરખો હોવાથી તેમને સમબંધારણીય પણ કહે છે.
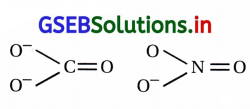
બન્ને આયનોનું બંધારણ સમતલીય ત્રિકોણ પ્રકારનું છે અને બન્ને પરમાણુમાં (C અને N) sp2 પ્રકારનું સંકરણ થાય છે.
![]()
પ્રશ્ન 6.
સમૂહમાં ફ્લોરિનથી આયોડિન તરફ જતાં હાઇડ્રોજન પ્રત્યે આકર્ષણ ઘટે છે, તો નીચેનામાંથી કયા હેલોજન ઍસિડની મહત્તમ બંધ-વિયોજન ઉષ્મા સૌથી વધુ છે ?
(A) HF
(C) HBr
(B) HCl
(D) HI
જવાબ
(A) HF

પ્રશ્ન 7.
E – H (E = તત્ત્વ) બંધની બંધ-વિયોજન ઊર્જાનાં મૂલ્યો નીચે આપેલાં છે. નીચેનામાંથી કયું સંયોજન સૌથી પ્રબળ રિડક્શનકર્તા છે ?
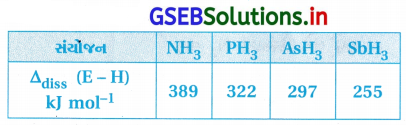
(A) NH3
(B) PH3
(C) AsH3
(D) SbH3
જવાબ
(D) SbH3
સમૂહમાં ઉપરથી નીચે તરફ જતાં મધ્યસ્થ પરમાણુમાં કદ વધે છે. આથી E – H બંધની બંધલંબાઈ વધે છે અને બંધવિયોજન ઍન્થાલ્પી ઘટે છે. આથી, રિડક્શનકર્તા તરીકેનો ગુણધર્મ વધે છે.

આમ, SbH3 પ્રબળ રિડક્શનકર્તા છે.
પ્રશ્ન 8.
ફૉસ્ફરસને સાંદ્ર NaOHના દ્રાવણ સાથે CO2 ના નિષ્ક્રિય વાતાવરણમાં ગરમ કરતાં વાયુ ઉત્પન્ન થાય છે. આ વાયુ માટે નીચેનામાંથી કયાં વિધાન સાચાં નથી ?
(A) આ અત્યંત ઝેરી વાયુ છે અને તે સડેલી માછલી જેવી વાસ ધરાવે છે.
(B) આ વાયુનું પાણીમાં દ્રાવણ સૂર્યપ્રકાશની હાજરીમાં વિઘટન પામે છે.
(C) તે NH3 કરતાં વધુ બેઝિક છે.
(D) તે NH2 કરતાં ઓછી બેઝિક છે.
જવાબ
(C) તે NH3 કરતાં વધુ બેઝિક છે.
સફેદ ફૉસ્ફરસને સાંદ્ર NaOHના દ્રાવણમાં CO2 જેવા નિષ્ક્રિય વાયુના વાતાવરણમાં ગરમ કરતાં ફૉસ્ફિન વાયુ મળે છે. તે NH3 કરતાં ઓછો બેઝિક છે.

પ્રશ્ન 9.
નીચેનામાંથી કયો એસિડ ત્રણ પ્રકારના ક્ષાર બનાવે છે ?
(A) H3PO2
(B) H3BO3
(C) H3PO4
(D) H3PO3
જવાબ
(C) H3PO4
- H3PO4 નું બંધારણ :
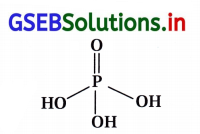
- H3PO4 પાસે ત્રણ -OH સમૂહ આવેલા છે. આથી ત્રણ
આયનીકરણ પામે તેવા H તેની પાસે હોય છે. આથી તે ત્રણ શ્રેણીના ક્ષારો બનાવે છે. જે નીચે મુજબ છે.
NaH2PO4, Na2HPO4 અને Na3PO4
પ્રશ્ન 10.
H3PO2 ની પ્રબળ રિડક્શનકર્તા ગુણધર્મનું કારણ ……………………..
(A) ફૉસ્ફરસની નીચી ઑક્સિડેશન અવસ્થા.
(B) બે -OH અને એક P – H બંધની હાજરીને કારણે.
(C) એક -OH બંધ અને બે P – H બંધ હોવાને કારણે.
(D) ફૉસ્ફરસની ઊંચી ઇલેક્ટ્રૉનપ્રાપ્તિ ઍન્થાલ્પી.
જવાબ
(C) એક -OH બંધ અને બે P – H બંધ હોવાને કારણે.
પ્રશ્ન 11.
લેડ નાઇટ્રેટને ગરમ કરતાં નાઇટ્રોજન અને લેડના ઑક્સાઇડ બને છે. બનતા ઑક્સાઇડ ………………… છે.
(A) N2O, PbO
(B) NO2, PbO
(C) NO, PbO
(D) NO, PbO2
જવાબ
(B) NO2, PbO
લેડ નાઇટ્રેટને ગરમ કરતાં કથ્થાઈ રંગનો નાઇટ્રોજન ડાયૉક્સાઇડ (NO2) તથા લેડ(II) ઑક્સાઇડ મળે છે.

![]()
પ્રશ્ન 12.
નીચેનામાંથી કયું તત્ત્વ અપરરૂપો (બહુરૂપકો) ધરાવતું નથી ?
(A) નાઇટ્રોજન
(C) ઍન્ટિમની
(B) બિસ્મથ
(D) આર્સેનિક
જવાબ
(A) નાઇટ્રોજન
નાઇટ્રોજન તત્ત્વ અપ૨રૂપો આપતું નથી. કારણ કે તેમાં નિર્બળ N-N એકલબંધ આવેલ હોય છે. આથી N-N પરમાણુ જોડાઈ પૉલિમર જેવું બંધારણ આપી શકતા નથી. આથી નાઇટ્રોજનના અપરરૂપો મળતા નથી.
પ્રશ્ન 13.
નાઇટ્રોજનની મહત્તમ સહસંયોજકતા ………………………. છે.
(A) 3
(B) 5
(C) 4
(D) 6
જવાબ
(C) 4
નાઇટ્રોજનની મહત્તમ સંયોજકતા 4 છે. તેમાં 1 ઇલેક્ટ્રૉન s-કક્ષકનો અને 3 ઇલેક્ટ્રૉન p-કક્ષકના એમ કુલ ચાર ઇલેક્ટ્રૉન બંધમાં ભાગ લેવા માટે તૈયાર હોય છે.
પ્રશ્ન 14.
નીચેનામાંથી કયું વિધાન ખોટું છે ?
(A) N-N એકલ બંધ, P-P એકલ બંધ કરતાં વધુ પ્રબળ છે.
(B) PH3 એક લિગેન્ડ તરીકે વર્તે છે અને સંક્રાંતિ તત્ત્વ સાથે સંકીર્ણ સંયોજન બનાવે છે.
(C) NO2 અનુચુંબકીય સ્વભાવ ધરાવે છે.
(D) N2O5માં નાઇટ્રોજનની સહસંયોજકતા ચાર છે.
જવાબ
(A) N-N એકલ બંધ, P-P એકલ બંધ કરતાં વધુ પ્રબળ છે.
વિધાન (A) ખોટું છે. કારણ કે N-N એકલબંધ એ P-P એકલબંધ કરતાં નિર્બળ હોય છે. આથી નાઇટ્રોજનના અપરરૂપો મળતા નથી.
(i) PH3માં P પાસે બંધમાં ભાગ લીધા વગરના ઇલેક્ટ્રૉન હોવાથી તે આ ઇલેક્ટ્રૉનનું દાન કરી લિગેન્ડ બનાવે છે.
(ii) NO2 સ્વભાવે અનુચુંબકીય હોય છે. કારણ કે તેમાં એક અયુગ્મિત ઇલેક્ટ્રૉન હોય છે.
(iii) N2O5માં નાઇટ્રોજનની સંયોજકતા 4 હોય છે.
પ્રશ્ન 15.
\(\mathrm{NO}_3^{-}\) આયન વીંટી કસોટીમાં કથ્થાઈ રંગની વીંટી બનાવે છે. આમ થવાનું કારણ ……………………….. નું સર્જન છે.
(A) [Fe(H2O)5 (NO)]2+
(B) FeSO4 • NO2
(C) [Fe(H2O)4 (NO)2]2+
(D) FeSO4 · HNO3
જવાબ
(A) [Fe(H2O)5 (NO)]2+
જ્યારે \(\mathrm{NO}_3^{-}\) આયનમાં તાજા બનાવેલા FeSO4નું દ્રાવણ ઉમેરવામાં આવે ત્યારે તે કથ્થાઈ રંગના સંકીર્ણ સંયોજનો આપે છે આને નાઇટ્રેટ આયનની પરખ કસોટી વીંટી કસોટી તરીકે જાણીતી છે.

પ્રશ્ન 16.
સમૂહ 15ના તત્ત્વો +5 ઑક્સિડેશન અવસ્થાનાં સંયોજનો બનાવે છે. પરંતુ બિસ્મથ +5 ઑક્સિડેશન અવસ્થા ધરાવતું માત્ર એક જ સંયોજન બનાવે છે. આ સંયોજન …………………….. છે.
(A) Bi2O5
(B) BiF5
(C) BiCl5
(D) Bi2S5
જવાબ
(B) BiF5
+5 ઑક્સિડેશન અવસ્થાની સ્થાયિતા સમૂહમાં ઉપરથી નીચે તરફ જતાં ઘટતી જાય છે. જ્યારે +3 ઑક્સિડેશન અવસ્થાની સ્થાયિતા નીચે તરફ જતાં વધતી જાય છે. આ ઘટના નિષ્ક્રિય યુગ્મ અસરને કારણે જોવા મળે છે. Biનું +5 ઑક્સિડેશન અવસ્થા ધરાવતું એક જ સંયોજન મળે છે જે BiF5 છે. Fના નાના કદ અને ઊંચી વિદ્યુતઋણતાના કારણે જોવા મળે છે.
![]()
પ્રશ્ન 17.
એમોનિયમ ડાયક્રોમેટ અને બેરિયમ એઝાઇડને સ્વતંત્ર રીતે ગરમ કરતાં ………………… મળે છે.
(A) બંને કિસ્સામાં N2 વાયુ
(B) એમોનિયમ ડાયક્રોમેટમાંથી N2 અને બેરિયમ એઝાઇડમાંથી NO વાયુ
(C) એમોનિયમ ડાયક્રોમેટમાંથી N2O અને બેરિયમ
એઝાઇડમાંથી N2 વાયુ
(D) એમોનિયમ ડાયક્રોમેટમાંથી N2O અને બેરિયમ
એઝાઇડમાંથી NO2 વાયુ
જવાબ
(A) બંને કિસ્સામાં N2 વાયુ
એમોનિયમ ડાયક્રોમેટને અને બેરિયમ એઝાઇડને અલગ અલગ ગરમ કરતાં બન્નેમાંથી N2 વાયુ મળે છે.
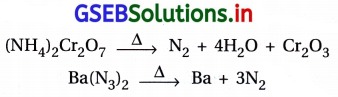
પ્રશ્ન 18.
HNO3ની બનાવટમાં, એમોનિયા વાયુના ઉદ્દીપકીય ઑક્સિડેશનથી NO વાયુ મળે છે. બે મોલ NH3 ના
ઑક્સિડેશનથી …………………….. મોલ NO ઉત્પન્ન થાય છે.
(A) 2
(B) 3
(C) 4
(D) 6
જવાબ
(A) 2
બે મોલ એમોનિયા દ્વારા 2 મોલ NO વાયુ ઑક્સિડેશન દ્વારા બને છે.
પ્રશ્ન 19.
NaH2PO2 માંથી મળતા ઋણાયનમાં કેન્દ્રસ્થ પરમાણુની ઑક્સિડેશન અવસ્થા …………………… છે.
(A) + 3
(B) + 5
(C) + 1
(D) – 3
જવાબ
(C) + 1
અહીં, મધ્યસ્થ પરમાણુ P છે. ધારો કે તેનો ઑક્સિડેશન આંક x છે.
NaH2PO2
∴1 + (2 × 1) + x + 2 (-2) = 0
∴ 1 + 2 + x – 4 = 0
∴ x – 1 =- 0
∴ x = + 1
પ્રશ્ન 20.
નીચેનામાંથી કયું સંયોજન સમચતુલકીય નથી ?
(A) \(\mathrm{NH}_4^{+}\)
(B) SiCl4
(C) SF4
(D) \(\mathrm{SO}_4^{2-}\)
જવાબ
(C) SF4
પ્રશ્ન 21.
નીચેનામાંથી સલ્ફરના પેરોક્સો (peroxo) એસિડ કયા છે?
(A) H2SO5 અને H2S2O8
(B) H2SO5 અને H2S2O7
(C) H2S2O7 અને H2S2O8
(D) H2S2O6 અને H2S2O7
જવાબ
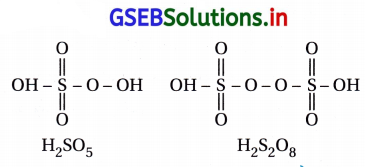
(A) H2SO5 અને H2S2O8
સલ્ફરના પેરોક્સૉઍસિડમાં ઓછામાં ઓછો એક –0–0− બંધ આવેલ હોય જે નીચે મુજબ છે.
![]()
પ્રશ્ન 22.
સાધારણ રીતે ગરમ સાંદ્ર H2SO4 પ્રબળ ઑક્સિડેશનકર્તા તરીકે વર્તે છે. તે ધાતુ અને અધાતુ બંનેનું ઑક્સિડેશન કરે છે. નીચેનામાંથી કયું તત્ત્વ સાંદ્ર H2SO4 દ્વારા બે વાયુરૂપ નીપજોમાં ઑક્સિડેશન પામે છે ?
(A) Cu
(B) S
(C) C
(D) Zn
જવાબ
(C) C
- H2SO4 એ પ્રબળ ઑક્સિડેશનકર્તા છે જે ધાતુ અને અધાતુ એમ બન્નેનું ઑક્સિડેશન કરે છે જે નીચે પ્રમાણે છે.
Cu + 2H2SO4 (સાંદ્ર) → CuSO4 + SO2 + 2H2O
S + 2H2SO4 (સાંદ્ર) → 3SO2 + 2H2O - જ્યારે તે કાર્બનનું ઑક્સિડેશન કરે ત્યારે બે વાયુમય ઑક્સાઇડ CO2 અને SO2 મળે છે.
C + 2H2SO4 (સાંદ્ર) → CO2 + 2SO2 + 2H2O
પ્રશ્ન 23.
મેંગેનીઝનું એક કાળું સંયોજન હેલોજન ઍસિડ સાથે પ્રક્રિયા કરીને લીલાશ પડતો પીળો વાયુ આપે છે. જ્યારે વધુ પ્રમાણમાં આ વાયુ NH3 સાથે પ્રક્રિયા કરે છે ત્યારે અસ્થાયી ટ્રાયહેલાઇડ બનાવે છે. આ પ્રક્રિયામાં નાઇટ્રોજનની ઑક્સિડેશન અવસ્થા …………………. બદલાય છે.
(A) -3 થી +3
(B) -3 થી 0
(C) -3 થી +5
(D) 0 થી −3
જવાબ
(A) -3 થી + 3
- કાળા રંગનું સંયોજન MnO2 જ્યારે HCl સાથે પ્રક્રિયા કરે ત્યારે Cl2 વાયુના કારણે લીલાશ પડતો પીળો રંગ જોવા મળે છે.
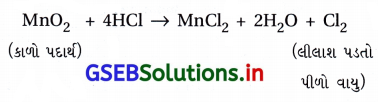
- Cl2 હવે NH3 સાથે પ્રક્રિયા કરી NCl3 બનાવે છે.

- આમ, ઉપરના સમીકરણમાં Nના ઑક્સિડેશન આંક -3થી +3 બને છે.
પ્રશ્ન 24.
Xe નાં સંયોજનોની બનાવટમાં બાર્ટલેટે (Bartlett) \(\mathrm{O}_2^{+}\) Pt \(F_6^{-}\) બેઝિક સંયોજન તરીકે લીધેલ છે. કારણ કે…………
(A) O2 અને Xe બંને સમાન કદ ધરાવે છે.
(B) O2 અને Xe બંને સમાન ઇલેક્ટ્રૉનપ્રાપ્તિ ઍન્થાલ્પી ધરાવે છે.
(C) O2 અને Xe ની લગભગ સમાન આયનીકરણ ઍન્થાલ્પી ધરાવે છે.
(D) Xe અને O2 બંને વાયુઓ છે.
જવાબ
(C) O2 અને Xe ની લગભગ સમાન આયનીકરણ ઍન્થાલ્પી ધરાવે છે.
બાર્ટલેટે \(\mathrm{O}_2^{+}\) Pt \(F_6^{-}\) સંયોજનને પાયાના સંયોજન તરીકે લીધું હતું. કારણ કે O2 અને Xe બન્નેની આયનીકરણ ઍન્થાલ્પી લગભગ સમાન છે અને નિષ્ક્રિય વાયુની આયનીકરણ ઍન્થાલ્પી તેના આવર્તનાં અન્ય તત્ત્વો કરતાં ખૂબ વધારે હોય છે. કારણ કે તેમની ઇલેક્ટ્રૉન રચના સૌથી વધારે સ્થાયી હોય છે.
પ્રશ્ન 25.
ઘન-અવસ્થામાં PCl5 એ ……………………. છે.
(A) સહસંયોજક ઘન
(B) અષ્ટલકીય બંધારણ
(C) [PCl6]+ અષ્ટફલકીય અને [PCl4]– સમચતુલકીય ધરાવતો આયનીય ઘન
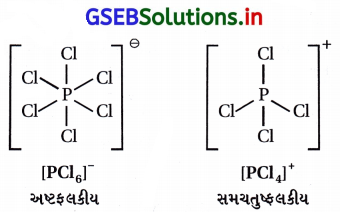
(D) [PCl4]+માં સમચતુષ્કલકીય અને [PCl6]– અષ્ટફલકીય ધરાવતો આયનીય ઘન
જવાબ
(D) [PCl4]+માં સમચતુષ્કલકીય અને [PCl6]– અષ્ટફલકીય ધરાવતો આયનીય ઘન
પ્રશ્ન 26.
કેટલાંક આયનોમાં રિડક્શન પોટેન્શિયલ નીચે આપેલ છે. તેમને ઑક્સિડેશનકર્તાની પ્રબળતાના ઊતરતા ક્રમમાં ગોઠવો.
| આયન | \(\mathrm{ClO}_4^{-}\) | \(\mathrm{IO}_4^{-}\) | \(\mathrm{BrO}_4^{-}\) |
| રિડક્શન પોટેન્શિયલ E⊖/V |
E⊖ = 1.19V | E⊖ = 1.65 | E⊖ = 1.74V |
(A) \(\mathrm{ClO}_4^{-}>\mathrm{IO}_4^{-}>\mathrm{BrO}_4^{-}\)
(B) \(\mathrm{IO}_4^{-}>\mathrm{BrO}_4^{-}>\mathrm{ClO}_4^{-}\)
(C) \(\mathrm{BrO}_4^{-}>\mathrm{IO}_4^{-}>\mathrm{ClO}_4^{-}\)
(D) \(\mathrm{BrO}_4^{-}>\mathrm{ClO}_4^{-}>\mathrm{IO}_4^{-}\)
જવાબ
(C) \(\mathrm{BrO}_4^{-}>\mathrm{IO}_4^{-}>\mathrm{ClO}_4^{-}\)
આયનો માટે જેટલું પ્રમાણિત રિડક્શન પોર્ટેન્શિયલનું મૂલ્ય વધારે તેટલો તેનો ઑક્સિડેશનકર્તા તરીકેનો ગુણધર્મ વધારે હોય છે.
પ્રશ્ન 27.
નીચેનામાંથી કઈ સમઇલેક્ટ્રૉનીય જોડ છે ?
(A) ICl2, ClO2
(B) \(\mathrm{BrO}_2^{-}, \mathrm{BrF}_2^{+}\)
(C) ClO2, BrF
(D) CN–, O3
જવાબ
(B) \(\mathrm{BrO}_2^{-}, \mathrm{BrF}_2^{+}\)
જે તત્ત્વોમાં કુલ ઇલેક્ટ્રૉનની સંખ્યા સમાન હોય તેને સમઇલેક્ટ્રૉનીય કહે છે.
| \(\mathrm{BrO}_2^{-}\) | \(\mathrm{BrF}_2^{+}\) | |
| કુલ ઇલેક્ટ્રૉનની સંખ્યા |
= 35 + 2 × 8 + 1 = 52 |
= 35 + 9 × 2 – 1 = 52 |
અહીં, (B)માં સરખા ઇલેક્ટ્રૉન થાય છે જ્યારે અન્યમાં સરખા ઇલેક્ટ્રૉન થતા નથી.
| ICl2 53 + 2 × 37 = 87 |
ClO2 17 + 16 = 33 |
| ClO2 17 + 16 = 33 |
BrF 35 + 9 = 44 |
| CN– = 6 + 7 + 1 = 4 |
O3 = 8 × 3 = 24 |
![]()
બહુવિકલ્પ પ્રશ્નો (પ્રકાર-II)
પ્રશ્ન 1.
ગરમ NaOH ના દ્રાવણમાં ક્લોરિન વાયુ પસાર કરતાં પ્રક્રિયા દરમિયાન ક્લોરિનના ઑક્સિડેશન આંકમાં બે ફેરફાર થાય છે તે ……………………. અને ………………………. છે.
(A) 0 થી +5
(B) 0 થી +3
(C) 0 થી −1
(D) 0 થી +1
જવાબ
(A, C)
- જ્યારે Cl2 વાયુને ગરમ NaOHના દ્રાવણ પરથી પસાર કરવામાં આવે તો NaCl અને NaClO3 મળે છે.
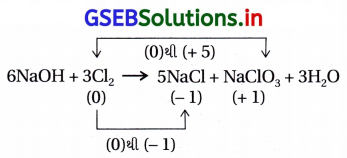
- આમ, Clનો ઑક્સિડેશન આંક 0થી −1 અને 0થી + 5 થાય છે.
પ્રશ્ન 2.
નીચેનામાંથી કયો વિકલ્પ તેની સાથે દર્શાવેલ ગુણધર્મના સંદર્ભમાં યોગ્ય નથી ?
(A) F2 > Cl2 > Br2 > I2 – ઑક્સિડેશનકર્તા તરીકે પ્રબળતા
(B) MI > MBr > MCl > MF – ધાતુ હેલાઇડની આયનીય લાક્ષણિકતા
(C) F2 > Cl2 > Br2 > I2 – બંધ વિયોજન ઍન્થાલ્પી
(D) HI < HBr < HCl < HF – હાઇડ્રોજન-હેલોજન બંધ પ્રબળતા
જવાબ
(B, C)
- ઇલેક્ટ્રૉન પ્રાપ્ત કરવાની ક્ષમતાનો સાચો ક્રમ F2 > Cl2 > Br2 > I2 છે. આમ, ઑક્સિડેશન કરવાની ક્ષમતાનો ક્રમ પણ આ જ થશે.
- F સૌથી વધારે વિદ્યુતઋણ તત્ત્વ છે. આથી તેની ઑક્સિડેશનકર્તા તરીકેની પ્રબળતા સૌથી વધારે હશે. આમ, ધાત્વીય હેલાઇડની આયોનિક લાક્ષણિકતા માટે સાચો ક્રમ નીચે મુજબ છે :
MI < MBr < MCl < MF - બંધ વિયોજન ઍન્થાલ્પીનો સાચો ક્રમ Cl2 > Br2 > F2 > I2 છે જે F2 અણુમાં રહેલા અબંધકારક ઇલેક્ટ્રૉનયુગ્મ વચ્ચેના અપાકર્ષણને લીધે જોવા મળે છે.
- આમ, બંધ વિયોજન ઊર્જાનો સાચો ક્રમ આ મુજબ છે :
Cl2 > Br2 > F2 > I2
પ્રશ્ન 3.
સફેદ ફૉસ્ફરસના P4 અણુ માટે નીચેનામાંથી કયું વિધાન સાચું છે ?
(A) તે 6 અબંધકારક ઇલેક્ટ્રૉનયુગ્મ ધરાવે છે.
(B) તે 6 P-P એકલ બંધ ધરાવે છે.
(C) તે 3 P-P એકલ બંધ ધરાવે છે.
(D) તે ચાર અબંધકા૨ક ઇલેક્ટ્રૉનયુગ્મો ધરાવે છે.
જવાબ
(B, D)
- P4 અણુનું બંધારણ નીચે મુજબ છે.
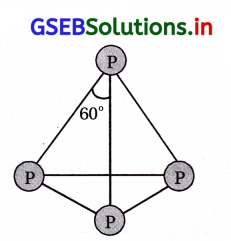
- તેમાં દરેક P પાસે 4 અબંધકા૨ક ઇલેક્ટ્રૉનયુગ્મો હોય છે. તેમાં 6 P-P એકલબંધ હોય છે.
પ્રશ્ન 4.
નીચેનામાંથી કયાં વિધાન સાચાં છે ?
(A) હેલોજનમાં આયોડિન અને ફ્લોરિનનો ત્રિજ્યા ગુણોત્તર સૌથી વધુ છે.
(B) F-F બંધ સિવાય બધા જ હેલોજનમાં X-X બંધ, આંતર- હેલોજન સંયોજનના X-X’ બંધ કરતાં નિર્બળ હોય છે.
(C) આંતરહેલોજન સંયોજનોમાં આયોડિનફ્લોરાઇડ સૌથી વધુ સંખ્યામાં પરમાણુઓ ધરાવે છે.
(D) હેલોજનનાં સંયોજનો કરતાં આંતરહેલોજન સંયોજનો વધુ સક્રિય છે.
જવાબ
(A, C, D)
- (A) હેલોજન તત્ત્વો પૈકી આયોડિન અને ફ્લોરિનનો ત્રિજ્યા ગુણોત્તર મહત્તમ હોય છે. કારણ કે આયોડિનની ત્રિજ્યા સૌથી મોટી હોય છે. જ્યારે ફ્લોરિનની ત્રિજ્યા સૌથી નાની હોય છે.
- (B) વિધાન આ મુજબ સાચી રીતે લખી શકાય. આંતર- હેલોજન સંયોજનો હેલોજન તત્ત્વો કરતાં વધારે સક્રિય હોય છે. કારણ કે આંતરહેલોજન સંયોજનમાં રહેલો X-X’ બંધ હેલોજન તત્ત્વોમાં રહેલા X-X બંધ કરતાં નિર્બળ હોય છે. અપવાદ : F-F બંધ
- (C) આંતરહેલોજન સંયોજનો પૈકી આયોડિન ફ્લોરાઇડમાં મહત્તમ પરમાણુઓ હાજર હોય છે. કેમ કે આયોડિન અને ફ્લોરિનનો ત્રિજ્યા ગુણોત્તર મહત્તમ હોય છે.
- (D) આંતરહેલોજન સંયોજનો હેલોજન તત્ત્વો કરતાં વધારે સક્રિય હોય છે. કારણ કે X-X’ બંધ એ X-X બંધ કરતાં નિર્બળ હોય છે.
પ્રશ્ન 5.
SO2 વાયુના સંદર્ભમાં નીચેનામાંથી કયું વિધાન સાચું છે ?
(A) ભેજવાળા વાતાવરણમાં તે ઑક્સિડેશનકર્તા તરીકે વર્તે છે.
(B) તે અણુ રેખીય ભૂમિતિ ધરાવે છે.
(C) તેનું મંદ દ્રાવણ ચેપનાશક તરીકે વપરાય છે.
(D) મંદ H2SO4 ની ધાતુ સલ્ફાઇડ સાથેની પ્રક્રિયાથી બનાવી શકાય છે.
જવાબ
(A, C)
- (A) ભેજવાળા વાતાવરણમાં તે બ્લીચિંગકર્તા (ઑક્સિડેશનકર્તા) તરીકે વર્તે છે.
દા.ત., તે Fe(III)નું Fe(II) આયનમાં રૂપાંતર કરે છે અને તે KMnO4(VII) દ્રાવણનો રંગ પણ દૂર કરે છે.
2Fe+3 + SO2 + 2H2O → 2Fe+2 + SO2-4 + 4H+
(B) વિધાન ખોટું છે.
SO2નો આકાર કોણીય હોય છે.
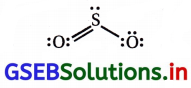
(C) તેનું મંદ દ્રાવણ ચેપનાશક છે.
(D) સલ્ફાઇડ ખનીજની O2 સાથેની પ્રક્રિયાથી SO2 મળે છે.
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- જ્યારે ધાતુની મંદ H2SO4 સાથેની પ્રક્રિયાથી H2S મળે છે. આમ, વિકલ્પ (A) અને (C) સાચાં છે.
![]()
પ્રશ્ન 6.
નીચેનામાંથી કયાં વિધાનો સાચાં છે ?
(A) HNO3માં બધા જ (ત્રણ) N-O બંધની બંધલંબાઈ સમાન હોય છે.
(B) વાયુ-અવસ્થામાં PCl5ના અણુમાં બધા જ P-Cl બંધની બંધલંબાઈ સમાન હોય છે.
(C) સફેદ ફૉસ્ફરસના P4 અણુમાં કોણીય તણાવ હોવાને કારણે તે ખૂબ જ સક્રિય છે.
(D ઘન-અવસ્થામાં PCl5 આયનીય છે જેમાં ધનાયન સમચતુલકીય અને ઋણાયન અષ્ટફલકીય છે.
જવાબ
(C, D)
સુધારેલા વિધાનો નીચે મુજબ છે :
(A) HNO3માં ત્રણે N-Oની બંધલંબાઈ સરખી હોતી નથી.
(B) PCl5નાં બધાં જ P-Cl બંધની લંબાઈ પણ સરખી હોતી નથી. તેમાં બે અક્ષીય બંધો નિરક્ષીય બંધો કરતાં લાંબા હોય છે.
પ્રશ્ન 7.
સામે આપેલા ગુણધર્મના સંદર્ભમાં નીચેનામાંથી કયા ક્રમ સાચા છે ?
(A) As2O3 < SiO2 < P2O3 < SO2 ઍસિડ પ્રબળતા
(B) AsH3 < PH3 < NH3 બાષ્પીભવન ઍન્થાલ્પી
(C) S < O < Cl < F વધુ ઋણ ઇલેક્ટ્રૉન-પ્રાપ્તિ ઍન્થાલ્પી
(D) H2O > H2S > H2Se > H2Te ઉષ્મીય સ્થિરતા
જવાબ
(A, D)
અહીં, વિધાન (B) અને (C)માં સાચો ક્રમ નીચે મુજબ લખી શકાય : (B) બાષ્પીભવન ઍન્થાલ્પીનો સાચો ક્રમ : AsH3 < PH3 < NH3 (C) વધુ ઋણ ઇલેક્ટ્રૉનપ્રાપ્તિ ઍન્થાલ્પીનો ક્રમ : S < O< F< Cl
પ્રશ્ન 8.
નીચેનામાંથી કાં વિધાન સાચાં છે ?
(A) H2S2O6 માં S-S બંધ છે.
(B) પેરોક્સૉસલ્ફ્યુરિક ઍસિડ (H2SO5)માં સલ્ફરની ઑક્સિડેશન અવસ્થા +6 છે.
(C) હેબર વિધિથી NH3ની બનાવટમાં ઉદ્દીપક તરીકે આયર્ન પાઉડર સાથે Al2O3 અને K2O વપરાય છે.
(D) SO2ના ઉદ્દીપકીય ઑક્સિડેશનથી SO3ની બનાવટ માટે ઍન્થાલ્પીનો ફેરફાર ધન છે.
જવાબ
(A, B)
- વિધાન (C) અને (D) ખોટાં છે જે નીચે મુજબ સુધારી શકાય.
- (C) NH3 વાયુની બનાવટમાં આયર્ન ઑક્સાઇડ સાથે Al2O3 અને K2O થોડા પ્રમાણમાં ઉદ્દીપક તરીકે વપરાય છે.
- (D) SO2ના ઉદ્દીપકીય ઑક્સિડેશન દ્વારા SO3 મેળવવાની પ્રક્રિયા માટે ઍન્થાલ્પીનું મૂલ્ય ઋણ મળે છે.
પ્રશ્ન 9.
નીચેનામાંથી કઈ પ્રક્રિયામાં સાંદ્ર H2SO4 ઑક્સિડેશનકર્તા તરીકે વર્તે છે ?
(A) CaF2 + H2SO4 → CaSO4 + 2HF
(B) 2HI + H2SO4 → I2 + SO2 + 2H2O
(C) Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
(D) NaCl + H2SO4 → NaHSO4 + HCl
જવાબ
(B, C)
ઉપર આપેલ સમીકરણો પૈકી (B) અને (C)માં H2SO4 નો ઑક્સિડેશનકર્તા તરીકેનો ગુણધર્મ જોવા મળે છે. આપણે જાણીએ છીએ કે જે પદાર્થનું રિડક્શન થાય તેને ઑક્સિડેશનકર્તા કહેવાય છે અને પ્રક્રિયા દરમિયાન તેના મધ્યસ્થ પરમાણુના ઑક્સિડેશન આંકમાં ઘટાડો થાય છે.

પ્રશ્ન 10.
નીચેનામાંથી કયા વિધાન સાચાં છે ?
(A) નિષ્ક્રિય વાયુઓના કણો વચ્ચેનું એકમાત્ર આકર્ષણ નિર્બળ વિક્ષેપન બળોને કારણે છે.
(B) આણ્વીય ઑક્સિજનની આયનીકરણ ઍન્થાલ્પી લગભગ ઝેનોન જેટલી હોય છે.
(C) XeF6 નું જળવિભાજન રેડોક્ષ પ્રક્રિયા છે.
(D) ઝેનોન ફ્લોરાઇડ સક્રિય નથી.
જવાબ
(A, B)
અહીં, વિધાન (C) અને (D) ખોટાં છે જે નીચે મુજબ સુધારી શકાય.
(C) XeF6 નું જળવિભાજન એ રેડોક્ષ પ્રક્રિયા નથી.

(D) ઝેનોનના ફ્લોરાઇડ ખૂબ જ સક્રિય હોય છે. તેનું થોડા પ્રમાણમાં પાણીની હાજરીમાં પણ ઝડપથી જળવિભાજન થાય છે.
![]()
ટૂંક જવાબી પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
સંપર્કવિધિ વડે H2SO4ના ઉત્પાદનમાં શા માટે SO3 પાણીમાં સીધો જ શોષિત (absorbed) થઈને H2SO4 બનાવતો નથી ?
ઉત્તર:
- સંપર્કવિધિ દ્વારા SO3 વાયુને પાણીમાં શોષી સીધો જ H2SO4 બનાવી શકાય નહીં કારણ કે આ પ્રક્રિયા ખૂબ જ ઉષ્માક્ષેપક પ્રક્રિયા છે અને તેમાં ઍસિડનો ખૂબ ધુમાડો ઊડે છે. આથી પ્રક્રિયા ખૂબ મુશ્કેલ બને છે.
- આમ, SO3માંથી સીધો જ H2SO4 બનાવી શકાય નહીં.
પ્રશ્ન 2.
NH3નું વાતાવરણના ઓક્સિજન વડે ઉદ્દીપકીય ઑક્સિડેશન માટે રાસાયણિક પ્રક્રિયાનું સમતોલિત સમીકરણ લખો.
ઉત્તર:
NH3નું વાતાવરણના ઑક્સિજન વડે ઉદ્દીપકીય ઑક્સિડેશન Rh / Pt જેવા ઉદ્દીપકની હાજરીમાં 500 K તાપમાને તથા 9 બાર દબાણે થતા નાઇટ્સ ઑક્સાઇડ મળે છે જેને સંતુલિત સ્વરૂપે નીચે મુજબ લખી શકાય.

પ્રશ્ન 3.
પાયરોફોસ્ફોરિક એસિડનું બંધારણ દોરો.
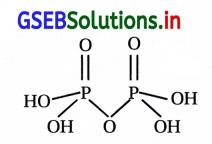
ઉત્તર:
પાયરૉફૉસ્ફોરિક ઍસિડનું આણ્વીયસૂત્ર H4P2O7 છે. જેનું બંધારણ નીચે મુજબ છે.
પ્રશ્ન 4.
PH3ને પાણીમાં ધીમેથી પસાર કરતાં પરપોટા બનાવે છે પરંતુ NH3 તરત જ દ્રાવ્ય થાય છે ? સમજાવો. શા માટે ?
ઉત્તર:
- PH3 અને NH3ની પાણીમાં દ્રાવ્યતા H-બંધના સંદર્ભમાં સમજાવી શકાય છે. NH3 પાણીમાં H બંધ બનાવે છે.
- આથી તે NH3 પાણીમાં દ્રાવ્ય છે, જ્યારે PH3 પાણીમાં H બંધ બનાવતો નથી. આથી તે પાણીમાં વાયુ સ્વરૂપે જ રહે છે અને તેનાં જ પરપોટા જોવા મળે છે.
પ્રશ્ન 5.
PCl5માં ફોસ્ફરસનું સંકરણ sp3d છે, પરંતુ તેના બધા પાંચ બંધ સમાન નથી. તમારા ઉત્તરને યોગ્ય કારણ આપી સમજાવો.
ઉત્તર:
- Nyou tubePCl5 બંધારણ ત્રિકોણીય દ્વિપિરામિડ સ્વરૂપનું હોય છે અને તેમાં બે P – Cl બંધ અક્ષીય હોય છે અને ત્રણ P – Cl બંધ નિરક્ષીય હોય છે. તેમાં બે પ્રકારની બંધલંબાઈ પણ જોવા મળે છે.
(i) અક્ષીય બંધલંબાઈ
(ii) નિરક્ષીય બંધલંબાઈ
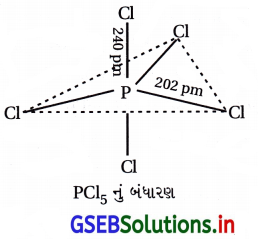
- બંધલંબાઈના તફાવત પાછળ અક્ષીય બંધોનું નિરક્ષીય બંધો કરતાં વધારે થતું અપાકર્ષણ જવાબદાર છે.
પ્રશ્ન 6.
શા માટે નાઇટ્રિક ઑક્સાઇડ વાયુમય અવસ્થામાં અનુચુંબકીય છે પરંતુ ઠંડો કરીને ઘન-અવસ્થામાં મેળવેલા તે પ્રતિચુંબકીય છે ?
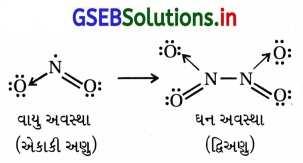
ઉત્તર:
- વાયુ અવસ્થામાં NO2 એકાકી અણુ સ્વરૂપે હોય છે. તેમાં નાઇટ્રોજન પાસે એક અયુગ્મિત ઇલેક્ટ્રૉન હોય છે. જ્યારે ઘન અવસ્થામાં તે દ્વિઅણુ સ્વરૂપે હોય છે. જે N2O4 બને છે.
- તેથી N2O4માં N પાસે અયુગ્મિત ઇલેક્ટ્રૉન હોતા નથી. આથી તે પ્રતિચુંબકીય બને છે.
![]()
પ્રશ્ન 7
કારણ આપો “ClF3 અસ્તિત્વ ધરાવે છે પરંતુ FCl3 અસ્તિત્વ ધરાવતો નથી.”
ઉત્તર:
ClF3 અને FCl3 માટે તેમના મધ્યસ્થ પરમાણુના આકાર પરથી જાણી શકાય છે કે તે અસ્તિત્વ ધરાવશે કે નહીં. કારણ કે Fનું કદ Cl કરતાં નાનું છે તથા તેની વિદ્યુતઋણતા Cl કરતાં વધારે હોય છે. આથી એક મોટો Cl પરમાણુ તેની આસપાસ ત્રણ નાના F પરમાણુ ગોઠવી શકે છે, પરંતુ આનાથી ઊલટું શક્ય બનશે નહીં.
પ્રશ્ન 8.
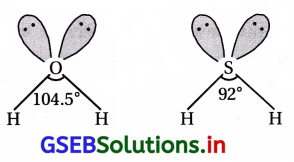
H2O અને H2S માં કોનો બંધકોણ વધુ છે ? શા માટે ?
ઉત્તર:
H2Oમાં (H-O-H = 104.5°) બંધકોણ H2Sના (H-S-S = 92°) બંધકોણ કરતાં મોટો છે. કારણ કે O સલ્ફર કરતાં વધુ વિદ્યુતઋણ છે. આમ, H2Oમાં ઑક્સિજનની બે બંધકા૨ક કક્ષકો વચ્ચેનું અપાકર્ષણ H2S કરતાં વધારે હોય છે.
પ્રશ્ન 9.
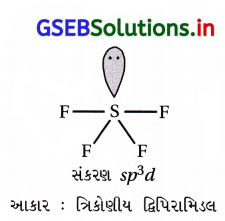
SF6 જાણીતો છે પરંતુ SCl6 નથી. શા માટે ?
ઉત્તર:
- F ૫૨માણુ કદમાં ઘણો નાનો હોય છે. આમ Sની આસપાસ 6F– આયન ગોઠવાઈ શકે છે. જ્યારે Clનું કદ મોટું હોય છે.
- આથી Cl– આયન વચ્ચે અપાકર્ષણ વધારે થાય છે. આથી Sની આસપાસ છ Cl– ગોઠવાઈ શકતા નથી.
પ્રશ્ન 10.
ફૉસ્ફરસની Cl2 વાયુ સાથેની પ્રક્રિયાથી બે હેલાઇડ A અને B મળે છે. હેલાઇડ A પીળાશ પડતો સફેદ રંગનો પાઉડર છે, જ્યારે B રંગવિહીન તૈલી પ્રવાહી છે. A અને B ને ઓળખો તથા તેમના જળવિભાજનની નીપજો લખો.
ઉત્તર:
ફૉસ્ફરસની Cl2 સાથે પ્રક્રિયા દ્વારા બે પ્રકારની નીપજ મળે છે. જે ‘A’ અને ‘B’ છે. જ્યાં A → PCl5 અને B → PCl3
P4 + 10 Cl2 → 4 PCl5 (A)
P4 + 6 Cl2 → 4 PCl3 (B)
જ્યારે (A) અને (B)નું જળવિભાજન થાય ત્યારે નીચે પ્રમાણે પ્રક્રિયા થાય છે.

પ્રશ્ન 11.
\(\mathrm{NO}_3^{-}\) આયનની વીંટી કસોટીમાં Fe2+ આયન નાઇટ્રેટ આયનનું નાઇટ્રિક ઑક્સાઇડમાં રિડક્શન કરે છે. જે Fe(aq) આયન સાથે સંયોજાઈને કથ્થાઈ રંગનો સંકીર્ણ બનાવે છે. કથ્થાઈ રંગની વીંટી બનાવવાની પ્રક્રિયાનાં સમીકરણ લખો.
ઉત્તર:
- \(\mathrm{NO}_3^{-}\) + 3Fe2+ + 4H+ → NO + 3Fe3+ + 2H2O

- આ પ્રક્રિયાને કથ્થાઇ સંકીર્ણ કસોટી કહે છે જે સામાન્ય રીતે \(\mathrm{NO}_3^{-}\) આયનની પરખ કસોટી છે.
પ્રશ્ન 12.
સમજાવો’ : ક્લોરિનના ઑક્સોએસિડમાં નીચે આપેલ ક્રમ મુજબ સ્થિરતા વધે છે :
HClO < HClO2 < HClO3 < HClO4
ઉત્તર:
- ઑક્સિજન ક્લોરિન કરતાં વધારે વિદ્યુતઋણ છે. આમ Cl પર રહેલા ઋણ વીજભાર ઑક્સિજનની સંખ્યા વધતા વધારે વિખેરાય છે અને આથી ઋણ આયનની સ્થાયિતા નીચેના ક્રમમાં વધે છે.
ClO– < \(\mathrm{ClO}_2^{-}\) < \(\mathrm{ClO}_3^{-}\) < \(\mathrm{ClO}_4^{-}\) - સંયુગ્મી બેઇઝની સ્થાયિતા વધતા તેની ઍસિડિક પ્રબળતા નીચેના ક્રમમાં વધે છે.
HClO < HClO2 < HClO3 < HClO4
![]()
પ્રશ્ન 13.
સમજાવો : શા માટે ઑક્સિજન કરતાં ઓઝોન ઉષ્માગતિકીય રીતે ઓછો સ્થાયી છે.
ઉત્તર:
- ઓઝોન ઑક્સિજન કરતાં ઉષ્માગતિકીય રીતે ઓછો સ્થાયી છે. કારણ કે તેનું (O3નું) વિઘટન થતા O2 મળે છે અને આ પ્રક્રિયા દરમિયાન ખૂબ જ ઉષ્મા મુક્ત થાય છે (ΔH ઋણ) અને તેની ઍન્ડ્રૉપીમાં (ΔS ધન થાય છે) વધારો થાય છે.
- આમ, આ બન્ને પરિસ્થિતિમાં ગિબ્સની મુક્ત ઊર્જા (ΔG) વધારે ઋણ બને છે. આમ, ઓઝોનમાંથી ઑક્સિજન બને છે.
પ્રશ્ન 14.
P4O6 ની પાણી સાથેની પ્રક્રિયા P4O6 + 6H2O → 4H3PO3 છે, તો 1.1 g P4O6 ને H2O માં ઓગાળીને બનાવેલ ઍસિડના તટસ્થીકરણ માટે 0.1 M NaOH ના દ્રાવણનું કેટલું કદ જરૂરી છે તેની ગણતરી કરો.
ઉત્તર:
- H3PO3 નું સંતુલન NaOH સાથે નીચે મુજબ થશે.
H3PO3 + 2NaOH → Na2HPO3 + 2H2O …………. (1)
તથા P4O6 + 6H2O → 4H3PO3 …………. (2)
સમીકરણ (1)ને 4 વડે ગુણતાં,
4H3PO3 + 8NaOH → 4Na2HPO3 + 8H2O ……. (3)
સમીકરણ (2) અને (3)નો સરવાળો કરતાં,

- 1 મોલ P4O6 વડે મળતી નીપજનું તટસ્થીકરણ કરવા 8 મોલ NaOH જોઈએ તો \(\frac{1}{200}\) મોલ P4O6 વડે મળતી નીપજનું તટસ્થીકરણ કરવા કેટલા મોલ NaOH જોઈએ ?

કદ = 0.4 લિટર
= 400 મિલી
- આમ, 400 મિલી NaOHની જરૂર પડશે.
પ્રશ્ન 15.
સફેદ ફૉસ્ફરસની ક્લોરિન સાથે પ્રક્રિયા થવાથી મળતી નીપજનું પાણીની હાજરીમાં જળવિભાજન થાય છે. તો 62g સફેદ ફૉસ્ફરસની ક્લોરિન સાથે પ્રક્રિયા થવાથી ઉત્પન્ન
થતી નીપજનું પાણીની હાજરીમાં જળવિભાજન થવાથી મળતા HCl નું વજન ગણો.
ઉત્તર:
- P4 + 6Cl2 → 4PCl3 …………. (1)
PCl3 + 3H2O → H3PO3 + 3HCl ……… (2)
સમીકરણ (2)ને 4 વડે ગુણતાં,
4PCl3 + 12H2O → 4H3PO3 + 12HCl ……… (3)
સમીકરણ (3) અને સમીકરણ (1)નો સરવાળો કરતાં,

- 124 gm સફેદ ફૉસ્ફરસ 438 gm HCl આપે છે તો 62 gm સફેદ ફૉસ્ફરસ કેટલા gm HCl આપશે ?
HClનું દળ = \(\frac{438}{124}\) × 62 = 219.0 gm HCl
પ્રશ્ન 16.
નાઇટ્રોજનના ત્રણ ઑક્સોએસિડનાં નામ આપો. નાઇટ્રોજનના એ ઑક્સોએસિડની વિષમીકરણ પ્રક્રિયા લખો જેમાં નાઇટ્રોજનની ઑક્સિડેશન અવસ્થા +3 હોય છે.
ઉત્તર:
- નાઇટ્રોજનના ત્રણ ઑક્સોઍસિડમાં નાઇટ્રોજનની ઑક્સિડેશન અવસ્થા + 3 હોય છે.
(a) HNO2 નાઇટ્રસ ઍસિડ
(b) HNO3 નાઇટ્રિક ઍસિડ
(c) હાઇપોનાઇટ્રસ ઍસિડ H2N2O2 - વિષમીકરણ પ્રક્રિયા : 3HNO2 → HNO3 + H2O + 2NO
પ્રશ્ન 17.
નાઇટ્રિક એસિડની P4O10 સાથે પ્રક્રિયા કરતાં નાઇટ્રોજનનો ઑક્સાઇડ મળે છે. આ પ્રક્રિયાનું સમીકરણ લખો તથા બનતા નાઇટ્રોજનની ઑક્સાઇડનાં સસ્પંદન સૂત્ર લખો.
ઉત્તર:
HNO3ની P4O10 સાથેની પ્રક્રિયા દ્વારા N2O5 મળે છે.
4HNO3 + P4O10 → 4HPO3 + 2N2O5 N2O5નું સસ્પંદનીય બંધારણ નીચે મુજબ છે.
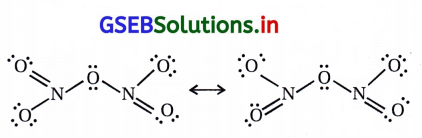
પ્રશ્ન 18.
ફોસ્ફરસનાં ત્રણ અપરરૂપો છે : (i) સફેદ ફૉસ્ફરસ (ii) લાલ ફૉસ્ફરસ (iii) કાળો ફૉસ્ફરસ. બંધારણ અને પ્રતિક્રિયાત્મકતાના આધારે સફેદ અને લાલ ફૉસ્ફરસ વચ્ચેનો ભેદ સ્પષ્ટ કરો.
ઉત્તર:
| સફેદ ફૉસ્ફરસ | લાલ ફૉસ્ફરસ | કાળો ફૉસ્ફરસ |
| (i) તે સૌથી અસ્થાયી સ્વરૂપ છે. | તે સફેદ ફૉસ્ફરસ કરતાં વધુ સ્થાયી સ્વરૂપ છે. | તે ત્રણે સ્વરૂપમાં સૌથી વધારે સ્થાયી સ્વરૂપ છે. |
(ii) તેની પ્રતિક્રિયાત્મકતા સૌથી વધારે છે. |
તે સફેદ ફૉસ્ફરસ કરતાં ઓછો પ્રતિક્રિયાત્મક છે.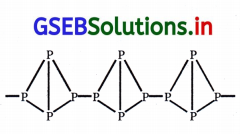 |
તે સૌથી ઓછો પ્રતિક્રિયાત્મક છે.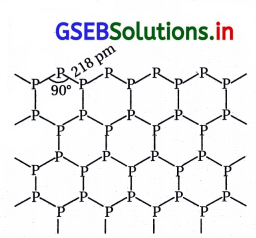 |
| (iii) તેનો આકાર સમચતુલકીય છે. | તેનું બંધારણ પૉલિમર પ્રકારનું છે. | તેનું બંધારણ સ્તરીય હોય છે. |
![]()
પ્રશ્ન 19.
નાઇટ્રિક ઍસિડની સાંદ્રતાની અસર ઑક્સિડેશન નીપજના નિર્માણ ઉપર દર્શાવતાં ઉદાહરણ આપો.
ઉત્તર:
ઑક્સિડેશનની નીપજોનો આધાર ઍસિડની સાંદ્રતા, તાપમાન અને પદાર્થના સ્વભાવ પર આધારિત છે. જુદી જુદી સાંદ્રતા ધરાવતો નાઇટ્રિક ઍસિડ Cu ધાતુ સાથે અલગ અલગ નીપજ આપે છે.
3Cu + 8HNO3 (મંદ) →3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 (સાંદ્ર) → Cu(NO3)2 + 2NO2 + 2H2O
પ્રશ્ન 20.
સિલ્વરના બારીક ભૂકા સાથે PCl5 ની પ્રક્રિયામાં ગરમ કરતાં સફેદ સિલ્વર ક્ષાર મળે છે જે વધુ પ્રમાણમાં NH3ના જલીય દ્રાવણમાં દ્રાવ્ય થાય છે. આ ઘટનાને દર્શાવતી રાસાયણિક પ્રક્રિયા લખો.
ઉત્તર:
- PCl5ની ચાંદીના ભૂકા સાથે પ્રક્રિયા કરતાં સિલ્વર હેલાઇડ મળે છે.
PCl5 + 2Ag → 2AgCl + PCl3 - AgClની વધારે એમોનિયાના દ્રાવણ સાથે પ્રક્રિયા કરતાં દ્રાવ્ય સંકીર્ણ [Ag(NH3)2]+ Cl–(aq) મળે છે.

પ્રશ્ન 21.
ફૉસ્ફરસ ઘણા બધા ઑક્સોઍસિડ બનાવે છે. આ બધા ઑક્સોએસિડમાં ફૉસ્ફિનિક ઍસિડ પ્રબળ રિડક્શનકર્તા ગુણધર્મ ધરાવે છે. તેનું બંધારણ લખો અને તેનો રિડક્શનકર્તા ગુણધર્મ દર્શાવતી એક પ્રક્રિયા લખો.
ઉત્તર:
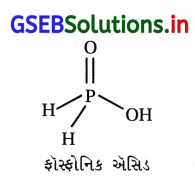
4AgNO3 + 2H2O + H3PO2 → 4Ag↓ + 4HNO3 + H3PO4
આ સમીકરણ તેની પ્રબળ રિડક્શનકર્તા ગુણધર્મ દર્શાવે છે.
જોડકાં જોડો
પ્રશ્ન 1.
કૉલમ – I માં આપેલાં સંયોજનોને કૉલમ – II માં આપેલ સંકરણ અને આકારના સાચા વિકલ્પ સાથે જોડો.
| કોલમ – I | કોલમ – II |
| (A) XeF6 | (1) sp3d3 – વિકૃત અષ્ટફલક |
| (B) XeO3 | (2) sp3d2 – સમતલીય ચોરસ |
| (C) XeOF4 | (3) sp3 – પિરામિડલ |
| (D) XeF4 | (4) sp3d2 – ચોરસ પિરામિડલ |
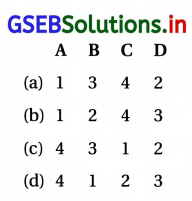
જવાબ
(a) (A – 1), (B – 3), (C – 4), (D – 2)
| કોલમ – I | કોલમ – II |
| (A) XeF6 | (1) sp3d3 – વિકૃત અષ્ટફલક |
| (B) XeO3 | (3) sp3 – પિરામિડલ |
| (C) XeOF4 | (4) sp3d2 – ચોરસ પિરામિડલ |
| (D) XeF4 | (2) sp3d2 – સમતલીય ચોરસ |
પ્રશ્ન 2.
કૉલમ – Iમાં ઑક્સાઇડનાં સૂત્રો ઓક્સાઇડના પ્રકાર સાથે કૉલમ – II સાથે જોડો.
| કોલમ – I | કૉલમ – II |
| (A) Pb3O | (1) તટસ્થ ઑક્સાઇડ |
| (B) N2O | (2) ઍસિડિક ઑક્સાઇડ |
| (C) Mn2O7 | (૩) બેઝિક ઑક્સાઇડ |
| (D) Bi2O3 | (4) મિશ્ર ઑક્સાઇડ |
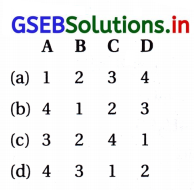
જવાબ
(b) (A – 4), (B – 1), (C – 2), (D – 3)
| કોલમ – I | કૉલમ – II |
| (A) Pb3O | (4) મિશ્ર ઑક્સાઇડ |
| (B) N2O | (1) તટસ્થ ઑક્સાઇડ |
| (C) Mn2O7 | (2) ઍસિડિક ઑક્સાઇડ |
| (D) Bi2O3 | (૩) બેઝિક ઑક્સાઇડ |
પ્રશ્ન 3.
કૉલમ – I ની વસ્તુઓને કૉલમ – II ના યોગ્ય વિકલ્પ સાથે જોડો.
| કોલમ – I | કૉલમ – II |
| (A) H2SO4 | (1) સૌથી વધુ ઇલેક્ટ્રોનપ્રાપ્તિ એન્થાલ્પી |
| (B) CCl3NO2 | (2) ચાલ્કોજન |
| (C) Cl2 | (3) અશ્રુવાયુ |
| (D) સલ્ફર | (4) સંગ્રાહક કોષ |
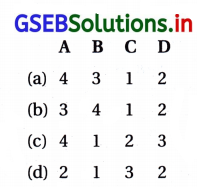
જવાબ
| કોલમ – I | કૉલમ – II |
| (A) H2SO4 | (4) સંગ્રાહક કોષ |
| (B) CCl3NO2 | (3) અશ્રુવાયુ |
| (C) Cl2 | (1) સૌથી વધુ ઇલેક્ટ્રોનપ્રાપ્તિ એન્થાલ્પી |
| (D) સલ્ફર | (2) ચાલ્કોજન |
![]()
પ્રશ્ન 4.
કૉલમ – I માં આપેલા સ્પિસીઝને કૉલમ – II માં આપેલા આકાર સાથે યોગ્ય વિકલ્પથી જોડો.
| કૉલમ – I | કોલમ – II |
| (A) SF4 | (1) સમચતુષ્કલકીય |
| (B) BrF3 | (2) પિરામિડલ |
| (C) \(\mathrm{BrO}_3^{-}\) | (૩) ચીચવો આકાર |
| (D) \(\mathrm{NH}_4^{+}\) | (4) વળેલો T-આકાર |
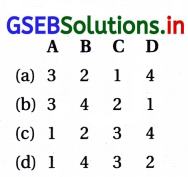
જવાબ
| કૉલમ – I | કોલમ – II |
| (A) SF4 | (૩) ચીચવો આકાર |
| (B) BrF3 | (4) વળેલો T-આકાર |
| (C) \(\mathrm{BrO}_3^{-}\) | (2) પિરામિડલ |
| (D) \(\mathrm{NH}_4^{+}\) | (1) સમચતુષ્કલકીય |
પ્રશ્ન 5.
કોલમ – I અને કૉલમ – II ની વસ્તુઓને સાચા વિકલ્પથી જોડો.
| કૉલમ – I | કોલમ – II |
| (A) તેનું અંશતઃ જળવિભાજનમાં કેન્દ્રસ્થ પરમાણુનો ઑક્સિડેશન આંક બદલાતો નથી. | (1) He |
| (B) તે ડૂબકી મારવાનાં(diving) આધુનિક સાધનોમાં વપરાય છે. | (2) XeF6 |
| (C) વિધુતના ગોળાઓને ભરવા માટે જરૂરી નિષ્ક્રિય વાતાવરણ ઉત્પન્ન કરવા માટે વપરાય છે. | (3) XeF4 |
| (D) તેનો કેન્દ્રસ્થ પરમાણુ sp3d2 સંકરણ ધરાવે છે. | (4) Ar |
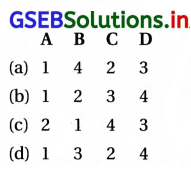
જવાબ
| કૉલમ – I | કોલમ – II |
| (A) તેનું અંશતઃ જળવિભાજનમાં કેન્દ્રસ્થ પરમાણુનો ઑક્સિડેશન આંક બદલાતો નથી. | (2) XeF6 |
| (B) તે ડૂબકી મારવાનાં(diving) આધુનિક સાધનોમાં વપરાય છે. | (1) He |
| (C) વિધુતના ગોળાઓને ભરવા માટે જરૂરી નિષ્ક્રિય વાતાવરણ ઉત્પન્ન કરવા માટે વપરાય છે. | (4) Ar |
| (D) તેનો કેન્દ્રસ્થ પરમાણુ sp3d2 સંકરણ ધરાવે છે. | (3) XeF4 |
વિધાન અને કારણ પ્રકારના પ્રશ્નો
નીચેના પ્રશ્નોમાં વિધાન (A) અને ત્યાર પછી કારણ (R) આપેલું છે. પ્રશ્નોની નીચે આપેલા વિકલ્પોમાંથી સાચો વિકલ્પ પસંદ કરો :
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે. (D) વિધાન (A) અને કારણ (R) બંને ખોટાં છે.
(E) વિધાન (A) ખોટું પરંતુ કારણ (R) સાચું છે.
પ્રશ્ન 1.
વિધાન (A) P4 કરતાં N2 ઓછો સક્રિય છે.
કારણ (R) : નાઇટ્રોજનની ઇલેક્ટ્રોન-પ્રાપ્તિ ઍન્થાલ્પી ફૉસ્ફરસ કરતાં વધુ છે.
જવાબ
(C) : વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે.
N2 એ P4 કરતાં ઓછો સક્રિય હોય છે. કારણ કે N2માં નાઇટ્રોજન-નાઇટ્રોજન વચ્ચે ત્રિબંધ (N = N) રચાય છે. આથી તેની બંધ વિયોજન ઊર્જા P4 કરતાં ખૂબ વધારે હોય છે.
પ્રશ્ન 2.
વિધાન (A) : HNO3 આયર્નને નિષ્ક્રિય બનાવે છે.
કારણ (R) : આયર્નની સપાટી ઉપર HNO3 ફેરિક નાઇટ્રેટનું રક્ષણાત્મક આવરણ બનાવે છે.
જવાબ
(C) વિધાન (A) સાચું છે પરંતુ કારણ (R) ખોટું છે.
HNO3 આયર્નની સપાટી પર આયર્ન ઑક્સાઇડનું નિષ્ક્રિય આવરણ બનાવે છે જેથી લોખંડ HNO3માં ઓગળતું નથી.
પ્રશ્ન 3.
વિધાન (A) KIની સાંદ્ર H2SO4 સાથેની પ્રક્રિયાથી HI બનવી શકાતો નથી.
કારણ (R) : બધા જ હેલોજન ઍસિડમાં HIની H−X બંધ ઊર્જા સૌથી ઓછી છે.
જવાબ
(B) વિધાન (A) અને કારણ (R) બંને સાચાં છે પરંતુ કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી નથી.
KIની સાંદ્ર H2SO4ની સાથેની પ્રક્રિયા દ્વારા HI બનતો નથી. કારણ કે HIમાંથી I2 વાયુ બની જાય છે આથી.
![]()
પ્રશ્ન 4.
વિધાન (A) હોમ્બિક અને મોનોક્લિનીક સલ્ફર બંને Sa તરીકે અસ્તિત્વ ધરાવે છે પરંતુ ઑક્સિજન O2 તરીકે અસ્તિત્વ ધરાવે છે.
કારણ (R) : ઑક્સિજન તેના નાના કદ અને નાની બંધલંબાઈને કારણે pπ-pπ બે બંધ બનાવે છે, પરંતુ સલ્ફરમાં બંધ શક્ય નથી.
જવાબ
(A) વિધાન (A) અને કારણ (R) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
બન્ને ર્હોમ્બિક તથા મોનોક્લિનિક સલ્ફર S8 પ્રકારનો અણુ આપે છે પણ ઑક્સિજન O2 પ્રકારનો અણુ આપે છે. કારણ કે નાના કદના કારણે ઑક્સિજન અણુ pT-p પ્રકારના બહુબંધ બનાવે છે. પરંતુ સલ્ફરનું કદ મોટું હોવાથી તે આ પ્રકારના બંધ બનાવી શકશે નહીં.
પ્રશ્ન 5.
વિધાન (A) : NaClની સાંદ્ર H2SO4 સાથેની પ્રક્રિયાથી તીવ્રવાસવાળા રંગહીન ધુમાડા મળે છે. પરંતુ તેમાં MnO2 ઉમેરતાં ધુમાડા લીલાશ પડતા પીળા બને છે.
કારણ (R) : HCLનું ઑક્સિડેશન MnO2 વડે ક્લોરિનમાં થાય છે જે લીલાશ પડતો પીળો છે.
જવાબ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
- જ્યારે NaClની સાંદ્ર H2SO4 સાથે પ્રક્રિયા કરતા રંગવિહીન તીવ્ર વાસ ધરાવતા HClના ધુમાડા મળે છે.
NaCl + H2SO4 → Na2SO4 + 2HCl - પણ તેમાં MnO2 ઉમેરતાં HClમાંથી Cl2 બનતા તેનો રંગ લીલાશ પડતો પીળો થાય છે.
પ્રશ્ન 6.
વિધાન (A) : SF6 નું જળવિભાજન નથી થતું પરંતુ SF4નું થાય છે.
કારણ (R) : SF6 માં 6 F પરમાણુ તેના સલ્ફર પરમાણુ ઉપર H2O ના હુમલાને અટકાવે છે.
જવાબ
(A) વિધાન (A) અને કારણ (B) બંને સાચાં છે તથા કારણ (R)એ વિધાન (A)ની સાચી સમજૂતી છે.
SF4નું જળવિભાજન થઈ શકે છે પણ SF6માં 6 પરમાણુ H2Oના અણુને S સાથે જોડાવા દેતા નથી. આમ, SF6નું જળવિભાજન થઈ શકશે નહીં.
સવિસ્તર પ્રકારના પ્રશ્નો
પ્રશ્ન 1.
એક અસ્ફટિકમય પદાર્થ A ને હવાની હાજરીમાં સળગાવતાં વાયુ B મળે છે, જે ચૂનાના પાણીને દૂધિયું બનાવે છે. સલ્ફાઇડયુક્ત કાચી ધાતુના ભૂંજન દરમિયાન પણ આ વાયુ આડપેદાશ તરીકે મળે છે. આ વાયુ એસિડિક KMnO4ના જલીય દ્રાવણને રંગહીન બનાવે છે અને Fe3+નું Fe+2માં રિડક્શન કહે છે. તો ઘન પદાર્થ A અને વાયુ B ને ઓળખો તથા પ્રક્રિયાનાં સમીકરણો લખો.
ઉત્તર:
સલ્ફાઇડ ખનીજનું ભૂંજન કરતાં આડપેદાશ તરીકે SO2 વાયુ મળે છે. આથી ઘન A એ S8 હશે અને વાયુ B એ SO2 વાયુ હશે.
પ્રક્રિયા :

પ્રશ્ન 2.
લેડ(II) નાઇટ્રેટને ગરમ કરતાં કથ્થાઈ રંગનો વાયુ A મળે છે. વાયુ A ને ઠંડો પાડતા રંગહીન ઘન પદાર્થ B મળે છે. ઘન પદાર્થ B ને NO સાથે ગરમ કરતાં તે વાદળી રંગના ઘન પદાર્થ Cમાં રૂપાંતરિત થાય છે. A, B અને C ને ઓળખો તથા પ્રક્રિયા માટે જરૂરી સમીકરણ લખો અને A, B અને Cનાં બંધારણ દોરો.
ઉત્તર:
Pb(NO3)2ને ગરમ કરતાં કથ્થાઈ રંગનો વાયુ NO2 મળે છે. તેને ઠંડું પાડતાં N2O4 બને છે અને તેને NO સાથે ગરમ કરતાં N2O3 બને છે.

![]()
પ્રશ્ન 3.
સંયોજન A ને ગરમ કરતાં તે વાયુ B આપે છે જે હવાનો ઘટક છે. આ વાયુની 3 મોલ હાઇડ્રોજન સાથે ઉદ્દીપકની હાજરીમાં પ્રક્રિયા કરતાં અન્ય વાયુ C આપે છે જે બેઝિક ગુણધર્મ ધરાવે છે. વાયુ Cને ભેજવાળા વાતાવરણમાં ઑક્સિડાઇઝ કરતાં તે સંયોજન D આપે છે જે ઍસિડ વર્ષાનો ભાગ છે, તો A થી D સુધીનાં સંયોજનોને ઓળખો અને દરેક તબક્કામાં સમાવિષ્ટ (involved) પ્રક્રિયાઓ લખો.
ઉત્તર:
- હવાના મુખ્ય બે ઘટકો N2 (78%) તથા O2 (21%) હોય છે. માત્ર N2જ ત્રણ મોલ H2 2ાથે પ્રક્રિયા કરી NH3(g) એમોનિયા વાયુ મળે છે. જે સ્વભાવે બેઝિક હોય છે. તેનું (NH3નું) ઑક્સિડેશન કરતાં NO2 વાયુ મળે છે જે ઍસિડ વર્ષાનો એક ઘટક છે.
- આમ સંયોજનો A થી D આ મુજબ હશે.
A = NH4NO2, B = N2, C = NH3, D = HNO3
પ્રક્રિયા સમીકરણો :
