Gujarat Board GSEB Solutions Class 9 Science Chapter 3 પરમાણુઓ અને અણુઓ Textbook Questions and Answers, Intext Questions, Textbook Activites Pdf.
પરમાણુઓ અને અણુઓ Class 9 GSEB Solutions Science Chapter 3
GSEB Class 9 Science પરમાણુઓ અને અણુઓ Textbook Questions and Answers
સ્વાધ્યાયના પ્રશ્નોત્તર
પ્રશ્ન 1.
ઑક્સિજન અને બોરોન ધરાવતા એક સંયોજનના 0.24g ડે નમૂનામાં 0.096 g બોરોન અને 0.144 g ઑક્સિજન હાજર છે, હું તી વજનથી સંયોજનના ટકાવાર પ્રમાણની ગણતરી કરો.
ઉત્તર:
![]()
સંયોજનનું વજન બોરોન તત્ત્વનું ટકાવાર પ્રમાણ = \(\frac{0.096}{0.24}\) × 100.
= 40
ઑક્સિજન તત્ત્વનું ટકાવાર પ્રમાણ = \(\frac{0.144}{0.24}\) × 100
= 60
આમ, બોરોન અને ઑક્સિજન ધરાવતા સંયોજનમાં ટકાવાર પ્રમાણ અનુક્રમે 40 અને 60 છે.
પ્રશ્ન 2.
8g ઑક્સિજનમાં જ્યારે 3g કાર્બનનું દહન કરવામાં આવે ત્યારે 11 હુ કાર્બન ડાયોક્સાઈડ બને છે. જ્યારે ૩g કાર્બનને 50 g ઑક્સિજનમાં દહન કરવામાં આવે ત્યારે કેટલા ગ્રામ કાર્બન ડાયૉક્સાઈડ બનશે? રાસાયણિક સંયોગીકરણનો કયો નિયમ તમારા જવાબ માટે દિશા સૂચવે છે?
ઉત્તર:
કાર્બનનું ઑક્સિજનની હાજરીમાં દહન સમીકરણ નીચે મુજબ છે:
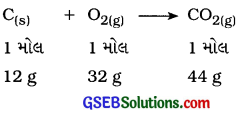
સમીકરણ પરથી કહી શકાય કે, 12 g કાર્બનનું દહન 32 g 3 ઑક્સિજનની હાજરીમાં થવાથી 44 g કાર્બન ડાયૉક્સાઈડ મળે છે.
આથી ૩ g (\(\frac{1}{4}\) મોલ કાર્બનનું 8g [\(\frac{1}{4}\) મોલ] ઑક્સિજનની હાજરીમાં દહન થવાથી 11g [\(\frac{1}{4}\) મોલ] કાર્બન ડાયોક્સાઇડ મળે છે.
આમ, જ્યારે 3 g કાર્બનનું 50 g ઑક્સિજનની હાજરીમાં દહન કરવામાં આવે ત્યારે 11 g કાર્બન ડાયૉક્સાઈડ બનશે. આ જવાબ નિશ્ચિત પ્રમાણના નિયમ તરફ દોરી જાય છે.
![]()
પ્રશ્ન 3.
બહુપરમાણ્વીય આયન એટલે શું? ઉદાહરણ આપો.
ઉત્તરઃ
પરમાણુઓનો સમૂહ કે જે આયનની માફક વર્તે છે, તેને ? બહુપરમાણ્વીય આયન કહે છે.
અથવા
એક કરતાં વધુ પરમાણુ ધરાવતા આયનને બહુપરમાવીય આયન કહે છે.
ઉદાહરણઃ NH4 1+: એમોનિયમ આયન
CO3 2-: કાર્બોનેટ આયન
SO4 2-: સલ્ફટ આયન
PO4 3-, ફૉસ્ફટ આયન
પ્રશ્ન 4.
નીચે દર્શાવેલાં સંયોજનોનાં રાસાયણિક સૂત્રો લખો:
(a) મૅગ્નેશિયમ ક્લોરાઇડ
ઉત્તર:
મૅગ્નેશિયમ ક્લોરાઇડ :
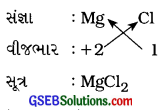
(b) કૅલ્શિયમ ઑક્સાઇડ
ઉત્તર:
કૅલ્શિયમ ઑક્સાઇડ :
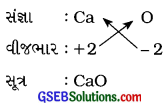
(c) કૉપર નાઇટ્રેટ
ઉત્તર:
કૉપર નાઇટ્રેટ :
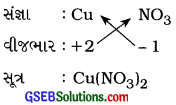
(d) ઍલ્યુમિનિયમ ક્લોરાઇડ
ઉત્તર:
ઍલ્યુમિનિયમ ક્લોરાઈડ:
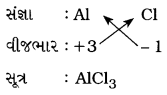
(e) કૅલ્શિયમ કાર્બોનેટ
ઉત્તર:
કૅલ્શિયમ કાર્બોનેટ :
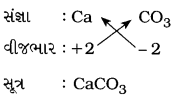
પ્રશ્ન 5.
નીચે દર્શાવેલાં સંયોજનોમાં હાજર રહેલ તત્ત્વોનાં નામ જણાવો
(a) ક્વિક લાઇમ
(b) હાઈડ્રોજન બ્રોમાઈડ
(c) બેકિંગ પાઉડર
(d) પોટેશિયમ સલ્ફટ
ઉત્તર:
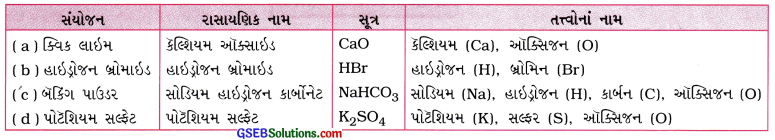
પ્રશ્ન 6.
નીચેના પદાર્થોના મોલર દળની ગણતરી કરો :
(a) ઇથાઇન (C2H2),
ઉત્તર:
ઇથાઇન C2H2 = 2 (Cનું પરમાણ્વીય દળ) + 2 (Hનું પરમાણ્વીય દળ)
= 2 (12) + 2 (1)
= 24 + 2 = 26 u
(b) સલ્ફર અણુ (S8),
ઉત્તર:
સલ્ફર અણુ S(S8) = 8 (Sનું પરમાણ્વીય દળ)
= 8 (32)
= 256 u
(c) ફૉસ્ફરસ અણુ (P4) (ફૉસ્ફરસનું પરમાણ્વીય દળ = 31 u),
ઉત્તર:
ફૉસ્ફરસ અણુ P4 = 4 (Pનું પરમાણ્વીય દળ)
= 4 (31)
= 124 u
(d) હાઇડ્રોક્લોરિક ઍસિડ (HCl),
ઉત્તર:
હાઇડ્રોક્લોરિક ઍસિડ HCl
= 1 (Hનું પરમાણ્વીય દળ) + 1 (CIનું પરમાણ્વીય દળ)
= 1 (1) + 1 (35.5)
= 36.5 u
(e) નાઇટ્રિક ઍસિડ (HNO3)
ઉત્તર:
નાઇટ્રિક ઍસિડ HNO3 = 1 (Hનું પરમાણ્વીય દળ) + 1 (Nનું પરમાણ્વીય દળ) + 3 (Oનું પરમાણ્વીય દળ)
= 1 (1) + 1 (14) + 3 (16)
= 63 u
![]()
પ્રશ્ન 7.
નીચેનાનાં દળ શું હશે?
(a) 1 મોલ નાઇટ્રોજન પરમાણુ
ઉત્તર:
1 મોલ નાઇટ્રોજન પરમાણુનું દળ = 14g
(b) 4 મોલ ઍલ્યુમિનિયમ પરમાણુ (ઍલ્યુમિનિયમનું પરમાણ્વીય દળ = 27 u)
ઉત્તર:
4 મોલ ઍલ્યુમિનિયમ પરમાણુનું દળ = 4 × 27
= 108 g
(c) 10 મોલ સોડિયમ સલ્ફાઇટ (Na2SO3)
ઉત્તર:
10 મોલ સોડિયમ સલ્ફાઇટ (Na2SO3)
1 મોલ Na2SO3નું દળ = 2 (Na) + 1 (S) + 3 (O)
= 2 (23) + 1 (32) + 3(16)
= 126 u
– 10 મોલ સોડિયમ સલ્ફાઇટનું દળ = 10 × 126
= 1260 g
પ્રશ્ન 8.
નીચેનાનું મોલમાં રૂપાંતર કરો
(a) 12 g ઑક્સિજન વાયુ
ઉત્તર:
![]()
= \(\frac{12}{32}\)
= 0.375 મોલ
(b) 20 g પાણી
ઉત્તર:
![]()
= \(\frac{20}{18}\)
= 1.11 મોલ
(c) 22 g કાર્બન ડાયૉક્સાઇડ
ઉત્તર:
![]()
= \(\frac{22}{44}\)
= 0.5 મોલ
પ્રશ્ન 9.
નીચેનાનું દળ કેટલું થશે?
(a) 0.2 મોલ ઑક્સિજન પરમાણુ
ઉત્તર:
0.2 મોલ ઑક્સિજન પરમાણુનું દળ = 0.2 × 16
= 3.2 g
(b) 0.5 મોલ પાણીના અણુ
ઉત્તર:
0.5 મોલ પાણીના અણુનું દળ = 0.5 × 18
= 9.0 g
![]()
પ્રશ્ન 10.
16 g ઘન સલ્ફરમાં રહેલા અણુ (S)ની સંખ્યા ગણો.
ઉત્તર:
અણુની સંખ્યા =![]() × ઍવોગેડો અંક
× ઍવોગેડો અંક
N = \(\frac{m}{M}\) × N0
= 6 × 6.022 × 1023
= 0.876 × 1023
= 3.76 × 1022 અણુ
પ્રશ્ન 11.
0.051 g ઍલ્યુમિનિયમ ઑક્સાઇડમાં હાજર રહેલા ઍલ્યુમિનિયમ આયનની સંખ્યા ગણો.
(Hint : કોઈ પણ આયનનું દળ તે જ તત્ત્વના પરમાણુના દળ જેટલું હોય છે. ઍલ્યુમિનિયમનું પરમાણ્વીય દળ = 27 u)
ઉત્તર:
Al2O3નું મોલર દળ
= 2 (AIનું પરમાણ્વીય દળ) + 3(Oનું પરમાણ્વીય દળ)
= 2 (27) + 3 (16) = 102 u
![]()
= \(\frac{0.051}{102}\)
= 0.0005 = 5 × 10-4 મોલ
1 મોલ Al2O3માં Al3+ આયનની સંખ્યા
= 2 × 6.022 × 1023
5.0 × 10-4 મોલ Al2O3 માં A3+ આયનની સંખ્યા
= 2 × 6.022 × 1023 × 5 × 10-4
= 101 × 6.022 × 1023 × 10-4
= 6.022 × 1020 Al3+ આયન
GSEB Class 9 Science પરમાણુઓ અને અણુઓ Intext Questions and Answers
Intext પ્રશ્નોત્તર [પા.પુ. પાના નં. 32 )
પ્રશ્ન 1.
એક પ્રક્રિયામાં 5.8g સોડિયમ કાર્બોનેટ 6 g ઇથેનૉઇક ઍસિડ (ઍસિટિક ઍસિડ) સાથે પ્રક્રિયા પામે છે તથા 2.2 g કાર્બન ડાયૉક્સાઇડ, 0.9 g પાણી અને 8.2 g સોડિયમ ઇથેનૉએટ (સોડિયમ
એસિટેટ) નીપજ મળે છે. દર્શાવો કે આ અવલોકનો દ્રવ્ય-સંચયના નિયમનું સમર્થન કરે છે.
સોડિયમ કાર્બોનેટ + ઇથેનૉઇક ઍસિડ → સોડિયમ ઇથેનૉએટ + કાર્બન ડાયૉક્સાઇડ + પાણી
ઉત્તર:

પ્રક્રિયકોનું દળ = 5.3 + 6.0 = 11.3 ગ્રામ
નીપજોનું દળ = 8.2 + 0.9 + 2.2 = 11.3 ગ્રામ
આમ, પ્રક્રિયકોનું દળ = નીપજોનું દળ
જે સૂચવે છે કે આ અવલોકન દ્રવ્ય-સંચયના નિયમનું સમર્થન આપે છે.
પ્રશ્ન 2.
પાણી બનાવવા માટે હાઇડ્રોજન અને ઑક્સિજન દળથી 1: 8ના પ્રમાણમાં જોડાય છે, તો 3g હાઇડ્રોજન વાયુ સાથે સંપૂર્ણ પ્રક્રિયા કરવા માટે ઑક્સિજનનો કેટલો જથ્થો જરૂરી છે?
ઉત્તર:
પાણી બનાવવા માટે,
1 g હાઇડ્રોજન માટે જરૂરી ઑક્સિજન = 8 g
3g હાઇડ્રોજન માટે જરૂરી ઑક્સિજન = 8 × 3g
= 24g
આમ, 3 g હાઇડ્રોજન માટે જરૂરી ઑક્સિજનનું વજન = 24g
પ્રશ્ન 3.
ડાલ્ટનના પરમાણ્વીય સિદ્ધાંતની કઈ અભિધારણા દ્રવ્ય-સંચયના નિયમનું પરિણામ છે?
ઉત્તર:
દ્રવ્યનું સર્જન કે વિનાશ શક્ય નથી.” આ અભિધારણા દ્રવ્ય-સંચયના નિયમનું પરિણામ છે.
![]()
પ્રશ્ન 4.
ડાલ્ટનના પરમાણ્વીય સિદ્ધાંતની કઈ અભિધારણા નિશ્ચિત પ્રમાણના નિયમની સમજૂતી આપે છે?
ઉત્તર:
“કોઈ પણ સંયોજનમાં પરમાણુઓની સાપેક્ષ સંખ્યા અને પ્રકાર નિશ્ચિત હોય છે.” આ અભિધારણા નિશ્ચિત પ્રમાણના નિયમની સમજૂતી આપે છે.
Intext પ્રશ્નોત્તર (પા.પુ. પાના નં. 35)
પ્રશ્ન 1.
પરમાણ્વીય દળ એકમને વ્યાખ્યાયિત કરો.
ઉત્તર:
કાર્બન-12 સમસ્થાનિકના એક પરમાણુના દળના મા ભાગને પરમાણ્વીય દળ એકમ કહે છે. – તેને ‘u’ સંજ્ઞા વડે દર્શાવવામાં આવે છે.
પ્રશ્ન 2.
કોઈ એક પરમાણુને નરી આંખે જોવો શા માટે શક્ય નથી?
ઉત્તર:
દરેક તત્ત્વનો પરમાણુ અતિસૂક્ષ્મ હોવાથી નરી આંખે જોઈ શકાતો નથી.
Intext પ્રશ્નોત્તર (પા.પુ. પાના નં.39)
પ્રશ્ન 3.
રાસાયણિક સૂત્રો લખો
(i) સોડિયમ ઑક્સાઈડ
ઉત્તર:
સોડિયમ ઑક્સાઇડ :
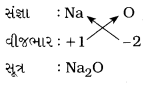
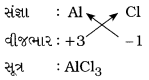
(ii) ઍલ્યુમિનિયમ ક્લોરાઈડ
ઉત્તર:
ઍલ્યુમિનિયમ ક્લોરાઈડ:
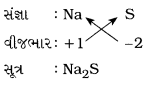
(iii) સોડિયમ સલ્ફાઈડ
ઉત્તર:
સોડિયમ સલ્ફાઈડ:
(iv) મૅગ્નેશિયમ હાઈડ્રૉક્સાઇડ
ઉત્તર:
મૅગ્નેશિયમ હાઈડ્રૉક્સાઇડ:
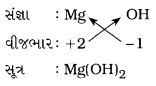
![]()
પ્રશ્ન 4.
નીચે દર્શાવેલ સૂત્રો ધરાવતાં સંયોજનોનાં નામ લખો :
(i) Al2(SO4)3
(ii) CaCl2
(iii) K2SO4
(iv) KNO3
(v) CaCO3
ઉત્તરઃ
| સંયોજન | સંયોજનનું નામ |
| (i) Al2(SO4)3 | ઍલ્યુમિનિયમ સલ્ફટ |
| (ii) CaCl2 | કૅલ્શિયમ ક્લોરાઇડ |
| (iii) K2SO4 | પોટેશિયમ સલ્ફટ |
| (iv) KNO3 | પોટેશિયમ નાઇટ્રેટ |
| (v) CaCO3 | કૅલ્શિયમ કાર્બોનેટ |
પ્રશ્ન 5.
‘રાસાયણિક સૂત્ર’ શબ્દનો અર્થ શું છે?
ઉત્તર:
સંયોજનમાં રહેલા ઘટકોનું સાપેક્ષ પ્રમાણ દર્શાવતા સૂત્રને રાસાયણિક સૂત્ર કહે છે.
પ્રશ્ન 6.
નીચેનામાં કેટલા પરમાણુઓ હાજર છે?
(i) H2S અણુ
ઉત્તરઃ
H2Sમાં બે હાઇડ્રોજન અને એક સલ્ફર એમ કુલ ત્રણ પરમાણુઓ હાજર છે.
(ii) PO43-, આયન
ઉત્તરઃ
PO43- આયનમાં એક ફૉસ્ફરસ અને ચાર ઑક્સિજન એમ કુલ પાંચ પરમાણુઓ હાજર છે.
![]()
Intext પ્રશ્નોત્તર (પા.પુ. પાના નં. 40)
પ્રશ્ન 1.
નીચેનાનાં આણ્વીય દળ ગણો
H2, O2, Cl2, CO2, CH4, C2H6, C2H4, NH3, CH3OH
ઉત્તરઃ
Hનું આણ્વીય દળ = 2 (Hનું પરમાણ્વીય દળ)
= 2 (1) = 2 u
→ O2નું આણ્વીય દળ = 2 (Oનું પરમાણ્વીય દળ)
= 2 (16) = 32 u
→ Cl2નું આવીય દળ = 2 (Clનું પરમાણ્વીય દળ)
= 2 (35.5) = 71 u
→ CO2 નું આણ્વીય દળ
= 1 (Cનું પરમાણ્વીય દળ) + 2 (Oનું પરમાણ્વીય દળ)
= 1 (12) + 2 (16)
= 12 + 32 = 44 u
→ CH4,(મિથેન)નું આવીય દળ
= 1 (Cનું પરમાણ્વીય દળ) + 4 (Hનું પરમાણ્વીય દળ)
= 1 (12) + 4 (1)
= 16 u
→ C2H6(ઇથેન)નું આવીય દળ
= 2 (Cનું પરમાણ્વીય દળ) + 6 (Hનું પરમાણ્વીય દળ)
= 2 (12) + 6 (1)
= 24 + 6 = 30 u
→ C2H4 (ઇથીન)નું આણ્વીય દળ
= 2 (Cનું પરમાણ્વીય દળ) + 4 (Hનું પરમાણ્વીય દળ)
= 2 (12) + 4 (1)
= 28 u
→ NH3(એમોનિયા)નું આવીય દળ
= 1 (Nનું પરમાણ્વીય દળ) + 3 (Hનું પરમાણ્વીય દળ)
= 1 (14) + 3(1) = 17 u
→ CH3OH(મિથેનોલ)નું આવીય દળ
= 1 (Cનું પરમાણ્વીય દળ) + 4 (Hનું પરમાણ્વીય દળ) + 1 (Oનું પરમાણ્વીય દળ)
= 1 (12) + 4 (1) + 1 (16)
= 32 u
પ્રશ્ન 2.
ZnO, Na2O, K2CO3, માટે સૂત્ર એકમ દળની રે ગણતરી કરો
‘Znનું પરમાણ્વીય દળ = 65u
Naનું પરમાણ્વીય દળ = 23u
Rનું પરમાણ્વીય દળ = 39 u
Cનું પરમાણ્વીય દળ = 12 u
Oનું પરમાણ્વીય દળ = 16u
ઉત્તરઃ
→ ZnOનું સૂત્ર એકમ દળ
= 1 (Znનું પરમાણ્વીય દળ) + 1 (Oનું પરમાણ્વીય દળ)
= 1 (65) + 1 (16)
= 81 u
→ Na2Oનું સૂત્ર એકમ દળ
= 2 (Naનું પરમાણ્વીય દળ) + 1 (0નું પરમાણ્વીય દળ)
= 2 (23) + 1 (16)
= 62 u
→ K2CO3 નું સૂત્ર એકમ દળ
= 2 (Kનું પરમાણવીય દળ) + 1 (Cનું પરમાણ્વીય દળ) + 3 (Oનું પરમાણ્વીય દળ)
= 2 (39) + 1 (12) + 3 (16)
= 78 + 12 + 48 = 138 u
Intext પ્રશ્નોત્તર [પા.પુ. પાના નં. 42 ]
પ્રશ્ન 1.
જો એક મોલ કાર્બન પરમાણુનું દળ 12 g હોય, તો કાર્બનના એક પરમાણુનું દળ કેટલું થશે?
ઉત્તરઃ

= 1.99 × 10-23 g
![]()
પ્રશ્ન 2.
100 ગ્રામ સોડિયમ અથવા 100 ગ્રામ લોખંડ પૈકી શેમાં પરમાણુની સંખ્યા વધુ હશે?
Naનું પરમાણ્વીય દળ = 23 u, Feનું પરમાણ્વીય દળ = 56 u
ઉત્તરઃ
![]()
Na(સોડિયમ)ના મોલ = \(\frac{100}{23}\) = 4.34 મોલ
Na પરમાણુની સંખ્યા = 4.34 × 6.022 × 1023
= 26.135 × 1023
= 2.6135 × 1024 Na પરમાણુ
Fe(લોખંડ)ના મોલ = \(\frac{100}{56}\) = 1.78 મોલ
Fe પરમાણુની સંખ્યા = 1.78 × 6.022 × 1023
= 10.71 × 1023
= 1.071 × 1024
આમ, 100 g સોડિયમ અને 100 g લોખંડ પૈકી 100 g સોડિયમમાં પરમાણુની સંખ્યા વધુ હશે.
GSEB Class 9 Science પરમાણુઓ અને અણુઓ Textbook Activities
પ્રવૃત્તિ 3.1 [પા.પુ. પાના નં. 31]
હેતુ : જ્યારે કોઈ રાસાયણિક ફેરફાર (પ્રક્રિયા) થાય ત્યારે દળમાં થતા ફેરફાર અંગેનો અભ્યાસ કરવો.
નીચે દર્શાવેલાં X અને Y રસાયણોનાં જૂથો પૈકી કોઈ એક જૂથ પસંદ કરો :
| X | Y |
| (i) કૉપર સલ્ફટ 1.25 g | સોડિયમ કાર્બોનેટ 1.43 g |
| (ii) બેરિયમ ક્લોરાઇડ 1.22 g | સોડિયમ સલ્ફટ 1.53g |
| (iii) લેડ નાઇટ્રેટ 2.07 g | સોડિયમ ક્લોરાઇડ 1.17 g |
- X અને Yમાં દર્શાવેલી યાદીમાંથી કોઈ એક યુગ્મના પદાર્થોનું પાણીમાં અલગ અલગ 10 mLનું દ્રાવણ તૈયાર કરો.
- એક કોનિકલ લાસ્કમાં નું દ્રાવણ લો અને એક નાની પ્રજ્વલન નળી(Ignition Tube)માં થોડી માત્રામાં X દ્રાવણ લો.
- પ્રજ્વલન નળીને સાવચેતીપૂર્વક કોનિકલ ફલાસ્કમાં એવી રીતે લટકાવો કે જેથી બે દ્રાવણો મિશ્ર થઈ ન જાય. ફલાસ્ક પર બૂચ લગાવો. (જુઓ આકૃતિ)

[આકૃતિ : X દ્રાવણ ધરાવતી પ્રજ્વલન નળીને Y દ્રાવણ ધરાવતા કોનિકલ ફલાસ્કમાં મૂકેલ છે.]
- ફલાસ્કનું તેમાં રહેલા ઘટકો સહિત કાળજીપૂર્વક વજન કરો.
- હવે લાસ્કને થોડો નમાવીને એવી રીતે ઘુમાવો કે જેથી તેમાં રહેલ X અને Y દ્રાવણો પરસ્પર મિશ્ર થઈ જાય.
- હવે ફરી વાર ફલાસ્કનું વજન કરો.
1. ફલાસ્કમાં શું પ્રક્રિયા થશે?
ઉત્તર:
દરેક કિસ્સામાં ફ્લાસ્ટમાં અવક્ષેપ (અદ્રાવ્ય પદાર્થ) ઉત્પન્ન થાય છે.
2. શું તમને લાગે છે કે કોઈ રાસાયણિક પ્રક્રિયા થઈ હશે?
ઉત્તર:
દરેક કિસ્સામાં લાસ્કમાં અવક્ષેપ મળતા હોવાથી પ્રક્રિયા થાય છે.
3. લાસ્કના મુખ પર બૂચ (કૉક) શા માટે લગાવીએ છીએ?
ઉત્તર:
લાસ્કના મુખ પર બૂચ લગાવવાથી ફલાસ્કને હલાવતાં તેમાંથી કોઈ દ્રવ્ય બહાર ઢોળાઈ ન શકે.
4. શું ફલા અને તેની અંદર રહેલા ઘટકોના દળમાં કોઈ ફેરફાર થાય છે?
ઉત્તર:
પ્રક્રિયા પહેલાં કે પછી ફલાસ્ક અને તેની અંદર રહેલા ઘટકોના દળમાં કોઈ ફેરફાર થતો નથી.
નિષ્કર્ષ : કોઈ પણ રાસાયણિક પ્રક્રિયામાં દ્રવ્યનું સર્જન કે વિનાશ થતો નથી.
![]()
પ્રવૃત્તિ 3.2 [પા.પુ. પાના નં. 36]
હેતુ સંયોજનના અણુઓમાં રહેલાં તત્ત્વોના પરમાણુઓની સંખ્યાનો ગુણોત્તર શોધવો.
- અણુઓમાં રહેલા પરમાણુઓના સાપેક્ષ દળ માટે કોષ્ટક 4 તથા તત્ત્વોના પરમાણ્વીય દળ માટે કોષ્ટક 2 જુઓ.
- કોષ્ટક 4માં આપેલ સંયોજનોના અણુઓમાં રહેલાં તત્ત્વોના પરમાણુઓની સંખ્યાનો ગુણોત્તર શોધો.
કોષ્ટક : કેટલાંક સંયોજનોના અણુઓ
| સંયોજન | સંયોજાતાં તત્ત્વો | દળથી ગુણોત્તર |
| પાણી | હાઇડ્રોજન, ઑક્સિજન | 1: 8 |
| એમોનિયા | નાઇટ્રોજન, હાઇડ્રોજન | 14 : 3 |
| કાર્બન ડાયૉક્સાઇડ | કાર્બન, ઑક્સિજન | 3: 8 |
પાણીના અણુઓમાંના પરમાણુઓની સંખ્યાનું પ્રમાણ નીચે મુજબ નોંધી શકાય છે :

- આમ, પાણી માટે પરમાણુઓની સંખ્યાનો ગુણોત્તર H: 0 = 2 : 1 ડે છે.
- એમોનિયાના અણુઓમાંના પરમાણુઓની સંખ્યાનું પ્રમાણ નીચે મુજબ નોંધી શકાય છે :

- આમ, એમોનિયા માટે પરમાણુઓની સંખ્યાનો ગુણોત્તર N: H = 1: ૩ છે.
- કાર્બન ડાયૉક્સાઇડના અણુઓમાંના પરમાણુઓની સંખ્યાનું પ્રમાણ નીચે મુજબ નોંધી શકાય છેઃ

આમ, કાર્બન ડાયોક્સાઇડ માટે પરમાણુઓની સંખ્યાનો ગુણોત્તર C: 0 = 1: 2 છે.
નિષ્કર્ષ : H2O, NH3 અને CO2માં પરમાણુઓની સંખ્યાનો 3 ગુણોત્તર અનુક્રમે 2: 1, 1: 3 અને 1 : 2 છે.